Заден план: Пренасищането на урината е един от ключовите фактори, определящи образуването на калциев оксалат (CaOx) в урината, а отделянето на оксалат и цитрат в урината са два ключови фактора. Всеки е повлиян от стомашно-чревни процеси.
Методи: Отворени и рандомизирани плацебо проучвания са изследвали ефекта на пероралните пробиотични препарати върху пренасищането на урината и екскрецията на оксалат. Проучванията в напречно сечение при хора са изследвали връзката на колонизационния статус на Oxalobacter formigenes и екскрецията на оксалат в урината и разпространението на пикочните камъни. Дефиниран е чревният микробиом на представителни животни, адаптиран към високооксалатна диета.
Резултати: Фекалното съдържание на O. formigenes, най-добре изследваният разградител на оксалати, варира в зависимост от състоянието на камъните. Опитите с пробиотици, предназначени да разграждат оксалати, включително тези, съдържащи O. formigenes, Lactobacillus и/или Bifidobacterium spp., Са разочароващи. Множество чревни сегменти на животни на диета с високо съдържание на оксалат съдържа разнообразни съобщества от микроорганизми, които могат да функционират заедно за разграждане и детоксикация на голямо количество оксалат.
Заключения: Въпреки че изглежда, че чревният микробиом играе роля за модифициране на стомашно-чревната абсорбция на литогенни вещества и следователно риск от камъни в урината, дали можем да разработим инструменти за неговото манипулиране и намаляване на този риск от бъбречни камъни, предстои да бъде определено.
Ключови думи: Калциев оксалат (CaOx); Лактобацили; микробиом; нефролитиаза; Oxalobacter formigenes
Изпратено на 30 септември 2016 г. Прието за публикуване на 12 октомври 2016 г.
Въведение
Биология на калциевия оксалат (CaOx) камъни в бъбреците
Урината на повечето хора е пренаситена и благоприятства кристализацията на CaOx. Поради това може би не е изненадващо, че 70% или повече камъни в бъбреците са съставени от CaOx (1). Като се има предвид, че урината на повечето хора е пренаситена за CaOx, може наистина да се чудим защо всички не образуват камъни. Въпреки това, въпреки че пренасищането е ключово и необходимо за образуването на камъни, други биологични събития също са замесени. Те включват образуването на закотвени предшественици в бъбреците, включително плаката на Рандал и събирателните канали (2-5), макромолекулите, които контролират скоростта на растеж и агрегация на кристали (6,7), и интернализация и обработка на кристали от клетките (8). Тези вторични фактори са разбрани само частично и в момента не подлежат на терапевтични интервенции.
За щастие се знае относително повече за контрола на пикочния състав на камънообразуващи соли. Основните фактори, които определят пренасищането на урината, включват отделянето на калций, оксалат, цитрат и вода в урината. От тях има сериозни доказателства, че генетиката оказва значително влияние върху отделянето на калций в урината (9), въпреки че диетата също е важен модификатор (10). Доказателствата също така сочат, че има наследствени компоненти на количеството на оксалат в урината, цитрат и дори вода (последният вероятно е медииран от жажда) (11). Въпреки това, най-вероятната среда (диета и прием/загуба на течности) са относително по-важни за определяне на състава на урината.
Оксалатна биология
Оксалатът е малка дикарбоксилна киселина, образувана като краен продукт на метаболизма от хората, до голяма степен в черния дроб (12). Оксалатът се среща и в някои растения, най-вече като CaOx кристали в стъблата и листата. Какъвто и оксалат да се генерира или абсорбира от диетата, той трябва да се елиминира с урината (13). Известно е, че поне три генетични дефекта причиняват първична хипероксалурия (PH), което води до свръхгенериране на оксалат в черния дроб (12). Дали други генетични вариации в тези или други гени са в основата на по-леката хипероксалурия в общата популация остава неизвестно.
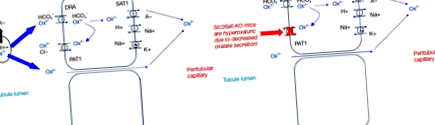
Тъй като оксалатът съществува в растенията е под формата на кристали CaOx, само малко количество е бионалично за абсорбция (обикновено около 10% или по-малко) (14). Смята се, че по-голямата част от анионния оксалат се абсорбира по парацелуларен път (Фигура 1) (15). Доказано е също, че апикалните и базолатералните транспортери имат активност, пренасяща оксалати in vitro. Обратно, ролята на трансцелуларния транспорт на оксалат в нормалната човешка биология остава неясна. Интересното е обаче, че нокаутирането на SLC26A6 (гена, който кодира PAT1) води до хипероксалурия поради намалена секреция на оксалат в лумена на червата при мишки (16,17). По този начин се предполага, че повишеното разграждане на оксалат от чревния микробиом може да създаде движеща сила за оксалатната част в червата и следователно да намали отделянето на урина. Освен това някои бактерии могат да отделят разтворими фактори, които повишават активността на PAT1 (18).
По-голямата част от оксалат се елиминира чрез бъбреците чрез филтрация. По-малко количество може да се секретира в проксималния канал. Количеството на секрецията на оксалат може да се увеличи при ХБН, може би в отговор на повишаване на концентрацията в кръвта (19). Оксалатът не се секретира или реабсорбира покрай проксималните тубули. По този начин концентрацията на оксалат се увеличава, когато водата се реабсорбира по нефрона, достигайки критични прагове от събирателния канал, където тя може да кристализира с калций (19). Това несъмнено е ключов фактор за риска от камъни в урината, особено по отношение на растежа върху съществуващ нидус, тъй като пикочният камък не може да се развие при липса на пренасищане.
Стомашно-чревният тракт е ключов играч в оксалатната биология. При нормални индивиди само около 10% от погълнатия оксалат се абсорбира, вероятно защото е в комплекс от калций в погълнатото растително вещество (14). Факторите, които влияят върху усвояването на оксалатите, включват количеството калций и мазнини в диетата (20). Смята се, че мастните киселини свързват калция и по този начин увеличават несвързаните анионни оксалати, които след това могат да се абсорбират парацелуларно. Свободният калций в лумена на червата може от своя страна да свърже този анионен оксалат и да предотврати неговата абсорбция. Поради това пациентите с каквато и да е причина за малабсорбция на мазнини са изложени на риск от ентерична хипероксалурия на тази основа.
Изглежда, че образувателите на камък CaOx абсорбират малко по-висок процент оксалат от храната си (14). Причините не са известни. Възможно ли е това да се дължи на генетични промени в транспорта на оксалати, тенденция към малабсорбция на мазнини или промени в чревния микробиом? Към днешна дата няма ясни отговори. Типичните лечения за пациенти с камъни с лека хипероксалурия включват диета с по-нисък оксалат и адекватни количества калций. За предпочитане калцият трябва да бъде в хранителни източници като млечни продукти, тъй като калциевите добавки могат леко да увеличат риска от камъни (21). По-ниският прием на мазнини също е добра идея, макар и да не е широко проучван извън групата с ясно изразена ентерична хипероксалурия. Надяваме се, че манипулацията на чревния микробиом може също да промени абсорбцията на оксалат.
Цитратна биология
Смята се, че цитратът е важен инхибитор на кристализацията (22). Цитратните комплекси с филтриран калций и също така имат независими ефекти върху кристалната повърхност, за да инхибират растежа на CaOx и кристалите на брушита (22,23). Някои филтрирани цитрати се реабсорбират в проксималния тубул, до голяма степен регулирани от рН на проксималните тубулни клетки, с по-ниско вътреклетъчно рН, увеличаващо реабсорбцията на цитрат (24). При липса на бъбречна тубулна ацидоза се смята, че нетната абсорбция на алкали от стомашно-чревния тракт е най-важният определящ фактор за нетна екскреция на цитрат с урината (25). По този начин диетата, претеглена към протеини, хронични състояния на малабсорбция, хипокалиемия или дистална бъбречна тубулна ацидоза са най-честите причини за хипоцитратурия, която се среща в 20–60% от образуващите калциев камък (24). Лечението е основното заболяване и/или приложението на калиев цитрат са наличните възможности (24). Като се има предвид ключовата роля на стомашно-чревната функция в цитратната хомеостаза, изглежда вероятно микробиомът да повлияе на нетната алкална абсорбция, а оттам и екскрецията на цитрат с урината. Все още обаче не са публикувани доказателства в този смисъл. В действителност, екскрецията на цитрат с урината не се е увеличила в проучванията с пробиотици с бъбречни камъни, където се съобщава за тази стойност (26-28).
Методи
В този систематичен преглед представяме резултатите от открити и рандомизирани плацебо проучвания, които са изследвали ефекта на пероралните пробиотични препарати върху пренасищането на CaOx с урината и екскрецията на оксалати. Ние също така обсъждаме изследвания на напречното сечение при хора, които са изучавали връзката на колонизационния статус на O. formigenes и екскрецията на оксалат в урината и разпространението на пикочните камъни. И накрая, ние разглеждаме съобщенията относно потенциалните разграждащи оксалати организми в червата на хора и животни.
Резултати
Изпитвания на пробиотици, съдържащи лактобацили за каменна болест
Изследователите категорично демонстрират, че компонентите на ендогенната храносмилателна микрофлора могат да използват оксалат, потенциално ограничавайки абсорбцията му от чревния лумен (29). Пробиотици, съдържащи Lactobacilli spp. са били често използвани за лечение на стомашно-чревни симптоми като индуцирана от антибиотици диария. По този начин може да се надяваме, че те ще имат благоприятни ефекти върху отделянето на оксалат в урината и/или цитрат. Oxadrop ® е формулиран специално за потенциално лечение на хипероксалурия (28). Всеки грам от сместа (Oxadrop ®) съдържа 2 × 10 11 бактерии (Lactobacillus acidophilus, L. brevis, Streptococcus thermophilus и Bifidobacterium infantis). Различните щамове се смесват в тегло 1: 1: 4: 4 и се приготвят като гранулат. Организмите са избрани въз основа на способността им да разграждат оксалатите in vitro.
В първоначално пилотно проучване Oxadrop ® намалява отделянето на оксалат с урина с 40% в група от леко хипероксалурични CaOx образуващи камъни (30) (Таблица 1). Хипооксалуричният ефект продължи дори след 1-месечен период на измиване. В последващо проучване, група от десет пациенти с различни причини за ентерична хипероксалурия и камъни също са лекувани с Oxadrop ® (28). Това проучване също не е заслепено и поради това липсва плацебо рамо. Пациентите последователно получават 4 g Oxadrop ®, 8 g Oxadrop ® и 12 g Oxadrop ® за 1 месец всеки. Тези данни предполагат малък ефект при 4 и 8 g, със спад в отделянето на оксалат в урината с около 20-25% (Таблица 1). Третият месец на 12 g Oxadrop ® екскрецията на оксалат с урината отново беше близо до изходното ниво, след което леко спадна след друг месец на измиване. По този начин това проучване предполага, че може да има дозозависим ефект на препарата или може би разликите, наблюдавани в екскрецията на оксалат в урината при по-ниските (и/или по-високи) дози, са неспецифични и изобщо не са свързани с изследваното лекарство.
В това рандомизирано, плацебо-контролирано проучване, пациентите са били поставени на контролирана метаболитна диета с нормален калций (1000 mg) и редуциран оксалат (80–100 mg), подходящ за тяхната диагноза CaOx в пикочните камъни. Самата диета беше ефективна, намалявайки отделянето на оксалат от урината средно с 36%, като цялостното подобрение на пренасищането на CaOx в урината. Оксалатът на урината обаче не пада по-далеч от тази изходна линия при контролирана диета с пробиотик или плацебо. Възможно е диетата да е била „твърде ефективна“, като по същество не е оставяла достатъчно свободен оксалат в лумена на червата, за да се разградят пробиотиците. Независимо от това, по-строгият дизайн от предишните проучвания предполага, че общата употреба на наличните в момента препарати, съдържащи лактобацилус, може да не работи така добре, както се надява първоначално при пациенти с ентерична хипероксалурия.
Впоследствие е завършено 56-дневно рандомизирано, плацебо контролирано проучване на Oxadrop ® в 20 леко хипероксалурични образуващи камъни, без известна ентерична хипероксалурия и на диета със свободен избор (31). В това проучване, подобно на плацебо-контролираното проучване за ентерична хипероксалурия (26), не се наблюдава ефект върху отделянето на оксалат с урината в нито едно рамо на 28 или 56 дни.
Както беше отбелязано по-горе, беше изказана хипотезата, че разграждащите оксалат бактерии може да изискват определено количество свободен оксалат, за да оцелеят и/или да процъфтяват в чревния лумен. По този начин Ferraz и колеги са изследвали популация от 14 образуващи камъни (7 мъже и 7 жени) на диета с ниско съдържание на калций (400 mg) и високо оксалат (200 mg) (27). При тези диетични условия отделянето на оксалат с урината се е увеличило с 30% от предишното изходно ниво при диета със свободен избор. Въпреки това, добавянето на препарат Lactobacillus/Bifidobacterium няма допълнителен ефект върху нивата на оксалат в урината.
По този начин може да се заключи, че данните от по-строгите проучвания не показват, че наличните в момента Lactobacillus или други пробиотични продукти и/или режими на тяхното приложение могат постоянно да намаляват отделянето на оксалат с урината.
Метаболизъм на оксалобактер и оксалат
O. formigenes е интересен организъм. Този задължителен анаероб използва оксалат като единствен енергиен източник. Трите ключови гена са оксалат/форматен антипортер (OxlT), формил коензим А трансфераза (frc) и оксалил коензим А декарбоксилаза (Oxc). Повечето хора се колонизират с O. formigenes по време на детството, но колонизацията може да бъде загубена по-късно в зряла възраст, може би в отговор на антибиотици. Балансът на диетичния калций и оксалат (и следователно свободен оксалат в лумена на червата) изглежда влияе върху количеството на O. formigenes, възстановено от изпражненията (32). По този начин, O. formigenes може да бъде индуцируема защита срещу поглъщане на диета с високо съдържание на оксалат.
Наблюдателните проучвания подкрепят ролята на колонизацията на O. formigenes при риска от уринарен камък на CaOx. Например, в голямо проучване на напречното сечение само 17% от 247 пациенти с камъни са били колонизирани с O. formigenes, докато 38% от 259 контролни пациенти са били (33). Предишната употреба на антибиотици е била свързана със статут на колонизация. Въпреки това, въпреки че каменните пациенти имат по-висока екскреция на оксалат с урина, състоянието на колонизация не корелира с екскрецията на оксалат в урината при тези пациенти, които са били на диета за самостоятелен избор.
В по-малко проучване на напречното сечение, при единадесет колонизирани образуващи камъни образуващи O. формигени имат по-ниска екскреция на оксалат в урината (0,31 ± 0,10 mM/ден) в сравнение с 26 неколонизирани образуващи камъни (0,40 ± 0,13 mM/ден) (34 ). По-вероятно е колонизираните каменообразуватели да имат история на множество каменни събития. Интересното е, че процентът на абсорбция на перорално маркиран оксалатен товар не варира между двете групи, въпреки факта, че плазменият оксалат е значително по-висок в колонизираната група на O. formigenes. Заедно тези наблюдения са в съответствие с намалената стомашно-чревна секреция на оксалат от пациентите, които не са колонизирани с O. formigenes.
Въпреки тези обещаващи предварителни данни, през десетилетието, откакто не са публикувани доказателства от последващо контролирано проучване, които допълнително да подкрепят използването на орална терапия с O. formigenes при PH. Потенциалните проблеми с терапевтичната употреба на орални O. formigenes включват формулиране на фармакологични количества от този задължителен анаероб, както и дългосрочната жизнеспособност на този задължителен анаероб в паста или лиофилизирани препарати. Освен това в литературата все още не са публикувани проучвания с използване на орални O. formigenes при групи пациенти с ентерична или идиопатична хипероксалурия. По този начин, ролята на фармакологичното използване на тази интригуваща бактерия за намаляване на отделянето на оксалат с урината и следователно риск от камъни в бъбреците, остава неясна.
Други разградители на оксалати
Проучванията in vitro предполагат, че O. formigenes е най-ефективният разграждащ оксалат организъм, открит в чревния тракт на човека. Например при контролирани условия O. formigenes разгражда до 98% от наличния оксалат (37). От друга страна, в същите проучвания Lactobacillus и Bifidobacterium spp. също ефективно разгражда оксалат, макар и малко по-малко ефективно (11–68%). Освен това ключовите оксалатно разграждащи гени Oxc и frc са секвенирани от Lactobacillus и Bifidobacterium spp. Една потенциално уникална характеристика на O. formigenes е, че този организъм може да използва оксалат като източник на въглерод и енергия и процъфтява в присъствието на аниона (38). Други разграждащи оксалати видове като лактобацилите могат да детоксикират оксалата и да оцелеят в негово присъствие, но не е задължително да процъфтяват. По този начин относителното значение на различните бактерии в оксалатно-хомеостазата при хората остава дефинирано.
Заключения
Диетата и стомашно-чревната функция играят ключова роля за определяне на състава на урината. Също така изглежда доста вероятно стомашно-чревният микробиом да окаже голямо влияние върху това как ключовите компоненти на диетата се метаболизират и усвояват. Основните параметри на урината, върху които микробиомът може да повлияе, включват оксалат и цитрат. Всъщност, чревният микробиом съдържа множество облигатни и генерализирани оксалатни разградители. Данните сочат, че фекалното съдържание на O. formigenes, най-добре проученият разградител на оксалати, варира в зависимост от камъчния риск и отделянето на оксалат с урината. Досегашните проучвания с пробиотици, предназначени да разграждат оксалатите, включително тези, съдържащи Oxalobacter, Lactobacillus и/или Bifidobacterium spp., Са разочароващи. По този начин, въпреки че чревният микробиом вероятно играе роля за модифициране на риска от камъни в урината, дали можем да разработим инструменти за неговото манипулиране и намаляване на този риск, остава да се определи.
Благодарности
Финансиране: Проучванията бяха частично подкрепени от (I) Консорциум за редки бъбречни камъни (U54KD083908), част от Клиничната изследователска мрежа за редки болести (RDCRN), инициатива на Службата за изследване на редки болести (ORDR), Национален център за развитие на транслацията Науки (NCATS). Този консорциум се финансира чрез сътрудничество между NCATS и Националния институт по диабет и храносмилателни и бъбречни заболявания (NIDDK); (II) Mayo Clinic O’Brien Урологичен изследователски център, DK100227; (III) грант за NIH AT R21AT2534; (IV) V.S.L. Pharmaceuticals Inc., Gaithersburg, MD; и (V) Фондация Майо. Източниците на финансиране не са играли роля в дизайна, провеждането или докладването на проучването.
Бележка под линия
Конфликт на интереси: Авторът няма конфликт на интереси, който да декларира.
- Превенция и лечение на остеоартрит с растителна диета; Диети на растителна основа в медицината
- Нови терапевтични подходи за лечение на затлъстяването Science Translational Medicine
- Слюнчени камъни Джон Хопкинс медицина
- Последни научни изследвания на традиционна китайска медицина, чай, за предотвратяване на хронични заболявания
- Наблюдения върху аналите за затлъстяването на вътрешните болести