Резюме
Заден план
Възпалителните цитокини допринасят за проатерогенните промени в липидния метаболизъм чрез намаляване на нивата на HDL-холестерол (HDL-C), увреждане на неговите противовъзпалителни и антиоксидантни функции. Следователно защитните действия на HDL-C могат да бъдат ограничени при хронични възпалителни заболявания като множествена склероза (МС). Целта на това проучване е да се оцени връзката между липопротеиновите субфракции и възпалителния статус в ранните стадии на множествената склероза.
Методи
Резултати
Концентрациите на измерените цитокини и липопротеинови подкласове са сравними между пациентите с МС и контролите. Мъжете, но не и жените с MS, са имали значително по-висока обща HDL-C и малка субфракция на HDL-C от здравите контроли. Големият HDL-C отрицателно корелира с всички измерени цитокини с изключение на IL-17 в MS, но не и в контролите. Междинните субфракции на HDL-C корелират положително с всички измерени цитокини, с изключение на G-CSF при жени от МС, но не и при мъже или контроли от МС.
Заключение
Нашите резултати от по-висок HDL-C и главно неговата малка субфракция HDL-C предполагат, че пациентите с мъжки пол с MS са изложени на по-висок риск от атеросклероза и фината дислипидемия присъства в ранните стадии на заболяването. Корелациите между специфични субфракции на HDL-C и възпалителните цитокини демонстрират взаимни връзки между системно възпаление и липиден метаболизъм при МС.
Пробна регистрация
ClinicalTrials.gov, Идентификатор: NCT 03052595 Регистриран на 14 февруари 2017 г.
Въведение
Множествената склероза (МС) е хронично невровъзпалително заболяване на централната нервна система (ЦНС), водещо до демиелинизация и невродегенерация. Най-честите симптоми включват двигателно увреждане, зрителни нарушения, сензорни проблеми, болка, умора и когнитивни нарушения, водещи до сериозни физически увреждания при млади възрастни [1].
Пациентите с МС имат повишен сърдечно-съдов риск дори при липса на традиционни рискови фактори като затлъстяване, хипертония, диабет тип 2 или дислипидемия, което предполага, че факторите, свързани с болестта, допринасят за развитието на атеросклероза при МС [2,3,4,5].
Връзката на дислипидемия, а именно на повишен общ холестерол, липопротеинов холестерол с ниска плътност (LDL-C) и намалени нива на липопротеинов холестерол с висока плътност (HDL-C), с атерогенезата и сърдечно-съдовите заболявания е добре приета ([6]; NCEP и ATP III, 2002). LDL-C и HDL-C представляват хетерогенна група частици, които се различават по плътност, миграционни характеристики, съдържание на апопротеини и връзки с болестта и тези субфракции варират в своя рисков профил. По-специално малките плътни LDL-C частици са свързани с повишен сърдечно-съдов риск, метаболитен синдром и диабет тип 2, докато не е установено, че големите LDL-C субфракции са свързани със сърдечно-съдов риск [7, 8]. Въпреки че ролята на субфракциите на HDL-C в кардиопротективните, противовъзпалителни и антиоксидативни механизми е по-малко ясна, по-голямата част от проучванията считат големите HDL-C субфракции за по-защитни от малките HDL-C [6, 8,9,10, 11,12,13].
Възпалителните цитокини могат да допринесат за проатерогенни промени в липидния метаболизъм чрез промени в ензимите и аполипопротеините, свързани с HDL-C. Това води до намаляване на нивата на HDL-C и до нарушаване на противовъзпалителните, антиоксидантните и обратните транспортни функции на холестерола [14, 15]. По този начин, хроничното възпаление може да представлява важен фактор за развитието на дислипидемия, атеросклероза, сърдечно-съдови заболявания, метаболитен синдром и затлъстяване при МС [16,17,18,19,20].
Освен това няколко проучвания показват връзки между профилите на серумния холестерол и резултатите от заболяванията при МС [17, 19, 21, 22]. Наскоро показахме намалена инсулинова чувствителност и повишена секреция на инсулин в отговор на перорално натоварване с глюкоза, несвързано със състоянието на възпаление и физическа активност при ранни пациенти с МС [23]. В допълнение, ние съобщихме за отрицателна асоциация на IDL-B липопротеинова субфракция с параметрите на инсулинова резистентност и хиперинсулинемия, което предполага начална дислипидемия, предшествана от развитие на инсулинова резистентност при тези пациенти с МС [24].
Остава неясно до каква степен дислипидемията е свързана с възпаление в ранните стадии на заболяването. Нашето проучване беше насочено към (1) оценка на дислипидемия и (2) изследване на връзката между специфични липопротеинови субфракции и възпалителен статус при пациенти с ранна МС.
Предмети и методи
Участници и протокол за обучение
След едно нощно бързо, проби от периферна венозна кръв се събират в полиетиленови епруветки; след съсирване при стайна температура за около 60 минути, кръвта се центрофугира при 4 ° C и аликвотни части от серуми се съхраняват при - 70 ° C, докато се анализира.
За да се оцени нивото на физическа активност, субектите попълниха словашката версия на въпросника за енергийните разходи на Lagerros (EEQ) [25], за да определят количествено общата продукция на енергия, свързана с всички физически натоварвания през средния седмичен ден. Физическата активност се класифицира в девет стъпки според нейната интензивност, представляваща кратно на метаболитния енергиен обмен (MET). Един MET представлява енергиен разход от 1 kcal/kg телесно тегло на час [25]. Участниците отчитат времето, прекарано на всяко ниво на интензивност през типичен ден и нощ, общият резултат за физическа активност и енергийните разходи са изчислени като сумата от отделните дейности на ниво (MET1 * t1 + MET2 * t2 +. + MET9 * t9, където METi представлява стойността на MET за текущо ниво и представлява времето, прекарано в извършване на дейността) [25].
Анализи
Нивата на общия холестерол на гладно (TC), LDL-C, HDL-C и триглицеридите (TG) се определят с помощта на автоанализатор (Siemens Healthcare Diagnostics Inc., Tarrytown, NY, USA) чрез стандартни процедури с ензимни комплекти (Roche Diagnostics, Lewes, Великобритания). Анализът на субфракция на липопротеините е извършен с помощта на техника за електрофореза в полиакриламиден гел с висока разделителна способност - система Lipoprint (Quantimetrix Corporation, Redondo Beach, CA, USA) според ръководството на производителя, което позволява анализ на следните профили на лифропротеинови субфракции: липопротеин с много ниска плътност (VLDL ) фракция, липопротеини със средна плътност (IDL) C, B и A, липопротеини с ниска плътност (LDL) с подфракции 1 и 2 (големи LDL) и подфракции 3 до 7 (малки плътни LDL - sdLDL) и висока подфракции на липопротеините на плътност (HDL), категоризирани на големи (подфракции 1–3), междинни (подфракции 4–7) и малки HDL (подфракции 8–10).
Нивата на цитокини в серума са измерени чрез мултиплекс анализ на зърна (Bio-Plex Human Cytokine panel; Bio-Rad, Hercules, CA, USA). Супернатантите бяха анализирани едновременно за следните избрани 15 цитокини: IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12 (p70), IL-13, IL-17, гранулоцитен колониестимулиращ фактор (G-CSF), гранулоцитно-макрофагичен колониестимулиращ фактор (GM-CSF), интерферон-y (IFN-γ) и TNF-α. HsCRP в серума е измерен чрез имунотурбидиметричен анализ на автоматизиран биохимичен анализатор (Hitachi 917, Roche Diagnostics, Базел, Швейцария).
Статистическа оценка
Статистическият анализ на получените данни беше извършен с помощта на IBM SPSS Statistics версия 19 (SPSS Inc., Чикаго, IL, САЩ). Нормалността на непрекъснатите променливи беше оценена чрез теста на Колмогоров-Смирнов. Нормално разпределените данни са изразени като средна стойност ± SD, докато данните, които не са нормално разпределени, са изразени като медиана (интерквартилен диапазон [IQR]). Сравненията между непрекъснатите променливи между групите бяха оценени чрез t-тест на Student или U-тест на Mann-Whitney, според случая. Използвани са два подхода за изследване на връзката на липопротеиновите субфракции и възпалителния статус. Първо, корелациите между различните липопротеинови субфракции и измерваните цитокини бяха изследвани в групите на пациентите с МС и контролните групи, като се използва коефициентът на корелация на Pearson или Spearman, в зависимост от нормалността на данните. След това корелациите бяха извършени при контролиране на възрастта, пола и ИТМ. Второ, корелациите и корелациите при контролиране на възрастта и ИТМ се извършват и в подгрупи на пола на пациенти и контроли. Разликите се считат за значителни при p
Резултати
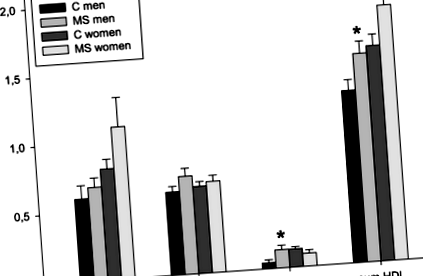
Антропометричните параметри и нивото на физическа активност са сравними както при пациентите с МС, така и при здравата контролна група (Таблица 1), дори след сравняване на мъжка и женска подгрупа поотделно. Няма значителни разлики между изследваните групи в серумната концентрация на TG на гладно и общо, LDL-C, HDL-C, както и в съответните им субфракции (Таблица 2). Когато се анализира по пол, няма значителна разлика в липидните параметри между пациентите от женския пол и контролите на жените. Пациентите от мъжки пол са имали значително по-високи концентрации на HDL-C (MS-M: 1,28 ± 0,23 mmol/l спрямо C-M: 1,04 ± 0,23 mmol/l; стр = 0,037). Подобна тенденция се наблюдава при малка субфракция на HDL-C (MS-M: 4,0 (2,5–7,0) mg/dl спрямо C-M: 1,0 (0,0–2,0) mg/dl; стр = 0,015) (Фиг. 1). Физическата активност (изразена като изчислен енергиен разход в kcal/24 h) е сравнима при мъже с MS и в контролите (MS-M: 3055 ± 784 kcal/24 h спрямо C-M: 3383 ± 620 kcal/24 h; стр = 0,366). Концентрациите на 15 измерени цитокини не се различават значително между пациентите и контролите (Таблица 3), дори след сравнение между половете.
IL-7 отрицателно корелира с междинния HDL-C и общия HDL-C при здрави контроли. GM-CSF отрицателно корелира с VLDL-C, IDL-C, голям HDL-C и общ HDL-C в здрави контроли, когато се контролира възрастта, ИТМ и пола, най-силните са корелациите на GM-CSF с големи HDL-C субфракция и общ HDL-C в здрави контроли (Таблица 4). След анализ на данните по пол, мъжките контроли показват стабилна положителна корелация на LDL1, LDL2 и LDL-C 1–2 субфракции с почти всички цитокини (r = .700–0.992; стр = 0,040–0,000). Тъй като обаче всички параметри на LDL-C субфракциите в мъжките контроли корелират положително с ИТМ (r = 0.717–0.889; стр = 0,03–0,000), данните след контролиране на възрастта и ИТМ следват подобен модел, както в цялата контролна група (Таблица 5). Силните отрицателни корелации на GM-CSF са налице само при женските контроли.
Дискусия
Целта на това проучване е да се изследва дислипидемия в ранната МС в контекста на възпалителния статус. Въпреки ниската възпалителна активност и ниския резултат на инвалидност при нашите пациенти с МС, нашите резултати показват по-висок общ HDL-C и по-висока малка субфракция на HDL-C при мъже с МС в сравнение със здрави мъже. Тези открития предполагат наличието на фини признаци на дислипидемия в ранните стадии на заболяването и при липса на други рискови фактори като ниска физическа активност или затлъстяване. Освен това, различен модел на корелация между субфракциите на HDL-C и възпалителните цитокини при МС потвърждава съществуването на взаимни връзки между липидния метаболизъм и възпалението.
LDL-C и HDL-C са хетерогенни групи частици; техните субфракции се различават по размер, плътност, по липидни и аполипопротеинови състави. Има няколко метода за измерване на лифропротеинови субфракции, освен метода Lipoprint, използван в това проучване, например ядрено-магнитна резонансна спектроскопия, градиентна гел електрофореза, ултрацентрифугиране, вертикален автоматичен профил и един от най-новите - високоефективна течна хроматография на Anion-Exchange . [11, 26, 27]. Тези различни субфракции имат различно въздействие върху риска от сърдечно-съдови заболявания; докато горе-долу е установено, че малките плътни LDL имат атерогенен потенциал [8, 10, 28], ролята на специфичните HDL-C подфракции остава двусмислена. Предполага се, че големите HDL-C частици могат да бъдат по-атеропротективни от малките HDL-C частици [10, 13]. Тези различни рискови потенциали на съответните субфракции може да не са очевидни в клиничната обстановка [2]. Следователно, промени в тези субфракции могат да обяснят увеличаване на сърдечно-съдовия риск при лица с нормален рутинен липиден профил, създавайки основа за персонализирани промени в начина на живот, като отказване от тютюнопушене, упражнения, намалена консумация на алкохол и/или хранителни интервенции [29, 30].
В сравнение с HDL и LDL холестерола, има само ограничена информация за IDL-C и връзката му със сърдечно-съдовия риск, данните за субфракциите на IDL-C и тяхната връзка с MS или възпаление като цяло са дори по-оскъдни. IDL-C има проатерогенни свойства, представляващи значителна част от сърдечно-съдовия риск, приписван на не-HDL-C [31, 32].
HDL-C притежава атеропротективни функции и противовъзпалителни свойства, но с появата на системно възпаление може да стане провъзпалително [33]. Дисфункционалните HDL-C частици са тези, които са загубили своите атеропротективни характеристики и дори могат да проявят проатерогенните [38]. Причините за това явление могат да бъдат обяснени с амилоидоза и други транслационни и посттранслационни модификации на аполипопротеин А-1 (апоА-1) [34]. Аполипопротеин A-1 е основният протеинов компонент на HDL-C частиците в плазмата. Освен заместването на апоА-1 със серумен амилоид А протеин [6, 34, 35], измененията на апоА-1 от миелопероксидаза (хлориране, окисление, нитриране, карбамилиране) и от реактивни карбонили (окисление, гликиране) по време на системно възпаление водят до производството на нефункционален HDL-C и до трансформацията на тази първоначално противовъзпалителна молекула в провъзпалителна [34]. Освен това автоантитела към апоА-1 и HDL-C са докладвани при пациенти с други автоимунни състояния като системен лупус еритематозус, ревматоиден артрит и антифосфолипиден синдром с докладван по-висок сърдечно-съдов риск и следователно могат да представляват друг механизъм, потенциално водещ до провъзпалителни свойства на апоА- 1/HDL-C [34].
Понастоящем приетата концепция за метаболизма на HDL-C описва секрецията на малки HDL-C частици от черния дроб и червата, последвана от узряване, ремоделиране и увеличаване на размера на циркулацията чрез поемане и естерификация на клетъчния холестерол [39,40,41]. Неотдавнашни проучвания обаче се съмняват, че този модел на метаболизъм на HDL-C с разширяване на размера предполага, че метаболизмът на HDL-C се среща главно в рамките на секретирания му размер, а не прогресивно узряване на нарастващите частици [39, 40].
Данните относно измерванията на HDL-C и ЯМР за лезионални и невродегенеративни промени при пациенти с МС са двузначни [17, 19, 21, 22], което може да се обясни с факта, че тези проучвания не правят разлика между субфракциите на HDL-C [42 ].
Постоянната отрицателна корелация както на общата HDL-C, така и на голямата HDL-C субфракция с цитокините може да се обясни с факта, че рутинното клинично измерване на плазмения HDL-C отразява предимно нивата на големи, богати на холестерол HDL-C частици с честа нечувствителност за откриване на малка, бедна на холестерол субфракция HDL-C [6]. В нашето проучване, повишените концентрации на малка субфракция на HDL-C при пациенти с мъжки MS и противоположните корелации на големи и междинни субфракции на HDL-C при пациенти с MS, предполагат взаимодействия между HDL-C и възпаление, дори при ремисия и ниска възпалителна активност.
Симулиращият фактор на колонии гранулоцити-макрофаги (GM-CSF), първоначално идентифициран като хематопоетичен растежен фактор, наскоро беше идентифициран като виден фактор, играещ роля при възпалението и автономността [44, 45]. Очевидно този цитокин играе важна роля в патогенезата на МС, особено в модулацията на функцията на миелоидните клетки и потенциално директно задействане на разрушаването на тъканите от тези клетки [46]. В нашето проучване GM-CSF показа най-силните корелации с липопротеиновите субфракции, потвърждавайки предполагаемата му роля в патогенезата на МС.
Заключения
В заключение, нашите резултати показват по-висок HDL-C и малката субфракция на HDL-C при мъже с ранна МС, което предполага, че пациентите с МС при мъже може да са изложени на по-висок риск от развитие на атеросклероза. Нашите резултати също ясно показват наличие на фина дислипидемия в ранните стадии на заболяването. Наблюдаваният модел на корелации между субфракциите на HDL-C и няколко цитокини отразява взаимните връзки между системно възпаление и липиден метаболизъм в ранна МС с ниска възпалителна активност.
- Управление на теглото си Общество за множествена склероза Великобритания
- Хроничното възпаление спира ли ви от отслабването Sault Fitness
- Ако започне в началото на живота, лечението с метформин увеличава продължителността на живота и отлага туморите при жените
- Лираглутид, GLP-1 рецепторен агонист, за хронично отслабване Експертен преглед на ендокринологията и
- Масова спектрометрия с течна хроматография с висока разделителна способност за профилиране на мастни киселини - Bromke - 2015 -