Хосе А. Родригес-Нивес
Програма по клетъчна и молекулярна биология, Университетът в Мичиган, 2966 Медицинска библиотека Таубман, Ан Арбър, Мичиган 48109-0619, САЩ
Джил А. Макоска
Департамент по биология, Университетът в Масачузетс, булевард Morrissey 100, Бостън, Масачузетс 02125-3393, САЩ
Резюме
Симптомите на долните пикочни пътища (LUTS) - съставляващи разстройство от спектъра, което обхваща слаб поток, никтурия и усещания за непълно изпразване и периодично или колебливо уриниране - са показателни за дисфункция на долните пикочни пътища (LUTD). LUTD е прогресиращо заболяване, което може да доведе до дисфункция на пикочния мехур, ако не се лекува или се лекува неефективно. Последствията включват задържане на урина, повтарящи се UTI, калкули на пикочния мехур и в крайна сметка бъбречно увреждане. LUTD, включващ простатата, е свързан както със стареенето, така и с възпалението. Възпалението на тъканите в резултат на стареене, инфекция или други възпалителни болестни процеси (например захарен диабет тип 2) е епидемиологично свързано с последващото развитие на тъканна фиброза в множество органи, включително простатата. Последните проучвания показват, че фиброзата на тъканите в долните пикочни пътища е свързана с LUTD и предполагат, че фиброзата може да е неразпозната досега патобиология, която допринася за LUTD. По този начин, антифибротичните терапевтични средства трябва да се разглеждат като нов подход за ефективно лечение на мъже с LUTD, особено тези, които не изпитват трайни реакции към 5α-редуктазни инхибитори или антагонисти на α-адренергичните рецептори.
Въведение
Симптомите на долните пикочни пътища (LUTS) са скъп и потенциално критичен медицински проблем за милиони застаряващи мъже. Това разстройство от спектъра обхваща симптоми като слаб поток, никтурия и усещания за непълно изпразване и периодично или колебливо уриниране, всички от които са показателни за дисфункция на долните пикочни пътища (LUTD). Ако не се лекува или се лекува неефективно, LUTD може да прогресира до дисфункция на пикочния мехур, което може да доведе до задържане на урина, повтарящи се UTI, камъни в пикочния мехур и в крайна сметка бъбречно увреждане. 1–5 LUTD често, макар и не винаги, е едновременно с ДПХ - пролиферативно, но немалигнено увеличение на простатата.
Хирургична аблация на простатната тъкан и медицински подходи за насочване на андрогенната активност (например инхибитори на 5α-редуктаза) или контрактилитет на гладката мускулатура (например антагонисти на α-адренергичните рецептори) могат да се използват за управление на LUTD. В САЩ се наблюдава постоянен спад в използването на хирургична трансуретрална простатектомия (TURP) през последните 10 години, както и постоянно нарастване на използването на минимално инвазивни технологии (MIST), особено лазерно изпаряване. 6,7 В скорошно проучване на 1645 пациенти в болница с LUTS, 4-годишният процент на повторно лечение за лазерна аблация е 8,3% в сравнение с 12,8% за TURP. 8 Проучване, основано на общността, съобщава за значителни подобрения в LUTS след лечение или с TURP, или с лазерно изпаряване, но не и с инхибитори на 5α-редуктаза или антагонисти на α-адренергичните рецептори (които само стабилизират LUTS). 9
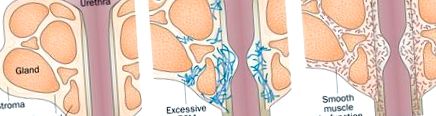
Патобиологии на простатата, които допринасят за дисфункция на долните пикочни пътища. Простатата се състои от дуктални жлези, заобиколени от фибромускулна строма, която от своя страна обгражда простатната уретра. а | Дукталните жлези и фибромускулната строма могат поотделно или едновременно да хиперпролиферират, което води до увеличаване на простатата и обструкция на уретрата. ДПХ може да се управлява медицински от 5α-редуктазни инхибитори, които предотвратяват превръщането на тестостерона в неговата активна форма, дихидротестостерон, което води до намалени нива на наличен дихидротестостерон и пролиферация на простатната тъкан. б | Феноконверсията и натрупването на миофибробласт - и последващо отлагане на ECM в периуретралната простатна тъкан (и вероятно също така и в съседни тъкани) - причинява скованост на тъканите и намалено уретрално съответствие при мъже със симптоми на долните пикочни пътища. ° С | Гладката мускулатура в простатата може да прояви дисфункционална контрактилитет с последваща дисфункция на уринирането, която може да се управлява медицински с антагонисти на α-адренергичните рецептори (които отпускат гладката мускулатура). Съкращение: ECM, извънклетъчен матрикс.
Възпаление и LUTD
Простатичен възпалителен инфилтрат
Източници на възпаление
- ▪ Възпалителен инфилтрат
- ▪ UTI
- ▪ Простатит
- ▪ Стареене
- ▪ Захарен диабет тип 2
Простатит и UTI
Друг източник на възпаление и възпалително увреждане на долните пикочни пътища е простатитът. Няколко епидемиологични проучвания показват връзка между простатита и последващото развитие на LUTD. Данните от последващото проучване на здравните специалисти показват значителна връзка между историята на гонорейната инфекция или младото начало (на 15 години Проучването на мъжкото здраве на окръг Олмстед показва, че мъжете с диагностициран от лекар простатит са значително по-склонни да развият простатизъм, ДПХ, LUTS, или уголемена простата (Р 16,17 Комбинирани данни от пет проучвания, включващи общо 10 617 мъже, предполагат, че мъжете, съобщаващи анамнеза за простатит, имат значително повишен риск от развитие на ДПХ, LUTS и рак на простатата. 18 UTIs също са свързани с мъжки LUTD. В едно проучване на 208 пациенти с бактериурия, 54% са диагностицирани с ИМП и тези пациенти демонстрират отпадаща дисфункция, проявяваща се с по-високи нива на дизурия (P = 0,0001), спешност (P = 0,0001) и честота (P = 0,0001; Каре 1) .19
Възпаление, свързано със стареенето
Възпалението на простатата също е резултат от нормалния процес на стареене. Значително по-високи концентрации на интерлевкин-8 и тясно свързания C-X-C мотив хемокин (CXCL) 5 се секретират от стромални фибробласти, култивирани от простатите на възрастни мъже в сравнение с по-младите мъже. 20–22 Освен това секрецията на интерлевкин-8, CXCL5, CXCL1, CXCL6 и CXCL12 чрез стареене на стромата на простатата индуцира пролиферативни реакции както от епителните, така и от стромалните простатни клетки in vitro. 21–23
Други проучвания показват, че богата на миофибробласти реактивна строма характеризира хиперпластична, диспластична и свързана с неопластиката простатна строма, 33,34 BPH възли показват повишена епителна CXCL8 имунореактивност (често свързана с реактивна строма), 33 CXCL8 индуцира диференциацията на фибробластите към миофибробластите 33 и свръхекспресията на получен от кератиноцити хемокин (миши хомолог на CXCL8) в миши простатен епител може да доведе до хиперпластични простатни епителни ацини (обикновено свързани с периацинарна реактивна строма). 35 В допълнение, CXCL5, CXCL8 и CXCL12 насърчават прехода на нормалните фибробласти на простатата към миофибробласти in vitro. 36 Взети заедно, тези данни предполагат, че застаряващата възпалителна микросреда може да благоприятства натрупването на миофибробласти и фиброзата на тъканите в простатата. По този начин, при липса на съпътстващи болестни процеси, „нормалните“ процеси на стареене може да са достатъчни за насърчаване на фиброзни промени в тъканната архитектура на долните пикочни пътища и последващи обструктивни симптоми на изпразване (каре 1).
Възпаление, свързано с диабет
Четвъртият източник на възпаление, който потенциално може да засегне долните пикочни пътища, е захарен диабет тип 2 (T2DM). Данните от няколко скорошни епидемиологични проучвания показват, че LUTD се среща по-често сред мъжете с T2DM, отколкото при здравите контроли. 37 Сред 9 856 мъже с клинично диагностицирана ДПХ, наличието на захарен диабет (13% разпространение) е свързано с повишена тежест на LUTS, засягаща функцията на изпразване повече от функцията за съхранение. Пациентите с ДПХ и T2DM са имали значително по-висок изходен международен рейтинг на симптомите на простатата (IPSS; 20,5 ± 0,2) и значително по-нисък максимален дебит на урината (Qmax; 10,4 ± 0,2) от тези с ДПХ, но без T2DM (18,6 ± 0,1 и 11,5 ± 0.1, съответно; P 38 Всъщност се предполага, че T2DM и LUTD споделят основната възпалителна патогенеза, тъй като много важни цитокини, участващи във възпалението, са свързани и с двете състояния.
Връзката между T2DM с LUTD иницииране и прогресия е биологично потвърдена при животински модели. Зайците, хранени с диета с високо съдържание на мазнини (HFD), показват метаболитен синдром, както се доказва от хипергликемия и непоносимост към глюкоза, повишени нива на серумни триглицериди и холестерол и повишено средно артериално налягане (MAP) и висцерална мастна тъкан (ДДС). 40 Тези зайци също развиват промени в пикочния мехур (включително фиброза, хипоксия и нискостепенно възпаление) във връзка с намалено съответствие на пикочния мехур. 40,41 По този начин, HFD се свързва с метаболитен синдром, T2DM, възпаление и нарушена функция на уринирането. Подобни проучвания показват, че HFD-хранените SAMP6 и AKR/J мишки развиват индуцирано от диетата затлъстяване и T2DM едновременно с повишено ДДС, възпаление на простатата, фиброза на простатната и уретралната тъкани и дисфункция на уриниране. 42 Взети заедно, тези проучвания показват, че възпалението на долните пикочни пътища е епидемиологично и биологично свързано с фиброза на тъканите и LUTD (каре 1).
Фиброза на простатата
Възпалението на тъканите, причинено от стареене, инфекция и други възпалителни болестни процеси, е епидемиологично свързано с последващото развитие на тъканна фиброза в множество органични системи, което води до състояния като панкреатична дисфункция, 43,44 хронични обструктивни белодробни заболявания, 45,46 циротични безалкохолни мастни чернодробно заболяване, 47,48 и болест на Crohn. 49–51 Механично, фиброзата се появява след възпалението (Фигура 2) и може да се разглежда като иницииран от възпаление, аномален процес на зарастване на рани, който се характеризира с натрупване на миофибробласти, отлагане на колаген, ремоделиране на извънклетъчната матрица (ECM) и увеличаване на тъканите скованост. 36,51–54 Фиброзата на тъканите нарушава функцията на органите, като замества нормалната тъкан със силно колагенизирана тъкан на белези, увеличава сковаността на тъканите (като по този начин намалява еластичността и приспособяването на тъканите), нарушава или премахва нормалната инервация на тъканите и съдовата система.
Принос на възпалението и фиброзата за дисфункция на долните пикочни пътища (LUTD). ИПП, простатит, стареене и захарен диабет тип 2 са източници на възпаление на тъканите, което насърчава фиброзата в долните пикочни пътища. Периуретралната фиброза на тъканите, стромалната или епителната простатна пролиферация и дисфункцията на гладката мускулатура могат самостоятелно или в комбинация да насърчават LUTD при мъжете. Тези три патобиологии могат да се появят едновременно в една и съща простатна жлеза.
Активирано от рани ECM ремоделиране
Фиброзата може да се разглежда като грешен процес на зарастване на рани, характеризиращ се с активиране и натрупване на миофибробласти, които се произвеждат временно в много тъкани като част от нормалната реакция на раната. Няколко клетъчни типа, включително фибробласти, перицити, фиброцити и мезенцимни клетки, може да са способни да се диференцират в миофибробласти. 55 Общите отличителни белези на диференциацията на миофибробластите са експресията на α-гладкомускулен актин (α-SMA) и колаген тип I, който е голям компонент на секретирания от миофибробласт ECM. Миофибробластите, експресиращи α-SMA, образуват фокални адхезии към околния ECM, увеличен с колаген, и свиването на тези миофибробласти осигурява механичната сила, необходима за контрактурата на раната и затварянето. Последващото затваряне на раната намалява механичното натоварване на миофибробластите - потенциално усещано от α-SMA, за което се смята, че е метаносензорен протеин - което води до разтваряне на фокалните сраствания, разглобяването на α-SMA и евентуална апоптоза на миофибробластите и клетъчна смърт. 53,54 Ако не настъпи затваряне на раната, миофибробластите не получават механичния сигнал за апоптоза и продължават да се натрупват и депозират ECM, като по този начин заменят нормалната тъкан с фиброзна тъкан.
Простатните стромални фибробласти могат да бъдат индуцирани да експресират свързания с фиброза колаген 1 и 3 и α-SMA и да претърпят пълна функционална феноконверсия на миофибробласт в отговор на експозицията на каноничния профибротичен протеин TGF-β1 или CXCLs CXCL5, CXCL8 и CXCL12 (дори при липса на екзогенен TGF-β1). 36 Освен това, медиираната от CXCL12 феноконверсия на миофибробластите може да бъде напълно отменена чрез инхибиране на рецептора CXCL12 CXCR4. Тези открития показват, че CXCL, които съдържат възпалителни протеини, за които е известно, че са силно експресирани в стареещата простата, могат ефективно и напълно да медиират феноконверсията на миофибробластите и следователно могат да насърчат фиброзните промени в архитектурата на простатната тъкан, които са свързани с развитието и прогресирането на мъжкия LUTD. 36
Периуретрално отлагане на ECM и фиброза
Феноконверсия на миофибробласт и започване на фиброза в простатата. а | Здравата простатна тъкан се състои от различни видове клетки, включително фиброцити, фибробласти, епителни клетки и ендотелни клетки, както и други, които не са показани тук (например неврони и левкоцити). б | Много от тези клетъчни типове могат да действат като клетки-предшественици, които се подлагат на феноконверсия на миофибробласт при излагане на профибротични стимули. Миофибробластите се натрупват и отлагат прекомерна ECM, която замества нормалната тъкан с твърда несъответстваща фиброзна тъкан. Съкращение: ECM, извънклетъчен матрикс.
Терапевтично насочване на фиброза
Стандарт на грижа
Няколко клинични проучвания показват, че пациентите, подложени на лъчева терапия на простатата - процедура, която може да предизвика фиброза на тъканите или стриктури на уретрата 57 - демонстрират значително намаляване на LUTS след лечение с антагонисти на α-адренергичните рецептори. 58 Проучванията при животни показват, че вентралните простати на плъхове, лекувани с агонист на α-адренергичния рецептор фенилефирин, са засегнати от интерстициална фиброза, възпаление, неоангиогенеза и de novo синтез на колаген (предполагащ дезмопластична реакция). 59 Обратно, други проучвания показват, че вентралните простати на възрастни плъхове Wistar, лекувани с антагониста на α-адренергичния рецептор доксазозин, съдържат повишени нива на колаген и колагенови фибрили в сравнение с нелекувани контроли. Известно е, че 60 антагонисти на A-адренергичния рецептор са насочени към съдови и гладкомускулни клетки в долните пикочни пътища. Въпреки това, миофибробластите, подобно на клетките на гладките мускули, са контрактилни, 55 и е необходима допълнителна работа, за да се определи дали миофибробластите реагират на антагонистите на α-адренергичните рецептори по подобен начин на клетките на гладките мускули в долните пикочни пътища.
Няколко проучвания са документирали хистологични промени в архитектурата на простатната тъкан - включително повишени нива на възпалителен инфилтрат и фиброза - след терапия с лишаване от андроген (ADT). 61–63 Проучвания за изследване на тъкани на простатата от мъже, лекувани с краткосрочна или дългосрочна терапия с 5α-редуктаза инхибитор за ДПХ или LUTS, все още не са провеждани. Въпреки това, като се има предвид връзката между фиброзата на тъканите и LUTD, такива проучвания са оправдани. Ако ADT са свързани с феноконверсия на миофибробласти и фиброза в немалигнени простатни тъкани, такова лечение всъщност може да допринесе за прогресията на ДПХ и LUTS при някои мъже.
Антифибротични средства
В обобщение, възпалението на тъканите в резултат на стареене, инфекция или други възпалителни болестни процеси (например T2DM) е свързано с последващото развитие на тъканна фиброза в простатата. Периуретралната фиброза на простатната тъкан от своя страна е свързана с LUTD, което предполага, че фиброзата може да е неразпозната досега патобиология, която допринася за LUTD. По този начин, антифибротичните терапевтични средства трябва да се разглеждат като нов подход за ефективно лечение на мъже с LUTD, особено тези, които не изпитват трайни реакции към 5α-редуктазни инхибитори, антагонисти на α-адренергичните рецептори или хирургична аблация.
Бележки под линия
Конкуриращи се интереси
Авторите не декларират конкуриращи се интереси.
- Естествено облекчение за инфекции на пикочните пътища на вашето куче Модерно списание за кучета
- Нефрогенен диабет Insipidus - Нарушения на бъбреците и пикочните пътища - Ръководства на Merck Потребителска версия
- Пациентите със стадий 3 в сравнение с етап 4 чернодробна фиброза имат по-ниска честота и по-дълго време
- Бъбречна глюкозурия - Нарушения на бъбреците и пикочните пътища - Наръчници на Merck Потребителска версия
- Симптоми; Причини за проблеми с контрола на пикочния мехур (уринарна инконтиненция) NIDDK