Кореспонденция на: д-р Мохамед G Atta, доктор по медицина, катедра по нефрология, Университет Джон Хопкинс, 1830 E. Monument Street, Suite 416, Балтимор, MD 21287, САЩ. ude.imhj@1attam
Телефон: + 1-410-9555268 Факс: + 1-410-9550485
Резюме
Основен съвет: Хипероксалурията е нарушение, характеризиращо се с повишена екскреция на оксалат с урината. Първичната хипероксалурия е наследствен дефект на метаболизма на оксалатите, докато вторичната хипероксалурия се наблюдава при състояния на повишено поглъщане на оксалат, неговите предшественици или променена чревна флора. Тези нарушения могат да доведат до повтарящи се бъбречни камъни, нефрокалциноза и в крайна сметка в краен стадий на бъбречно заболяване. Въпреки тези общи черти, подвидовете хипероксалурия се различават по своята патогенеза, тежест на клиничното представяне и план на лечение. Бързото клинично разпознаване и разграничение между тези нарушения е от съществено значение не само за навременната интервенция, но и влияе върху прогнозата при пациенти с хипероксалурия.
ВЪВЕДЕНИЕ
Оксалатът е йонната форма на оксалова киселина и се получава от различни животински и растителни източници. Оксалатът се екскретира главно през бъбреците. Хипероксалурията е състояние на нарушен метаболизъм, характеризиращо се с повишена екскреция на оксалат с урината. Нормалната дневна екскреция на оксалат при здрави индивиди варира между 10-40 mg на 24 часа. Концентрации над 40-45 mg за 24 часа се считат за клинична хипероксалурия [1-3]. Това може да е резултат от повишено ендогенно производство на оксалат при първична хипероксалурия (PH) или от повишена чревна абсорбция или увеличен прием на прекурсори на оксалат при вторична хипероксалурия (SH).
Хипероксалурията има потенциал да причини опустошителни последици, които могат да възникнат още в ранна детска възраст или през шестото десетилетие от живота и ако не се предприемат подходящи мерки, могат да причинят значителна заболеваемост и смъртност, включително бъбречна болест в краен стадий (ESRD) [4]. Повишените нива на оксалат в плазмата водят до отлагане на оксалат в различни органи. Системната оксалоза трябва да бъде предотвратена, но диагнозата често се отлага при повече от 40% от пациентите. В проучване на Hoppe et al [5] 30% от пациентите са диагностицирани само когато вече са достигнали ESRD. В някои случаи диагнозата може първо да бъде поставена, когато заболяването се повтори след бъбречна трансплантация [6]. Хипероксалурията продължава да бъде предизвикателна болест и подходящото лечение изисква висок индекс на подозрение и навременна диагноза.
Този преглед подчертава механизмите, лежащи в основата както на първичната, така и на вторичната хипероксалурия, клиничните прояви, важните елементи при скрининга и диагностиката, както и настоящите ни познания за начините на лечение.
ИЗТОЧНИЦИ ОКСАЛАТ
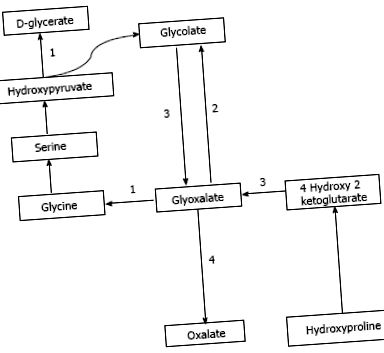
Оксалатът се получава от екзогенни източници, както и от ендогенен синтез. Оксалатът се среща в изобилие в растителни и животински източници. Диетичните източници, най-богати на оксалат, включват ядки, сливи, шоколад, цвекло, ягоди, ревен, тофу и спанак [1,7]. Сокообразуването е скорошна популярна тенденция, при която се консумира диета, основана предимно на плодови и зеленчукови сокове и може да доставя много голямо количество дневен оксалат [8,9]. Проучванията показват, че с увеличаване на диетичния прием на оксалат се увеличава и концентрацията на оксалат в урината [10]. Ендогенният синтез на оксалат се осъществява в черния дроб [11] чрез път, който генерира глиоксалат като междинна молекула [12]. Глиоксалатът се синтезира от окисляване на гликолат чрез ензимно действие на гликолат оксидаза или от метаболизъм на хидроксипролин, който се намира в колаген или хранителни източници. Повишеният глиоксалат се превръща в оксалат чрез действие на лактат дехидрогеназа при липса на ензимна активност, както се наблюдава при различните видове PH [12,13]. Този път е изобразен на фигура Фигура 1 1 .
Път на синтеза на оксалати и ензимни дефекти в PH. A: PH1, аланин глиоксалат аминотрансфераза; B: PH 2, гликолат редуктаза хидрокси пируват редуктаза; С: PH 3,4-хидрокси 2-кетоглутарат алдолаза; D: Лактат дехидрогеназа.
БЪДЕЩНА РАБОТА С ОКСАЛАТ
Обработката на бъбречните оксалати включва гломерулна филтрация, тубулна секреция и тубулна реабсорбция [14,15]. Гломерулната филтрация зависи от плазмените нива на оксалат, докато тубулният транспорт се медиира от семейството на транспортни протеини SLC26. SLC26A1 посредничи поемането на оксалат в клетката през базолатералната мембрана в замяна на сулфат [16,17]. От апикалната страна на тубуларните клетки SLC26A6 е доминиращият хлорид-оксалатен обменник, който насърчава реабсорбцията на хлорид в замяна на секрецията на оксалат и е замесен в развитието на бъбречни камъни. Този обменник също медиира чревна секреция на оксалат и е доказано, че загубата на този обменник насърчава повишената чревна абсорбция на оксалат в тънките черва [18,19]. При бъбреците на плъхове е доказана тубулна реабсорбция в сегментите S1 и S2 на проксималния канал [14], което може да помогне за намаляване на тенденцията за пренасищане на калциев оксалат в по-ранните части на нефрона [3].
Като цяло приносът на тубулната секреция в допълнение към гломерулната филтрация е от решаващо значение за регулирането на плазмените нива на оксалат, тъй като е доказана силна корелация между високите плазмени нива на оксалат и секрецията на оксалати [20]. Също така е отбелязано, че секрецията на тубуларен оксалат се увеличава при пациенти с РН, вероятно в опит да се смекчат животозастрашаващите последици от системната оксалоза [21]. Повишена тубулна секреция е отбелязана и при пациенти с хипероксалурия след чревен байпас [22].
ГЕНЕТИЧНИ И БИОХИМИЧНИ ОСНОВИ НА БОЛЕСТТА
Първична хипероксалурия
Първичната хипероксалурия тип 1 (PH1) е най-честата и тежка форма на PH. Той представлява приблизително 80% от случаите на PH и се причинява от дефект в зависимия от витамин В6 чернодробен пероксизомен ензим, аланин глиоксалат аминотрансфераза (AGT). Този ензим катализира трансаминирането на L-аланин и глиоксалат до пируват и глицин. Ензимният дефект се дължи на мутация в гена AGXT, разположен в хромозома 2 [23,24].
Първичната хипероксалурия тип 2 (PH2) представлява около 10% от пациентите с PH. Дисфункцията на ензима глиоксалат/хидроксипируват редуктаза (GRHPR) възниква вторично вследствие на мутация в гена GRHPR, разположен в хромозома 10 [25-27]. Следователно има повишена екскреция на урина с L-глицеринова киселина и оксалат.
Първичната хипероксалурия тип 3 (PH 3) е наскоро описан обект и се среща в 10% случаи на PH. Генетичният дефект в PH3 е локализиран в гена HOGA1, разположен в хромозома 9, който кодира митохондриалната 4-хидрокси 2-оксоглутарат алдолаза [28]. Този ензим разгражда 4-хидрокси 2-оксоглутарат до пируват и глиоксалат, който от своя страна се превръща в оксалат.
ВТОРИЧНА ХИПЕРОКСАЛУРИЯ
Причините за SH са повишаване на диетичната и чревната абсорбция (ентерична хипероксалурия), прекомерен прием на оксалатни предшественици и промяна в чревната микрофлора.
Повишен хранителен прием на оксалат
Богатите на оксалати хранителни източници включват ревен и спанак, а дневният прием може да надвишава 1000 mg/ден [29]. Повишената диетична абсорбция може да възникне при „изцеждане на сок“, което се разпространява като модна мода за изчистване на токсините от тялото, а също и за отслабване. Преди се смяташе, че диетичният оксалат допринася само минимално (10% -20%) за количеството оксалат, екскретирано с урината, но проучванията показват, че това не е правилно. В проучване на Holmes et al [10] приемът на храна допринася за около 50% от оксалатната секреция, доказвайки, че поглъщането с храната е важен фактор, определящ общата екскреция на оксалати. Бионаличността на оксалат от храната и, следователно, оксалат в урината, също се влияе от формите на оксалат в храната, техниките за обработка и готвене на храна и други съставки в храната [30]. Хранителното поглъщане на оксалат се намалява чрез едновременно поглъщане на калций или магнезий, които се комплексират с оксалат и образуват неразтворими соли [10,31].
Хипероксалурия, свързана с малабсорбция на мазнини
Малабсорбцията на мазнини увеличава чревната абсорбция на оксалат поради повишената чревна пропускливост за оксалат и образуването на калциеви и мастнокиселинни комплекси, водещи до увеличени количества разтворим оксалат. Необходимо е непокътнато дебело черво за повишена абсорбция на оксалат чрез този механизъм [32]. Тази форма на хипероксалурия се наблюдава при частична гастректомия, бариатрична хирургия, йеюноилеален байпас и възпалително заболяване на червата [7,33].
Роля на oxalobacter formigenes
Oxalobacter formigenes (O. formigenes) е аеробна грам отрицателна бактерия, която използва оксалат като свой енергиен източник и намалява чревната абсорбция на оксалат и по този начин намалява отделянето на оксалат в урината [34,35]. Това е добре документирано както в експерименти с хора, така и с животни [36,37]. Загубата на тази бактерия настъпва след употребата на антибиотици [38] и нейното възстановяване може да има роля при лечението на хипероксалурия.
Прекомерен прием на оксалатни предшественици
Аскорбиновата киселина (витамин С) е предшественик на оксалат и приемът на прекомерни количества витамин С може да доведе до утаяване на калциев оксалат [39,40]. Оксалатът е продукт на етилен гликол, причиняващ отлагане на калциев оксалат и бъбречна недостатъчност [41,42]. Съобщава се и за хипероксалурия след бъбречна трансплантация поради мобилизация на оксалат и отлагане в рамките на бъбречната алотрансплантация [43]. Повишена чревна абсорбция на оксалатна и тубулна секреция също се съобщава при пациенти с муковисцидоза, водеща до хипероксалурия [3,44,45].
„Сокообразуването“ заслужава специално внимание, тъй като доставя голямо количество дневен оксалат. Повишеното количество прием на течности в соковете увеличава парацелуларната абсорбция на оксалат в червата. Това може да преодолее способността на бъбреците да отделят повишеното хранително натоварване, особено при пациенти с хронично бъбречно заболяване. Оксалатът се поглъща в плодовете и зеленчуците, използвани за приготвянето на сокове като киви, спанак и цвекло. Отбелязва се също нисък прием на калций и поглъщане на излишък от витамин С, което заедно с приема на оксалат повишава риска от остра бъбречна травма [8,9].
КЛИНИЧНА ПРЕЗЕНТАЦИЯ
Разпространението на PH1 е приблизително 1-3 случая на милион население [46,47]. Най-малко 1% от ESRD, наблюдавано при педиатричната популация, се дължи на PH1 в европейски и японски проучвания [48,49]. По-често се наблюдава в кувейтско и тунизийско население, където се практикуват роднински бракове [50,51]. PH1 е най-тежкият тип PH, въпреки че има значителна вариабилност в клиничното му представяне. Пациентите могат да се появят в ранна възраст по време на ранна детска възраст с животозастрашаваща оксалоза и неуспех за процъфтяване или в зряла възраст след преминаване на случайни камъни. Като цяло заболяването се характеризира с рецидивираща нефролитиаза и прогресираща нефрокалциноза, водеща до бъбречно увреждане и в резултат на това по-голямата част от пациентите достигат до ESRD през 3-5-то десетилетие от живота [52,53].
PH2 е по-малко агресивна форма на PH с по-добро запазване на бъбречната функция и по-ниска честота на бъбречно заболяване в краен стадий и по-малко тежка нефрокалциноза в сравнение с PH1. Разликите се обясняват с по-високата екскреция на оксалати в PH1 и променен състав на урината с намалени нива на цитрат и магнезий в урината в PH1 в сравнение с PH2 [54].
PH3 обикновено се проявява с рецидивираща нефролитиаза в ранните десетилетия от живота. Също така се характеризира с повишаване на нивата на калций в урината и генетичните дефекти в гена HOGA1 също са замесени в случаи на идиопатична уролитиаза на калциев оксалат [55]. Курсът на заболяването е по-доброкачествен в сравнение с други форми и въпреки че са налични ограничени клинични данни, досега не са докладвани случаи на ESRD с PH3 [56,57].
Пациентите с вторична хипероксалурия имат предразположение към развитие на повтарящи се калциево-оксалатни камъни поради основното заболяване. Това води до влошаване на бъбречното увреждане и прогресия към ESRD. Системната оксалоза е по-рядко срещана при вторична хипероксалурия, но се съобщава в някои тежки случаи на болестта на Crohn [58].
СИСТЕМНА ОКСАЛОЗА
Солите на калциевия оксалат са слабо разтворими в телесни течности. Калциевият оксалат се отлага в бъбречната тъкан като нефрокалциноза и също така образува бъбречни камъни (нефролитиаза). Това води до прогресиращо бъбречно увреждане и възпаление и тубулна обструкция, водещо до интерстициална фиброза, намаляване на бъбречната функция и в крайна сметка ESRD [52,59].
Когато скоростта на гломерулна филтрация (GFR) падне под 30-40 ml/min на 1,73 m 2, бъбречният капацитет за отделяне на калциев оксалат е значително нарушен. На този етап калциевият оксалат започва да се отлага в допълнителни бъбречни тъкани в процес, наречен системна оксалоза. Съобщава се за отлагания на калциев оксалат в миокарда, сърдечната проводима система, бъбреците, костите и костния мозък. Това води до кардиомиопатия, сърдечен блок и други сърдечни проводими дефекти, съдови заболявания, ретинопатия, синовит, оксалатна остеопатия и анемия, за която се отбелязва, че е устойчива на лечение [52,60,61].
СКРИНИНГ ЗА ХИПЕРОКСАЛУРИЯ
Скрининг за хипероксалурия трябва да се предприеме при всяко дете с първия епизод на бъбречен камък и всички възрастни, които се представят с повтарящи се калциево-оксалатни камъни. Скринингът също трябва да се направи при първо представяне на нефрокалциноза или фамилна анамнеза за каменна болест на всяка възраст. Освен това, скринингът трябва да бъде предложен на роднини на индекси. PH1 трябва да бъде силно обмислен при диференциала при всеки пациент с бъбречна недостатъчност с неизвестна етиология, особено когато има нефрокалциноза с намалена бъбречна функция или висока честота на бъбречни камъни. Наличието на монохидратни калциево-оксалатни кристали в биологични течности или тъкани също е силен указател към първичната хипероксалурия и трябва да бъде проследено с допълнителни тестове [62].
ДИАГНОСТИКА
Диагнозата на хипероксалурия се установява с помощта на комбинация от клинични, радиологични, биохимични, хистопатологични и генетични изследвания при първична хипероксалурия. Прецизната диагноза е от първостепенно значение за прогностичните и лечебните последици, а също и за пренаталния скрининг в подходящи случаи, когато се подозира PH.
При пациенти с клинично подозрение за хипероксалурия диагностичната обработка трябва да започне с ултразвук или друго радиологично изобразяване на бъбреците и останалите пикочни пътища, за да се потвърди наличието на нефрокалциноза и уролитиаза [2,53]. Трябва да се направи анализ на камъни и може да даде първоначални диагностични следи за PH. Камъните в PH са съставени от монохидрат калциев оксалат (Whewellite), които приемат форма на гира [63].
Първоначалните биохимични тестове включват екскреция на оксалат с урина, за предпочитане измерена в рамките на 24 часа събиране на урина и се препоръчва корекция на екскрецията на оксалат на 1,73 m 2 от телесната повърхност [2]. Оксалат в урината: могат да се използват съотношения на креатинин в урината, но трябва да се знаят специфични за възрастта нормални стойности. Тези стойности обаче трябва да се тълкуват с повишено внимание, тъй като съотношенията намаляват в ранния живот и също са обект на променливост въз основа на хранителния прием. Оксалурията трябва да бъде потвърдена с помощта на две проби от урина. PH се характеризира с екскреция на оксалат с урината> 1,0 mmol/1,73 m 2 за 24 h в повечето случаи и в някои случаи може да надвишава 2,0 mmol/1,73 m 2/24 h за разлика от нормалната екскреция с урина, която обикновено е 2 за 24 h. При пациенти с хипероксалурия> 0,8 mmol/1,73 m 2 за 24 часа, трябва да се измерват нивата на гликолат и глицерат в урината. Около две трети от пациентите с PH1 имат повишени нива на гликолат в урината, но е важно да се помни, че нормалните нива на гликолат не изключват диагнозата. Установено е, че нивата на глицерат в урината са високи при пациенти с РН2 [2,53].
Тъй като GFR намалява, отделянето на оксалат с урината намалява и оценката на оксалата в урината може вече да не е точна. При тези обстоятелства трябва да се измери плазмен оксалат. При пациенти с PH с ESRD, нивата на плазмен оксалат обикновено са по-високи от 80 μmol/L, докато при пациенти без PH хипероксалурични нива на плазмен оксалат могат да варират между 30-80 μmol/L [64-66]. Това е за разлика от плазмените нива на оксалат от 1-5 μmol/L при нормални пациенти [1].
Неинвазивната, окончателна диагноза на PH се осигурява чрез тестване на AGXT, GRHPR и HOGA1 гени. Известни са 150 мутации за AGXT [67], 16 за GRHP [26] и 15 за HOGA1 [28,55-57,68]. Уилямс и съавт. [69] показват, че целевият анализ на трите най-чести мутации в AGXT (c.33_34insC, c.508G> A и c.731T> C) дава диагнозата при 34.5% пациенти с PH1, докато екзонно секвениране на екзон 1, 4 и 7 увеличава добива и позволява диагностициране при 50% пациенти с PH1. Пренаталната диагностика може да се направи чрез тестване на хорионни ворсинки. При пациенти с една или никаква известна мутация за диагностициране се препоръчва анализ на интрагенна и екстрагенна връзка [70,71]. Когато скринингът на ДНК е недиагностичен, но клиничното съмнение е високо, за установяване на диагнозата се предприема чернодробна биопсия. Това обаче е инвазивен метод и носи висок риск от усложнения като кървене [53].
При SH камъните обикновено се смесват (Whewellite и Wedellite) за разлика от PH. Екскрецията на оксалат в урината се увеличава в SH и може да бъде> 0,7 mmol/1,73 m 2 за 24 часа, но в някои случаи може да надвишава 1,0 mmol/1,73 m 2 за 24 часа [2,72,73]. Други налични диагностични тестове включват използване на PCR в проби от изпражнения за идентифициране на оксалобактер формигени [74,75]. Също така, повишената чревна абсорбция на оксалат може да бъде оценена чрез тест за абсорбция, използвайки (13 С2) оксалат [76]. Този тест може да помогне за идентифицирането на хиперабсорбери, които биха се възползвали от диетични интервенции, фокусиращи се върху понижаване на оксалат и повишаване на калция в диетата. Този диагностичен тест също помага да се направи разлика между първичната и вторичната форма на хипероксалурия [33].
Рентгенологичното изобразяване може да помогне при диагностицирането на мултисистемно участие. Засягането на бъбреците, освен уролитиазата, може да покаже два различни модела: медуларна нефрокалциноза, която се оценява добре при ултразвук, докато КТ е по-добър начин за диагностика на кортикална нефрокалциноза. КТ може да бъде полезен и за откриване на отлагане на калциев оксалат в различни други органи, като стени на червата, мускули и артерии. Ефектите върху сърцето могат да бъдат оценени чрез електрокардиография и ехокардиография. Кожната биопсия може да се наложи при кожни лезии, вторични след отлагането на калциев оксалат, които могат да приличат на лезии на калцифилаксия [62]. При хистопатологично изследване кристалите на калциевия оксалат показват характерно двойно пречупване при изследване под поляризирана светлина. Фигури Фигури 22 и и 3 3 показват отлагане на калциев оксалат в бъбречната тъкан.
Отлагане на калциев оксалат в бъбречните каналчета (черни стрелки).
- Първична хипероксалурия Доклад за случай и преглед на списанието „Literature Journal of Comprehensive“
- Видове първична хипероксалурия, лечение и др
- Перитонеален рак първичен, вторичен, симптоми, етапи и др
- Обструкция на тънките черва, вторична за остър панкреатит
- Рак на тънките черва Разбиране на знаците; Симптоми на тумори в малките черва -