Резюме
Глутатион S-трансферазата P1 (GSTP1), ензим, участващ в процеса на детоксикация, често се инактивира при рак на простатата поради епигенетични модификации. Чрез Silico анализ идентифицирахме подмножество от микроРНК (miRNAs), които са предполагаеми цели за регулиране на GSTP1. miRNAs са малки ендогенни некодиращи РНК, които са критични регулатори на различни физиологични и патологични процеси и тяхното ниво на експресия може да играе точно роля в ранната диагностика и прогноза на рака. Тези малки молекули са открити в голямо разнообразие от човешки биологични проби, включително кръв, серум, урина, еякулат и тъкани, които могат да бъдат използвани като клинично полезен биомаркер при ранно откриване и прогнозиране на рак на простатата. Главата обобщава настоящите знания за miRNA, участващи в регулацията на GSTP1 при рак на простатата и техния потенциал като полезни биомаркери на заболяването за ранно откриване и прогнозиране, заедно с предизвикателствата и ограниченията в това развитие.
Въведение
Ракът на простатата остава най-честата форма на рак при мъжете в САЩ [1]. Според оценка на Американското онкологично общество през 2014 г. ще бъдат диагностицирани приблизително 233 000 нови случая на рак на простатата и около 29 480 мъже ще умрат от това заболяване [1, 2]. Ранната диагностика на тумора и навременното откриване на прогресията на рака на простатата след операция или лъчева терапия са от решаващо значение за неговия ефективен и полезен клиничен резултат. Широкото използване на серум-базиран общ простатно-специфичен антиген (PSA) доведе до откриване на рак на простатата на потенциално лечим етап; използването му като скринингов инструмент обаче остава противоречиво поради липсата на истинска точка на tPSA за идентифициране на риска от рак на простатата [3, 4]. Първо, приблизително една трета от раковите заболявания на простатата, открити на ниво PSA при или над 4 ng/ml, вече са се разпространили в простатната капсула или повече, и приблизително 15% от мъжете с ниво на PSA
Глутатион S-трансферази
Глутатион S-трансфераза pi и рак на простатата
Епигенетика и генна регулация
Експресията на гени е сложно регулирана чрез епигенетични модификации като метилиране на ДНК, пост-транслационни модификации на хистонови протеини и транскрипционно регулиране на генната експресия чрез некодираща регулаторна микроРНК [42, 43]. Многобройни проучвания показват, че регулаторните последователности в близост до гена GSTP1 обикновено се инактивират чрез ДНК хиперметилиране по време на ранните етапи на карциногенезата на простатата [44, 45]. Широко метилиране на дезоксицитидинови нуклеотиди, разпределени в островния регион 5′CpG на GSTP1, не се открива в доброкачествената простатна тъкан, но е установено при високостепенна интраепителна неоплазия (HGPIN) и аденокарцином на простатата в тъканите и течности, включително плазма, серумни простатни еякулати, проби от урина [46–48].
Модификацията на хистона е тясно свързана с метилирането на ДНК при рак на простатата [49]. Проучванията показват, че хистоновите деацетилази от клас I (HDACs) често са свръхекспресирани при рак на простатата [50]. Проучванията показват, че HDAC1 допринася за агресивно туморно поведение и лоша прогноза, докато експресията на HDAC2 е свързана със съкратено време за преживяване без рецидив при пациенти с рак на простатата [51]. HDAC1–3 са силно експресирани при рак на простатата и в съответните лезии на HGPIN съвпадат със загубата на експресия на GSTP1 в туморни проби [51, 52]. Li et al. демонстрира, че инхибирането на HDAC1 от маспин, супресиращ тумора серпин, увеличава експресията на GSTP1 в човешки ракови клетки на простатата, потвърждавайки, че HDAC1 играе критична роля в медиираната от маспин реекспресия на GSTP1 [53].
Некодиращите РНК се появяват като нов клас ключови регулатори на гените [54, 55]. МикроРНК (miRNAs) са къси (~ 20–24 нуклеотиди) некодиращи РНК, които регулират генната експресия най-вече чрез улесняване на разцепването на целевата иРНК в растенията [56]. Интересното е, че miRNAs влияят върху експресията на целевия си ген най-вече чрез транслационна репресия при животните. miRNAs насочват mRNAs чрез несъвършено допълващо сдвояване на база към 3 ′ нетранслируемата област (3′UTR), за да регулират синтеза на протеин на целта, или чрез мъртво анилиране на целевото съобщение, или чрез потискане на транслацията при активно превеждащите рибозоми [57, 58]. Понастоящем miRBase разполага с 2588 зрели човешки miRNA от сглобяване на човешки геном (GRCh 38) до GenBank [59]. Предполага се, че тези много miRNAs са насочени към> 45 000 сайта, които представляват> 60% от човешките гени.
Потенциално регулиране на GSTP1 от miRNAs
Няколко изчислителни и експериментални подхода са използвани за идентифициране на miRNAs и техните насочени гени [70 ••, 71]. За това проучване използвахме изчислителни подходи за идентифициране на miRNAs, потенциално насочени и регулиращи експресията на GSTP1 (Таблица 1). Тези miRNAs включват miR-133a/b, miR-144/144 *, miR-153-1/2 и miR-590-3p/5p. В тази глава е подчертано кратко описание на тези miRNAs и тяхното участие в рака и регулацията на GSTP1.
miR-133a/b
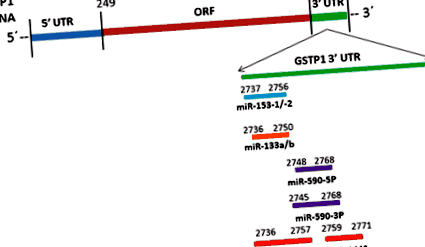
Схематично представяне на целеви сайтове miR-133-a/b, miR-153-1/2, miR-590-3P/5P и miR-144/144 * на GSTP1 3′UTR
miR-144/miR-144 *
miR153-1/2
miR-590-3p/5p
МикроРНК целеви бази данни, като TargetScan и miRanda, прогнозираха, че miR-590-3p/5p може да регулира GSTP1 mRNA и/или експресията на протеин miR-590-3p образува 7mer в позиции 57–63 на GSTP1 3′UTR. Изследването на mRNA последователността на GSTP1 разкри, че потенциални целеви сайтове на miR-590-3p/5p се намират при нуклеотиди 2748-2748 в 3'UTR региона (фиг. 1). Доказано е, че miR-590-3p/5p е регулиран при някои видове рак на човека, включително хепатоцелуларен карцином, ясноклетъчен бъбречно-клетъчен карцином, миелоидна левкемия и рак на маточната шийка [102–105]. Доказано е, че регулирането на miR-590-5p насърчава пролиферацията и инвазията на ясни клетъчни клетки на бъбречно-клетъчен карцином чрез понижаване на експресията на p21 (Waf1/Cip1) [103]. Доказано е също така, че се изразява диференциално при резистентния на кастра рак на простатата в сравнение с доброкачествената простатна хиперплазия [106]. TargetScan прогнозира PTEN като потенциални целеви гени на miR-590-3p/5p и беше установено, че активира PI3K-AKT сигнален път чрез понижаване на регулирането на PTEN за насърчаване на фосфорилирането на AKT1-S473 [107], което може да играе важна роля в регулирането на GSTP1 при рак на простатата.
Заключение, ограничения и бъдеща посока
Измерването на серумните нива на PSA не открива адекватно рака на простатата или предсказва прогноза след окончателна терапия. Следователно, има значително предизвикателство да се разработят нови неинвазивни стратегии за идентификация на биомаркери за точно откриване и прогнозиране на прогресията на рака на простатата. miRNAs са важни регулатори на онкогенни и туморни супресорни гени, които прихващат различни сигнални пътища и патологични процеси, свързани с туморогенезата. Многобройни публикации съобщават за потенциала на miRNA като клас от нови биомаркери в диагностиката и прогнозата на заболяването [63–68, 69 ••]. Нашият in silico анализ предполага, че miRNAs могат да упражняват своите функции чрез потенциално регулиране на експресията на GSTP1 и да играят важна роля в канцерогенезата на простатата (Таблица 1; Фиг. 1). С идентифицирането на изброените предполагаеми miRNAs, които регулират GSTP1, може да бъде дешифрирана по-подробна регулаторна роля, която може да бъде приложима при ранното откриване и прогнозиране на рак на простатата.
Въпреки това остават някои ограничения при тяхното разработване и замяна на конвенционалните биомаркери. Това включва липса на установен ендогенен контрол на miRNA за нормализиране на нивата на miRNA в телесните течности. В тази връзка, U6 малка ядрена РНК често се използва за нормализиране на нивата на miRNA; обаче нестабилната му природа и разграждането в серума не го определят като идеален стандартен контрол. Друго ограничение е освобождаването на miRNA в телесните течности, а нейната функционална роля и последици остават неизвестни и/или ограничени несъответствия при анализа на функцията на miRNA при рак на простатата. Освен това, не е установен точен механизъм (и) за причинно-следствена връзка за много miRNAs при рак на простатата, въпреки значителните усилия в такива изследвания. Следователно са необходими допълнителни проучвания, за да се разбере ролята и последиците от miRNA при рак на простатата чрез нови техники с висока производителност. Друга забележка, която трябва да се вземе предвид, е, че пост-транскрипционната генна регулация на miRNA, както и нейната целева mRNA, допълнително се модулират от RNA-свързващи протеини (RBP). Напоследък се характеризират множество RBP и много от тях играят роля както в стабилността на miRNA, така и на mRNA.
В заключение, техническият напредък в откриването на miRNAs, регулиращи експресията и функцията на GSTP1, може да има големи обещания като молекулярни биомаркери за рак на простатата. По-нататъшното разработване и прилагане на тези miRNA-регулиращи GSTP1 тестове върху клинични проби, включително кръв, урина, еякулат и биопсия на простатата за скрининг на рак и ранно откриване, може да има голямо обещание като кандидат клинични тестове. Необходима е нова поредица от изследвания, критично оценяващи прогнозните стойности на miRNAs при рак на простатата.
- Регулиране на MicroRNA глутатион S-трансфераза P1 при рак на простатата
- Профилактика на рак на простатата Медицина Джон Хопкинс
- Рискови фактори за рак на простатата Медицина Джон Хопкинс
- Честотата на рака на простатата е 3 пъти по-ниска при японските мъже тук; s Защо
- Рак на простатата Ръководство за възрастни мъже