Андреа Г. Изкуердо
1 Лаборатория по епигеномика в ендокринологията и храненето, Отдел за епигеномика, Instituto de Investigacion Sanitaria de Santiago (IDIS), Complejo Hospitalario Universitario de Santiago (CHUS/SERGAS), 15706 Сантяго де Компостела, Испания; [email protected] (A.G.I.); moc.liamtoh@sariejurcnelebana (A.B.C.)
2 CIBER de Fisiopatologia de la Obesidad y Nutricion (CIBERobn), Instituto Salud Carlos III, 28029 Мадрид, Испания
Ана Б. Crujeiras
1 Лаборатория по епигеномика в ендокринологията и храненето, Отдел за епигеномика, Instituto de Investigacion Sanitaria de Santiago (IDIS), Complejo Hospitalario Universitario de Santiago (CHUS/SERGAS), 15706 Сантяго де Компостела, Испания; [email protected] (A.G.I.); moc.liamtoh@sariejurcnelebana (A.B.C.)
2 CIBER de Fisiopatologia de la Obesidad y Nutricion (CIBERobn), Instituto Salud Carlos III, 28029 Мадрид, Испания
Фелипе Ф. Казануева
2 CIBER de Fisiopatologia de la Obesidad y Nutricion (CIBERobn), Instituto Salud Carlos III, 28029 Мадрид, Испания
3 Лаборатория по молекулярна ендокринология, Instituto de Investigacion Sanitaria de Santiago (IDIS), Complejo Hospitalario Universitario de Santiago (CHUS), 15706 Сантяго де Компостела, Испания
4 Молекулярна ендокринолгия, Университет на Сантяго де Компостела (USC), 15706 Сантяго де Компостела, Испания
Маркос К. Карейра
2 CIBER de Fisiopatologia de la Obesidad y Nutricion (CIBERobn), Instituto Salud Carlos III, 28029 Мадрид, Испания
3 Лаборатория по молекулярна ендокринология, Instituto de Investigacion Sanitaria de Santiago (IDIS), Complejo Hospitalario Universitario de Santiago (CHUS), 15706 Сантяго де Компостела, Испания
Резюме
Лептинът, хормон, който е в състояние ефективно да намали приема на храна и телесното тегло, първоначално се счита за използван при лечението на затлъстяване. Оттогава обаче е установено, че затлъстелите лица имат високи нива на циркулиращ лептин и са нечувствителни към екзогенното приложение на лептин. Неспособността на лептина да упражнява своите анорексигенни ефекти при затлъстели индивиди и следователно липсата на клинична полезност на лептина при затлъстяване се определя като лептинова резистентност. Това явление все още не е адекватно характеризирано. Изясняването на молекулните механизми, лежащи в основата на лептиновата резистентност, е от жизненоважно значение за прилагането на лептин като ефективно лечение за затлъстяване. Лептинът трябва да премине кръвно-мозъчната бариера (BBB), за да достигне хипоталамуса и да упражни своите анорексигенни функции. Механизмите, свързани с транспортирането на лептин през кръвно-мозъчната бариера, продължават да бъдат неясни, като по този начин се предотвратява клиничното приложение на лептин при лечението на затлъстяване. През последните години са разработени нови стратегии за възстановяване на отговора на лептин при затлъстяване. Ние обобщихме тези стратегии в този преглед.
1. Въведение
2. Кръвно-мозъчна бариера и затлъстяване
Кръвно-мозъчната бариера (BBB) се състои от няколко високоспециализирани клетъчни типа, които предпазват мозъка от токсични вещества и регулират преминаването на макромолекули, както и двупосочния транспорт на хранителни вещества и хормони между кръвта и мозъка. Приемът на храна и метаболизмът се регулират от различни хормони, като лептин, чиито нива на циркулация трябва да се регулират много точно и често се променят при затлъстяване. Тези хормони трябва да достигнат мозъка чрез преминаване на BBB чрез специфичен транспортер [12]. Тъй като много от тези транспортери са засегнати от механизми за насищане, циркулиращите нива на хормоните влияят върху тяхната активност и регулация и следователно транспортерите на ниво BBB играят критична роля в регулирането на метаболизма. В допълнение, затлъстяването може да генерира патологични промени в клетъчната цялост на ВВВ, независимо от носителите, което може да влоши патологичната ситуация на нивото на централната нервна система.
Затлъстяването и хроничната консумация на диета с високо съдържание на мазнини (HFD) водят до важни промени на нивото на BBB, както и в различни региони на мозъка, особено в регионите на невронални популации с високи метаболитни нужди, като хипокампуса [13, 14]. Някои проучвания върху гризачи показват, че храненето с HFD води до загуба на неврони в дъгообразното ядро и хипоталамуса [13], в допълнение към намаляване на целостта на BBB поради загубата на таницити (специализирани епендимални клетки в средната еминенция ) и превозвачи на ниво BBB [14].
3. Лептин, мозъчна и кръвно-мозъчна бариера
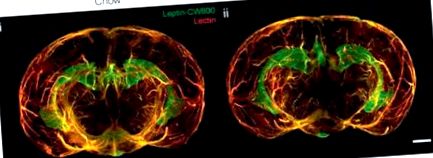
Триизмерна реконструкция на мозъка, показваща натрупването на флуоресцентен лептин (лептин-CW800) в средната еминенция (ME) и хориоиден плексус (CP) на постно (чау, стандартна диета) (i) и индуцирано затлъстяване (DIO) ) (ii) мишки. От [34] посетете http://creativecommons.org/licenses/by/4.0/.
През последните 25 години се смята, че лептиновата резистентност, както се наблюдава при затлъстяване, се дължи главно на загубата на способността на лептина да пресича BBB, главно чрез специфичния си транспортер, но като се имат предвид по-рано публикувани данни, молекулярната механизмите, замесени в лептиновата резистентност, както и механизмът, чрез който мозъкът изтегля лептина от системното кръвообращение, са слабо разбрани.
4. Възможно ли е да се използва лептин за лечение на затлъстяване?
Загубата на тегло, постигната с диети, базирани на калории, промени в начина на живот и/или рядко използвани фармакологични лечения срещу затлъстяване показват възстановяване на чувствителността към лептин, което може да се използва за поддържане на телесно тегло.
Независимо от механизма (механизмите), отговорен (и) за лептиновата резистентност, е вероятно да се използва лептин за отслабване, ако лептиновият рецептор и основният вътреклетъчен сигнален път са специално активирани в съответните части на мозъка. Използвани са различни методологични подходи (Фигура 2).
Схематично представяне на различни терапии против затлъстяване, основани на употребата на лептин (OBR = рецептор на лептин).
Ендогенният лептин е молекула, която не е много стабилна in vivo и има кратък полуживот, което означава, че е по-малко полезна в случай на лептинова резистентност. Следователно, използването на синтетични молекули, подобни на лептина, които са по-стабилни, може да помогне за активирането на OBR. Свързани с лептин аналози като 22–56, 57–92, 93–105 и 116–130 са способни да имитират взаимодействието и активирането на OBR, за да подобрят техните ефекти срещу затлъстяването, макар и с относително ограничен успех [43, 44]. OB3 е синтетичен лептинов агонист, съдържащ С-крайните аминокиселинни остатъци 116 ≥ 122. Този пептид пресича BBB чрез независим механизъм на OBRb, достигайки по-висока концентрация в централната нервна система в сравнение с лептина и намалявайки приема на храна и телесното тегло в модел на затлъстяване на мишки с дефицит на OBRb db/db [45]. В допълнение, той регулира енергийния баланс, гликемията и инсулиновата чувствителност при CB57/BL6 затлъстели мишки [46].
Няколко проучвания показват, че конвенционалните терапии за заместване на лептин при пациенти със затлъстяване имат много скромни ефекти. До този момент няколко проучвания предлагат комбинаторни терапии на различните хормони, участващи в енергийната регулация, за да въздействат върху различни механизми на действие и да избягват компенсаторните механизми. При резистентни на лептин плъхове комбинацията от амилин, 37-аминокиселинен анорексигенен хормон, с лептин води до по-голямо инхибиране на приема на храна и загуба на телесно тегло в сравнение с монотерапията с лептин, както и подобрен метаболизъм в дългосрочно [47,48,49,50,51,52,53,54]. При хората е използвана комбинация от прамлинтид ацетат (синтетичен аналог на амилин) и метрелептин (метионилова форма на лептин), което причинява по-голяма загуба на тегло в сравнение с тази, наблюдавана индивидуално при тези съединения [55,56]. Тази терапевтична стратегия обаче е спряна поради развитието на антитела срещу метрелептин.
Холецистокининът (CCK) и глюкагоноподобният пептид (GLP-1) и техните аналози са други молекули, които могат да бъдат използвани в комбинирани терапии с лептин. Подкожното приложение на CCK, амилин и лептин предизвиква забележително намаляване на приема на храна, телесно тегло и затлъстяване при DIO мишки [57]. Използването на лептин и екзендин-4, естествен лиганд на GLP-1 рецептора, доведе до възстановяване на чувствителността към лептин при DIO мишки, подложени на загуба на тегло [35]. Фибробластният растежен фактор 21 (FGF21) също е използван като ко-лечение с лептин за противодействие на лептиновата резистентност [35]. Забележително е, че в някои от тези проучвания е установено, че загубата на телесно тегло е недостатъчна за възстановяване на чувствителността към лептин, което показва необходимостта от използване на комбинирани стратегии с два или повече хормона за оказване на значителни и трайни ефекти върху загубата на тегло [35, 58]. Повишаващи лептина ефекти са наблюдавани и при едновременното му приложение с клътерин, лиганд за свързан с рецептор с ниска плътност (LDL) протеин-2 (LRP2) [59]. Докладвани са и други проучвания върху животни, при които е доказано, че лечението с лептин с инсулин насърчава покафеняване на бялата мастна тъкан [60] и лекарства, които активират 5-хидрокситриптамин (5-НТ) 2С рецептори, като мета-хлорофенилпиперазин, могат да упражнят адитивен ефект при отслабване [61].
5. Други потенциални терапии
Развитието на лептинова резистентност при затлъстяване също е свързано с увеличаване на стреса на ендоплазмен ретикулум (ER) при животински модели [86]. Химическите шаперони са група съединения, които са характеризирани като агенти, които увеличават функционалността на ER и намаляват натрупването и агрегирането на неправилно сгънати протеини в ER чрез намаляване на ER стреса [87]. Четири-фенилбутиратът (PBA) и тауроурсодезоксихолевата киселина (TUDCA) са одобрени от Американската администрация по храните и лекарствата (FDA) молекули [88,89], които са били използвани за намаляване на ER стреса на хипоталамусно ниво, като по този начин възстановяват чувствителността към лептин при DIO мишки от намаляване на приема на храна и телесно тегло [86]. Други съединения като флувоксамин, инхибитор на обратното поемане на серотонин и флурбипрофен, молекула с противовъзпалителен капацитет, са в състояние да намалят ER стреса и резистентността към лептин заедно с причиняване на загуба на тегло при миши модели [90,91].
Тъй като различни невропептиди могат да бъдат доставени в централната нервна система чрез интраназално приложение, интраназалният лептин може да се окаже ефективен подход за лечение на затлъстяването. Плъховете със затлъстяване, получаващи лептин интраназално, запазват орексигенния ефект на лептина по начин, подобен на този, наблюдаван при плъхове без затлъстяване [92]. Това активира фосфорилирането на STAT3 в специфични части на мозъка и намалява чернодробните липиди чрез увеличаване на секрецията на чернодробни триглицериди и намаляване на липогенезата, с възможно терапевтично приложение при безалкохолно мастно чернодробно заболяване (NAFLD) [93]. Въпреки това, използването на интраназален лептин за лечение на пациенти със затлъстяване представлява някои предизвикателства, които все още не са преодолени, като високи дози пептидни хормони, променлива абсорбция от носната лигавица и високата цена на рекомбинантен лептин.
Независимо от механизма (механизмите), участващ в появата на лептинова резистентност при индивиди със затлъстяване, важно е да се отбележи наличието на високи концентрации на циркулиращ лептин. Това може да е и произходът на лептинова резистентност. Високите нива на лептин могат да бъдат отговорни за активирането на молекулярните механизми, залегнали в основата на лептиновата резистентност, и следователно възможна стратегия може да бъде намаляване на нивата на циркулиращия лептин до техните физиологични нива. Предишни данни, получени и патентовани от нашата група, показват, че лечението на DIO плъхове с поликлонален серум срещу антилептиново антитяло е причинило намаляване на нивата на циркулиращ лептин, намален прием на храна и е причинило
5% загуба на телесно тегло.
6. Заключения
Принос на автора
Всички автори са участвали в написването на статията.
Финансиране
Тази работа беше подкрепена от Centro de Investigacion Biomedicaen Red de Fisiopatología de la Obesidad y Nutrición (CIBERobn) и безвъзмездни средства от Instituto de Salud Carlos III (PI17/01287), съфинансирани от Европейския фонд за регионално развитие (FEDER). Andrea G. Izquierdo и Marcos C Carreira се финансират от CIBERobn, а Ana B. Crujeiras се финансира от изследователски договор „Miguel Servet“ (CP17/00088) от Instituto de Salud Carlos III, съфинансиран от Европейския фонд за регионално развитие (FEDER).
Конфликт на интереси
Авторите не декларират конфликт на интереси.
- Резистентността към лептин е предразполагащ фактор за индуцирано от диетата затлъстяване American Journal of
- Резистентност към лептин Възможен интерфейс между затлъстяването и белодробните нарушения
- Инсулинова и лептинова резистентност при хиперлептинемия при мишки, при които липсва диабет с андрогенен рецептор
- Как калифорнийската кухня за пица побеждава конкуренцията, списание FSR 34 години по-късно
- Хиперлептинемията е необходима за развитието на лептинова резистентност