Свързани термини:
- Деменция
- Амиотрофична латерална склероза
- Моторен неврон
- Убиквитин
- ДНК-свързващ протеин
- Автофагия
- Тау протеин
- Фронтотемпорална деменция
- Протеин
- Фронтален вариант фронтотемпорална деменция
Изтеглете като PDF
За тази страница
Неврогенетика, част II
Джесика Делеон, Брус Л. Милър, в Наръчник по клинична неврология, 2018
Генът FUS е разположен на 16p11.2 и кодира протеина, слят в саркома, който играе роля в различни клетъчни процеси, включително клетъчна пролиферация (Bertrand et al., 1999), възстановяване на ДНК (Baechtold et al., 1999), транскрипция регулиране, снаждане на РНК (Yang et al., 1998) и транспорт на РНК (Zinszner et al., 1997). Той може също да играе роля в невроналната пластичност и поддържането на дендритната цялост (Fujii and Takumi, 2005; Fujii et al., 2005). Мутациите в FUS причиняват преразпределение на FUS протеин от ядрото към цитоплазмата, където той образува невротоксични агрегати (Neumann et al., 2009).
В момента са идентифицирани 23 патологични мутации (Molgen: Cruts et al., 2012). Унаследява се по автозомно-доминиращ начин с непълна пенетрантност. Забележително е, че докато ALS с FUS патология обикновено се дължи на FUS мутация, повечето случаи на FTD с основна FUS патология са спорадични (Neumann et al., 2009; Rohrer et al., 2010a; Urwin et al., 2010; Snowden et al ., 2011). В един център мутациите на FUS представляват 3% от спорадичните случаи на FTD (Seelaar et al., 2010).
FUS мутациите първоначално са идентифицирани в ALS (Kwiatkowski et al., 2009; Vance et al., 2009). През 2009 г. Neumann и колеги описаха група пациенти с FTD с определен фенотип и патология. Пациентите са имали ранна възраст, често по-млади от 40 години, с тежки промени в поведението и личността, включително промени в личната хигиена, дезинхибиране и асоциално поведение, неподходящо сексуално поведение, хипералност и психоза. Тези поведенчески промени не са придружени от забележими промени в езика или двигателната функция (Neumann et al., 2009). Последващи проучвания предполагат, че стереотипното поведение (Snowden et al., 2011), халюцинациите и заблудите също могат да бъдат по-чести при FUS мутации (Urwin et al., 2010).
При образна диагностика пациентите с патология на FUS могат да имат повишена атрофия на опашка в сравнение с пациенти с основна патология на TDP или тау (Seelaar et al., 2010; Josephs et al., 2010). Те също могат да имат повишена хипокампална склероза (Josephs et al., 2010; Seelaar et al., 2010).
По отношение на патологията има уникални невронални и глиални включвания с усукана или извита морфология, които са били убиквитин-положителни, но TDP-43-отрицателни, които след това са идентифицирани като протеин FUS (Neumann et al., 2009; Urwin et al., 2010 ).
Неврохимични аспекти на фронтотемпоралната деменция
Оксидативен стрес при фронтотемпорална деменция
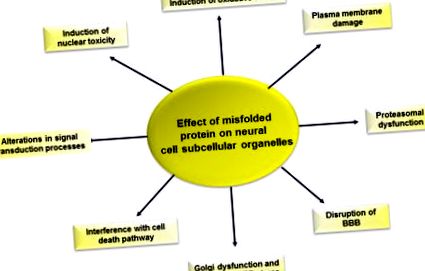
Фигура 6.5. Ефект на неправилното сгъване на протеините върху функцията на нервните клетки.
Фигура 6.6. Метаболизъм на нормални и неправилно сгънати протеини в нервните клетки. Неправилно сгънатите протеини могат да бъдат повторно сгънати или от шаперони (Hsps), или обработени чрез протеазомно разграждане чрез добавяне на убиквитин (Ub). Натрупването на неправилно сгънати протеини или протеинови агрегати води до смърт на невроналните клетки по неизвестен механизъм.
Фигура 6.7. Хипотетична диаграма, показваща неврохимични процеси, допринасящи за патогенезата на фронтотемпоралната деменция (FTD).
ARA, арахидонова киселина; cPLA2, цитозолна фосфолипаза А2; СОХ-2, циклооксигеназа-2; Glu, глутамат; I-кВ, инхибиторна субединица на NF-кВ; IL-1β, интерлевкин-1β; IL-6, интерлевкин-6; 5-LOX, 5-липоксигеназа; MCP-1, моноцитен хемоаттрактант протеин-1; NF-kB, ядрен фактор-kB; NF-κB-RE, елемент на ядрен фактор κB-отговор; NMDA-R, NMDA рецептор; NO, азотен оксид; ONOO -, пероксинитрит; PtdCho, фосфатидилхолин; ROS, реактивни кислородни видове; TNF-α, фактор на туморна некроза-α.
Животински модели за изследване на човешки невродегенеративни заболявания
5.1.3 Модели FUS
FUS е идентифициран поради неговите онкогенни свойства след хромозомна транслокация, водеща до сливане на пресечен FUS протеин с транскрипционен фактор CHOP (Crozat et al., 1993; Rabbitts et al., 1993). Генът FUS е разположен на 16p11.2 и съдържа 15 екзона, кодиращи многофункционален 526 аминокиселинен протеин (Prasad et al., 1994) със сложна доменна структура. FUS се разпространява повсеместно във всички клетки. Някои данни за гризачи предполагат, че експресията извън ЦНС намалява с възрастта, като липсва в скелетните мускули на мишки, черния дроб и бъбреците от 80-дневна възраст (Huang et al., 2010). FUS свързва ДНК и РНК и представя предимно ядрена локализация (Bosco and Landers, 2010; Gal et al., 2011).
Мутациите в FUS са описани като допринасящи в подобен дял от случаите на fALS (FUS-ALS) като мутациите на TDP-43. FUS може да функционира надолу по веригата TDP-43 и паралелно с други РНК-свързващи протеини (Kabashi et al., 2011). Разработването на модели на FUS-ALS е от съществено значение за изясняване на механизмите, чрез които мутациите в този протеин причиняват ALS и как отклоненият метаболизъм на РНК може да доведе до невродегенерация.
Има четири трансгенни линии на гризачи, свръхекспресиращи FUS: трансгенни мишки, които свръхекспресират човешки FUS от дивия тип, маркирани с HA, под контрола на мишкия прионов промотор (Mitchell et al., 2013); соматични мозъчни трансгенни мишки, експресиращи V5-маркирани човешки FUS от див тип, мутанти R521C и FUS, които нямат своя сигнал за ядрена локализация (D14) (Verbeeck et al., 2012); трансгенни плъхове, които условно експресират човешки FUS от див тип или мутант под системата на елементите за отговор на тетрациклин TRE (Huang et al., 2011); и трансгенни плъхове, които експресират мутантни FUS под промотора на CaMKIIa с TRE (Huang et al., 2012). Тези модели показват различни фенотипни прояви, вариращи от различни нива на двигателно участие с мускулна денервация, аксонопатия и гръбначна дегенерация, до когнитивни дефицити с увреждане на паметта и хипокампална невронална смърт.
Фронтотемпорална деменция
FUS-положително FTLD (FTLD-FUS)
По-голямата част от тау-отрицателните/TDP-43-отрицателни, убиквитин-положителни случаи на FTLD имат положително имунохистохимично оцветяване на FUS протеина, като по този начин се разграничава трета категория FTLD невропатология. Протеинът FUS съдържа 526 аминокиселини. Той е като ядрен протеин, участващ в възстановяването на ДНК и регулирането на снаждането на РНК. Мутациите в гена FUS на хромозома 16 подчертават нейната патогенетична роля в клиникатопатологичния спектър на FTD и ALS. 55, 56 Клинично, повечето случаи на FTLD-FUS се характеризират с ранна поява на FTD (възраст 57
Животински модели за невродегенеративни нарушения
Хитоми Цуджи, Коджи Яманака, в Биотехнологията на животните, 2014
FUS/TLS
Още пет процента от наследствените случаи на ALS са причинени от доминиращи мутации в гена, който кодира слятия сарком (FUS, известен също като транслоциран в липосарком протеин (TLS)). FUS е също РНК- и ДНК-свързващ протеин, състоящ се от два богати на аргинин/глицин (RGG) домейни, домейн на Zn-пръст, RRM, богат на глицин регион и Q/G/S/Y-богат регион. Повечето болестотворни мутации се намират в С-терминалния регион, със сигнал за ядрена локализация, но някои мутации са в богатия на глицин регион. Анормални агрегати на FUS протеин в цитоплазмата или ядрото се откриват в засегнатите двигателни неврони на гръбначните мозъци. FUS също така пренася между ядрото и цитоплазмата и регулира транскрипцията и сплайсинга на РНК. Като се има предвид сходството между функцията TDP-43 и FUS и доменната структура на протеина, дефектите в метаболизма на РНК могат да бъдат един от основните пътища, водещи до невродегенерация на ALS моторни неврони (Da Cruz and Cleveland, 2011).
Амиотрофна странична склероза 1 и много заболявания
Амиотрофична патология на страничната склероза
Основният патологичен подпис на ALS е загубата на двигателни неврони в мозъка, хипоглосалното ядро и гръбначния мозък. Микроскопски ALS се характеризира с агрегация и отлагане на протеини в двигателните неврони (Al-Chalabi et al., 2012; Blokhuis, Groen, Koppers, van den Berg, & Pasterkamp, 2013). Убиквитин-положителни и отрицателни включвания се наблюдават в двигателните неврони. Убиквитин-положителните агрегати са класифицирани като приличащи на тялото хиалин или подобни на чиле Lewy и често са близо до неврофиламентозни натрупвания в зоната на аксоновия хълм (Al-Chalabi et al., 2012; Blokhuis et al., 2013; Mackenzie et ал., 2007). С изключение на случаите на SOD1 и кондензирани в саркома/преведени в липосарком протеини (FUS), тези включвания са TDP-43 – положителни, потенциален общ процес надолу по веригата. Любопитното е, че SOD1- и FUS-медиираният ALS показва натрупвания на SOD1 или FUS протеини, а не TDP-43 включвания в двигателните неврони. Други патологични агрегати, свързани с ALS, включително спорадични случаи, могат да съдържат протеини или продукти, произхождащи от гени, за които е установено, че са мутирали в ALS, като FUS, OPTN, UBQLN2 и C9orf72. Как и защо произхождат тези агрегати е обект на активно разследване.
Като цяло вътреклетъчната агрегация на протеини на ALS изглежда произтича от наличието на поне едно от трите състояния в болния двигателен неврон и вероятно взаимодействие и на трите: (1) повишена склонност към агрегиране на протеини, (2) намаляване на пътищата на разграждане на протеините и (3) повишен клетъчен стрес. Структурните промени на протеиново ниво, като неправилно нагъване на протеини, особено в домейни с ниска сложност (наричани на някои места „прион-подобни домейни“), изглежда улесняват агрегирането (Udan-Johns et al., 2014). Нарушаването на нормалните пътища за разграждане на протеини може да доведе до натрупване на агрегирани протеини (Alami et al., 2014; Bosco, Lemay, et al., 2010). Агрегацията на протеини може да доведе до клетъчен стрес и активиране на възпалителни пътища в неврона и околните клетки, което може да ускори белтъчната агрегация (Robberecht & Philips, 2013).
Убиквитин-отрицателните включвания, тела на Bunina, открити в цитоплазмата на LMN, също са характерни за ALS. Те са малки и кръгли цистатинови С-положителни еозинофилни включвания, съдържащи аморфен електрон-плътен материал, свързан с тръбни и везикуларни структури, визуализирани чрез електронна микроскопия (Okamoto, Mizuno, & Fujita, 2008). Докато точното им естество и значение остават неясни, се предполага, че те могат да произхождат от клетъчни органели, като ендоплазмен ретикулум, или да са резултат от абнормен метаболизъм на протеини.
Вътреклетъчни агрегати са наблюдавани и в екстрамоторни региони, като фронтални и темпорални кортикали, хипокампус и малкия мозък. Те присъстват както при fALS, така и при sALS, както и при други невродегенеративни заболявания, като фронтотемпорална лобарна дегенерация (FTLD). Това предполага, че агрегацията на протеини може да свърже fALS и sALS и невродегенеративни заболявания като цяло. Дали наличието на протеинови агрегати само по себе си е ключовото вредно събитие, остава предмет на дебат (Brotherton, Li, & Glass, 2013), въпреки че натрупванията ясно отразяват аномалии в нормалните клетъчни процеси. Някои доказателства сочат, че тези протеинови агрегации са необходими, но не са достатъчни, за да причинят невродегенеративно заболяване и че произтичащата от това загуба на протеинова функция от изолирани протеини или възпалението, индуцирано в неврона и околните глии, е виновна за дегенеративния процес (Robberecht & Philips, 2013 ).
Деменция и системни заболявания
Фронтотемпорална деменция
Фронтотемпоралната деменция е клинично, патологично и генетично разнообразно разстройство. При невропатологично изследване много случаи са свързани с включвания, съдържащи тау, стабилизиращ микротубула протеин. 30 Невропатологията в други случаи с подобни клинични фенотипи демонстрира включвания, съдържащи TAR ДНК-свързващ протеин от 43 kDa (TDP-43) и без tau оцветяване; други са тау отрицателни и TDP-43 отрицателни, но положителни за протеина, слят в саркома; а други са тау отрицателни, TDP-43 отрицателни, слети в саркома отрицателни и убиквитин положителни. 31 Поради припокриването между клинични и патологични подтипове е трудно да се предскаже със сигурност патология на отделен пациент, като се използват съвременни диагностични техники, но като цяло клиничните синдроми, свързани с тау включванията, са поведенчески вариант фронтотемпорална деменция, прогресивна нефлуентна афазия, прогресивна надядрена парализа, и кортикобазален синдром. Семантичната деменция, вариант на фронтотемпорална деменция с прогресивно увреждане при именуване и разбиране на една дума, обикновено се свързва с патологията на TDP-43. Много положителни случаи на TDP-43 имат коморбидно заболяване на двигателния неврон. Няма специфични лечения.
Средната възраст на настъпване е между 50 и 60 години; честотата не се увеличава с възрастта. 31 Фронтотемпоралната деменция представлява значителна част от случаите на деменция при хора на възраст между 45 и 65 години. Времето между появата на симптомите и смъртта е малко по-кратко от това при болестта на Алцхаймер. 32 Поведенческият вариант се представя с личностни промени, апатия или импулсивност, емоционално притъпяване, загуба на съпричастност и социална информираност, липса на прозрение, психическа твърдост, промяна в хранителните навици и лоша лична хигиена, всички отразяващи дегенерация предимно на недоминиращата фронтална и темпоралните лобове (фиг. 61-1). 33 Когато патологичният процес засяга доминиращото полукълбо, прогресивната неточна афазия е типичният фенотип и е свързан с по-малко поведенчески промени и по-известни езикови трудности. 31
Фигура 61-1. Фронтотемпорална деменция. Т1-претегленото изображение с магнитен резонанс (MRI) на мозъка демонстрира атрофия на недоминиращия (десен) фронтален лоб непропорционално на други области.
Амиотрофна странична склероза и деменция
Д-р Пол Х. Гордън,. Д-р Филип Корсия, доктор по диета и хранене при деменция и когнитивен спад, 2015 г.
Приложения за други деменции
Различни видове деменция могат да възникнат при ALS, но връзката е най-силна с фронтотемпоралната лобарна дегенерация (FTLD); болестите се припокриват клинично, патологично и генетично (FTD-ALS) [36]. FTLD се отбелязва клинично от прогресивни промени в изпълнителната функция, език и поведение; невроизобразяването показва хипометаболизъм и атрофия на челните и предните темпорални дялове. Подобно на други невродегенеративни нарушения, FTLD има протеинови включвания (tau, TAR ДНК-свързващ протеин-43 и слят в саркомен протеин) в засегнатите неврони. При ALS включванията се срещат в двигателните неврони, докато при ALS-FTD включванията се разпространяват в клетките през фронталния и темпоралния лоб. Поведенческите подгрупи на FTLD и FTD-ALS изглежда имат по-младо начало от другите деменции.
До 15% от пациентите с FTLD и 30% от пациентите с ALS изпитват синдром на припокриване [57]. Пациентите с двете нарушения имат по-кратко време за оцеляване. fALS-FTD е свързан с GGGGCC хексануклеотиден повтор в некодиращия регион на гена C90RF72 на хромозома 9p21 [37]. Тази мутация също обяснява редки случаи на спорадичен ALS-FTD.
Дихателната недостатъчност, хипоксемия и хиперкапния също могат да причинят промени в паметта; неинвазивната вентилация може да доведе до подобряване на симптомите. По същия начин депресията, умората и страничните ефекти на лекарствата могат да повлияят на познанието.
ALS и други невродегенеративни заболявания, включително Алцхаймер, Хънтингтън и Паркинсон, показват агрегация на протеини в мозъка. Клинично и патологично невродегенеративните нарушения изглежда започват фокално [58]. Симптомите прогресират, когато патологията се разпространява в съседни нервни клетки. Изглежда, че някои протеини имат прион-подобни домени, с тенденция към самоагрегиране [59]. Неправилно сгънатият протеин може да се предава от клетка на клетка, тъй като ненормалните протеини индуцират съседни протеини от див тип да приемат патологична конформация. Такъв е случаят с FUS и TDP-43, които съдържат прионен домейн, склонен към патологично неправилно сгъване. Експериментални доказателства за прион-подобно разпространение съществуват и за SOD1. Протеиновите агрегати могат също да насърчават други патофизиологични процеси като митохондриална дисфункция и изчерпване на енергията, възбуда на глутамат и индукция на възпалителни медиатори. Неправилно сгънати протеинови агрегати могат да осигурят молекулярна цел за интервенции с последици за всички невродегенеративни заболявания; терапевтичен пробив за човек вероятно би се превърнал бързо в други разстройства.
Биопсична патология на невродегенеративни нарушения при възрастни
Хистопатология
Много нови открития в генетиката и протеинопатията през последното десетилетие потвърдиха хетерогенността на FTLD и очертаха нейните патологични варианти въз основа на типа протеини, натрупани в клетките, както демонстрира IHC. Понастоящем FTLD се класифицира в две основни и три малки групи въз основа на IHC на убиквитин (вж. Фиг. 27.11E и F) или p62, фосфорилиран тау, TDP-43 и слети в саркома протеини (FUS) и обобщено по-долу. От тях групите (1) и (2) заедно представляват до 90% от случаите на FTLD, като всеки от тях има подобна честота. Повечето случаи (FTLD-U) показват повсеместно включени цитоплазматични и ядрени включвания с различна форма в невроните в различни мозъчни региони, които не могат да бъдат разграничени от подобни на скейн включвания, открити в спорадични ALS. Трябва да се отбележи, че LFB/H & E и сребърните петна могат да идентифицират и класифицират повечето случаи на FTLD-tau без помощта на IHC и че точното тълкуване на IHC изисква опит.
FTLD-тау с включвания tau (+), TDP-43 (-) и FUS (-): PSP, CBD, болест на Pick, FTDP-17 (MAPT), AGD, PART и редки образувания
FTLD-TDP с включвания TDP-43 (+), tau (-) и FUS (-): някои C9 + FTLD-ALS, FTDP-17 (GRN), редки случаи с TARDBP (генно кодиране за TDP-43) или VCP мутации
FTLD-FUS с FUS (+), tau (-) и TDP-43 (-) включвания: атипични FTLD-U (aFTLD-U), невронална междинна болест на включване на нишки (NIFID) и базофилно включване на тялото (BIBD); FUS мутациите не винаги се идентифицират
FTLD-UPS (убиквитин-протеазомна система) с включения убиквитин (+), p62 (+), tau (-), TDP-43 (-) и FUS (-): мутации в CHMP2B и някои C9 + FTD-ALS
FTLD-ni (няма откриваема имунореактивност за убиквитин, p62, tau, TDP-43 или FUS)
- Skin Turgor - общ преглед на ScienceDirect теми
- Париетални клетъчни антитела - общ преглед на ScienceDirect теми
- Protein Sparing - общ преглед на ScienceDirect теми
- Непоносимост към протеини - общ преглед на ScienceDirect теми
- Плесени (гъби) - общ преглед на ScienceDirect теми