Сезар Л. Морено
1 Катедра по неврология и Мозъчен институт на Фридман, Медицинско училище Icahn в планината Синай, Ню Йорк, Ню Йорк, Съединени американски щати
Линда Янг
1 Катедра по неврология и Мозъчен институт Фридман, Медицинско училище Icahn в планината Синай, Ню Йорк, Ню Йорк, Съединени американски щати
Пени А. Дакс
1 Катедра по неврология и Мозъчен институт Фридман, Медицинско училище Icahn в планината Синай, Ню Йорк, Ню Йорк, Съединени американски щати
Fumiko Isoda
1 Катедра по неврология и Мозъчен институт Фридман, Медицинско училище Icahn в планината Синай, Ню Йорк, Ню Йорк, Съединени американски щати
Ян М. А. ван Дюрсен
2 Катедра по детска и юношеска медицина, Медицински колеж Mayo Clinic, Рочестър, Минесота, Съединени американски щати
Чарлз V. Mobbs
1 Катедра по неврология и Мозъчен институт Фридман, Медицинско училище Icahn в планината Синай, Ню Йорк, Ню Йорк, Съединени американски щати
Концептуализация: CLM LY PAD CVM FI JMAD.
Официален анализ: CLM LY CVM FI JMAD.
Придобиване на финансиране: CLM CVM.
Разследване: CLM LY PAD FI.
Методология: CLM LY CVM FI JMAD.
Администрация на проекта: CLM LY PAD CVM FI JMAD.
Ресурси: CVM JMAD.
Надзор: CVM FI JMAD.
Проверка: CLM LY PAD CVM FI JMAD.
Визуализация: CLM LY PAD CVM FI JMAD.
Писане - оригинален проект: CLM CVM.
Писане - преглед и редактиране: CLM LY PAD CVM FI JMAD.
Свързани данни
Всички съответни данни са в хартията и нейните поддържащи информационни файлове.
Резюме
Съобщаваме за корелация между хипоталамусната експресия на свързващ протеин (Cbp) и продължителността на живота и че инхибирането на Cbp предотвратява защитните ефекти на диетичните ограничения по време на стареенето, което предполага, че хипоталамусният Cbp играе роля в отговорите на хранителния статус и енергийния баланс. Последните GWAS и мрежовите анализи също така включват Cbp като най-свързания ген при взаимодействията протеин-протеин при диабет тип 2 при човека. Настоящите проучвания разглеждат механизмите, посредничащи за ролята на Cbp при диабет чрез инхибиране на хипоталамусния Cbp, използвайки Cre-lox стратегия. Инхибирането на Cbp на хипоталамуса води до дълбоко затлъстяване и нарушена хомеостаза на глюкозата, увеличен прием на храна и намалена телесна температура. В допълнение, тези промени са придружени от молекулярни доказателства в хипоталамуса за нарушено сигнализиране за лептин и инсулин, преминаване от метаболизъм на глюкоза към липиди и намалена иРНК на Pomc, без ефект върху движението. По-нататъшната оценка на значимостта на метаболитния превключвател демонстрира, че подобрената експресия на хипоталамусния Cpt1a, който насърчава метаболизма на липидите, по подобен начин води до повишено телесно тегло и намалена PomC иРНК.
Въведение
Нарастващото разпространение на диабет тип 2, свързано със затлъстяването, представлява една от най-големите заплахи за световното здраве през 21 век [1], но механизмите, допринасящи за тези синдроми, трябва да бъдат изяснени. Хипоталамусните неврони, чувствителни на хранителни вещества, представляват ключов локус за усещане и регулиране на енергийния баланс и метаболизма на глюкозата, така че механизмите, медииращи тези хипоталамусни функции, са от основно значение. Докато хипоталамусното засичане на лептин и инсулин медиира аспекти на енергията и глюкозната хомеостаза [2], специализираните хипоталамусни неврони също усещат глюкозата чрез механизми, подобни на тези на панкреатичните бета-клетки [3], и тези неврони могат да регулират кръвната глюкоза [4]. Хипоталамусните глюкозно-чувствителни неврони отдавна се предполага, че играят роля в регулирането на енергийния баланс [5], но ролята на тези неврони в регулирането на енергийния баланс остава да бъде определена. Независимо от това последните проучвания предполагат, че метаболитното преминаване от метаболизма на хипоталамусната глюкоза към метаболизма на хипоталамусния липид насърчава фенотипите със затлъстяване [6,7].
По-рано съобщавахме, че хипоталамусната експресия на свързващ протеин (Cbp) положително корелира с продължителността на живота на 5 миши щама [8]. Съвсем наскоро наблюдаваме, че диетичните ограничения предизвикват хипоталамусен Cbp при мишки, свързан със защитни ефекти срещу протеотоксичност [9]. По същия начин, диетичните ограничения при Caenorhabditis elegans индуцират Cbp и блокирането на тази индукция предотвратява защитните ефекти от диетичните ограничения по време на стареенето [8]. В допълнение, неотдавнашните GWAS и мрежовите анализи включват Cbp като най-свързания ген при протеин-протеиновите взаимодействия при диабет тип 2 [10]. Тези доклади предполагат функция за Cbp в чувствителността на хранителните вещества и енергийния баланс.
Настоящите проучвания изследват ролята на хипоталамусния Cbp в енергийния баланс и глюкозната хомеостаза. Тези проучвания демонстрират, че инхибирането на Cbp на хипоталамуса произвежда стабилни затлъстели фенотипи, включващи както увеличен прием на храна, така и намалена телесна температура, свързана с нарушена хомеостаза на глюкозата. Тези промени са свързани с хипоталамусния молекулен профил, който показва преминаване от метаболизма на глюкозата към липидния метаболизъм, дори при контролирани с двойно хранене и съпоставени с теглото, подкрепящи, че този молекулярен профил причинява, а не е резултат от затлъстяването . Допълнително подкрепяйки причинно-следствена роля, ние демонстрираме, че засилената хипоталамусна експресия на карнитин палмитоилтрансфераза 1А (Cpt1a), ключов ензим, насърчаващ липидния метаболизъм, произвежда подобни затлъстели фенотипи, свързани с намален хипоталамус на хипоталамуса Про-опиомеланокортикотропин (Pomc). Тези проучвания показват, че намаленият Cbp на хипоталамуса насърчава фенотипите със затлъстяване, правдоподобно отчасти чрез засилване на метаболизма на хипоталамусния липид и намаляване на метаболизма на хипоталамусната глюкоза, свързан с намаления хипоталамусен Pomc.
Материали и методи
Животни
Cbp (флокс/флокс) разплодни двойки са получени от лабораторията Jan van Deursen (Mayo Clinic, Rochester, MN); те са произведени, както е описано [11]. Всички проучвания с мишки бяха специално одобрени с разрешение и в съответствие с Институционалния комитет за грижи и употреба на животните (протоколи IACUC 12–0044 и 12–0169) от Медицинското училище Icahn в планината Синай. Мишките бяха държани под 12-часова светлина: 12-часови тъмни цикли.
Хирургични процедури и вирусна доставка
Имунохистохимия
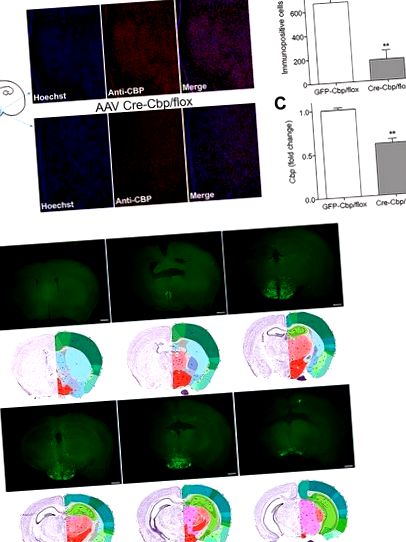
Животните бяха перфузирани, използвайки студен 4% параформалдехид в PBS, както е описано [13]. Мозъкът се екстрахира и се поставя в 4% параформалдехид при 4 ° С за една нощ. Свободно плаващи секции бяха приготвени чрез нарязване с дебелина 75 μm с помощта на вибратом и събрани в PBS. Мозъчните филийки бяха измити и блокирани за 1,5 часа в 5% нормален кози серум и 0,3% Triton X. Резените бяха инкубирани с Anti-CBP (SC-1211; 1: 100) (Santa Cruz Biotechnology, Dallas, TX) O/N при 4 ° С. След инкубационните секции бяха оцветени с Alexa Fluor 658 Anti-заешки IgG (A-11011; 1: 400) и Hoescht (H1399; 2 μg/ml) (Life Technologies). След това секциите бяха монтирани на слайдове с помощта на Fluoromount G (Beckman Coulter, Fullerton, CA). Всички изображения са получени с конфокален микроскоп Zeiss LSM 780, използващ 10x обектив Neofluar. 1024x1024 12-битови изображения бяха заснети с помощта на ZEN 2012 версия 8.1 и обработени във Фиджи. CBP имунопозитивни клетки от едно стъкло (дебелина 75 μm) на животно, което включва мястото на инфузия в медиобазалния хипоталамус с помощта на ROI маска (S1 Фиг.) От същата област, са преброени и оценени с помощта на заслепен дизайн и функцията за анализ на частиците във Фиджи.
Измерване на кръвната глюкоза и инсулин
Кръвта от опашката се събира и глюкозата в кръвта се измерва с помощта на глюкомер Bayer Contour (Bayer, Mountain View, CA). Тестовете за толерантност към глюкозата се провеждат след 4-часово гладуване, последвано от интраперитонеално (i.p) инжектиране на 20% глюкоза във физиологичен разтвор, адаптиран към телесното тегло (10 μl/g). Кръвният инсулин беше получен с помощта на ултра-чувствителен комплект ELISA за инсулин на мишка (Crystal Chem, Downers Grove, IL).
Администрация на храните и записи на животни
Всички животни бяха отделно поставени в клетки след инжектиране на вируса. Приемът на храна е измерен 2 седмици след вирусно раждане. Всяка разлята храна се събира и изважда от измерванията на приема на храна. На две контролни групи, инжектирани или с AAV-Cre, или с AAV-GFP, беше разрешен свободен достъп до чау-диета. Още две експериментални групи бяха създадени, използвайки следния протокол, за да съответстват на телесното тегло от времето на операцията. Последните се претеглят всеки ден и им се дават подходящи грамове храна, за да се поддържа първоначалното телесно тегло. За изследване на енергийните разходи, започващи една седмица след операцията, групите с инфузия на AAV-Cre или AAV-GFP са хранени по двойки, като се осигуряват хранителни гранули 1 час преди изгасването на светлините. Животните са получили NIH-31 формула за чау (Harlan Teklad Laboratories, Madison, WI) или диета с високо съдържание на мазнини 20% протеин, 35% въглехидрати, 45% мазнини). Температурата на ядрото на тялото беше записана след обезглавяване чрез ректална сонда с помощта на термодвойка микросонда IT-1E и термометър Bat-12 (Physitemp, Clifton, NJ).
Количествено определяне на иРНК
(A) Представителни изображения, показващи ядрено оцветяване на Hoescht (синьо), имунореактивна CBP (червено) и колокализация (розово) след 3 седмична хипоталамусна инфузия на AAV-GFP или AAV-Cre (B) Брой имуноположителни клетки ± SEM в медиобазалния хипоталамус ( n = 5–6) (С) Миши хипоталамус Cbp ± SEM, количествено определена чрез RT-PCR (n = 14–20). (D) Представителни изображения на коронални срези, събрани 3 седмици след стереотаксично доставяне. Изображенията са подредени от рострален до каудален заедно със съответните раздели на Ален Атлас за справка [16]. Скала = 800 μm.
Статистически анализ
Всички физиологични записи на животни са анализирани с помощта на софтуер PRISM 5, като се използва двупосочен ANOVA, последван от Bonferroni или t-тест на Student, където е подходящо.
Резултати
Инхибиране на хипоталамусния Cbp при мишки Cbp flox/flox от AAV-Cre
Инхибирането на хипоталамусния Cbp увеличава телесното тегло и приема на храна и влошава хомеостазата на глюкозата
(A) Телесна температура ± SEM на контролни и нокдаун мишки, хранени по желание (AL) чау диета или ограничена диета, за да съответства на телесното тегло (Съответстващо BW) (n = 5–10). (B) Тегло на тялото ± SEM на контролни и нокдаун мишки, хранени с фиксирана диета под прием на храна ad libitum в продължение на 6 седмици след инфузия на вируса. Плътни линии = GFP-Cbp/flox (контроли); бели ленти = Cre-Cbp/flox (експериментално). Относително изобилие на хипоталамусни транскрипти ± SEM, измерено чрез nCounter, стойностите се нормализират спрямо контрола ad libitum. Бели ленти = GFP-Cbp/флокс (контроли); Плътни пръти = Cre-Cbp/флокс (експериментално). Миши гени (C) Pomc, (D) Bdnf, (E) Lepr, (F) Irs4 и (G) Gck (n = 8). *, p Фиг. 3C), както и Bdnf (Фиг. 3D) и други експресии на гени продължават да съществуват, дори когато телесното тегло се съчетава с калорични ограничения под консумацията на двойки. Доказано е, че намалената експресия на двата гена причинява затлъстяване и нарушена хомеостаза на глюкозата и поне частично медиира затлъстелите фенотипове при мишки с дефицит на лептин [20,22]. Намаляването на хипоталамуса Pomc и Bdnf е в съответствие с намаляването на експресията на лептинов рецептор (Lepr), инсулиновата сигнализация (Irs4) и глюкокиназата (Gck) (Фигура 3E-3G), като всички те медиират хипоталамусния отговор на хранителното състояние [23, 24]. Експресията на други гени, замесени в енергийния баланс, като Agrp, не се повлиява от намаляване на хипоталамусния Cbp, докато има умерен спад на Npy (данните не са показани).
Инхибирането на хипоталамусния Cbp води до транскрипционен профил, показващ намален метаболизъм на глюкозата и повишен липиден метаболизъм
Съобщаваме, че гладуването създава профил на експресия на хипоталамусен ген, показващ преминаване от гликолиза към липиден метаболизъм и алтернативни пътища за метаболизъм на глюкозата [7]. В съответствие с наблюдението, че индуцираните на гладно промени в хипоталамуса могат да предизвикат затлъстяващи фенотипове в присъствието на храна, инхибирането на Cbp на хипоталамуса води до подобен хипоталамусен пробив от гликолизата (и към алтернативни пътища на метаболизма на глюкозата) и към повишен липиден метаболизъм ( Фигури (съответно Фигури 4 4 и и 5, 5). Както е показано на Фигура 4, инхибирането на Cbp на хипоталамуса създава профил на генна експресия, която се очаква да намали гликолизата. Например, инхибирането на Cbp намалява експресията на глюкокиназа, критична за хипоталамусната чувствителност към сигнализиране за глюкоза чрез гликолиза [25]. Освен това маркерите за отрицателно регулирана пируватдехидрогеназа (напр. повишен Pdk4 и намален Pdp1) също предполагат намалено използване на глюкоза от гликолиза [26]. Освен това повишената експресия на G6pdx и H6pd показва промяна в метаболизма на глюкозата далеч от гликолизата към пентозния път [27] .Накрая, повишена експресия на Foxo1, Hif1a и Txnip, всички са в съответствие с намалената гликолиза [7].
Относително изобилие на миши транскрипти ± SEM, измерено чрез nCounter, стойностите се нормализират спрямо контрола ad libitum. Бели ленти = GFP-Cbp/флокс (контроли); Плътни пръти = Cre-Cbp/флокс (експериментално). Миши гени (A) Pdk4, (B) Pdp1, (C) G6pdx, (D) H6pd, (E) Foxo1, (F) Hif1a и (G) Txnip (n = 8). *, p Фиг. 5A – 5C) или пероксизоми (Crot, Acox3; Фиг. 5D и 5E). Семейството на ацил-коа тиоестеразите медиира окисляването на свободните мастни киселини [28]. По този начин, значително увеличение на Acadl, Acads и Acadvl подкрепят, че инхибирането на хипоталамусния Cbp увеличава окисляването на мастните киселини (Фиг. 5F – 5H). Други гени, потенциално медииращи увеличаването на метаболизма на свободните мастни киселини, включват Apod и Apoe, които улесняват освобождаването на свободни мастни киселини от триацилглицеридите [7,29] (Фигура 5I и 5J).
Подобрената експресия на хипоталамус Cpt1a увеличава приема на храна и телесното тегло, като същевременно намалява експресията на Pomc
Хипоталамусният транскрипционен профил, наблюдаван в Cre-Cbp/flox, предполага няколко механизма, чрез които инхибирането на Cbp може да произведе затлъстели фенотипове, включително чрез нарушена хормонална (например, лептинова сигнализация) или променена хранителна сигнализация (например преминаване от гликолиза към липиден метаболизъм). Няколко реплики показват, че инхибирането на β-окисляването на хипоталамуса намалява приема на храна [30–33]. За да се оцени дали засиленото хипоталамусно β-окисление ще имитира ефекти на инхибиране на Cbp, хипоталамусният карнитин палмитоилтрансфераза 1А (Cpt1a), ограничаващ скоростта за липидно окисление [34], се влива в AAV конструкция, насочена към вентромедиалния хипоталамус (VMH). Подобрената експресия на Cpt1a (фиг. 6А) увеличава телесното тегло при стандартна диета с чау и дори повече при диета с високо съдържание на мазнини (фиг. 6В). Затлъстяването не е свързано с хиперфагия при диетата с чау, но повишената хипоталамусна Cpt1a е довела до хиперфагия при диетата с високо съдържание на мазнини (Фигура 6С). Повишената хипоталамусна Cpt1a също повишава изходната глюкоза в кръвта преди повишаване на телесното тегло (Фигура 6D). И накрая, увеличаването на телесното тегло след 2 седмици при диета с високо съдържание на мазнини е свързано с повишено изходно ниво на инсулин, лептин и намалена хипоталамусна Pomc иРНК (Фигура 6E-6G).
(А) Хипоталамус Cpt1a при контрол и свръхекспресия на вирус (n = 5-7). (B) Ad libitum телесно тегло ± SEM, измерено на 4 седмици след инфузиите в чау и диета с високо съдържание на мазнини (n = 8-10). (C) Чау и прием на храна с високо съдържание на мазнини ± SEM, измерено след инфузии (n = 12–14) (D) Изходна глюкоза в кръвта ± SEM, измерено след инфузии и при различни диети (n = 12–14). (E, F) Инсулин и лептин ± SEM, измерени при диета с високо съдържание на мазнини (n = 12-14). (G) Хипоталамусни Pomc транскрипти ± SEM, измерени чрез RT-PCR (n = 10-13). *, p Фиг. 2В). Инхибирането на Cbp на хипоталамуса причинява стабилни затлъстели фенотипи, независимо от пола, въпреки че мъжете са значително по-тежки от жените (данните не са показани). Повишаването на теглото е свързано със силно повишаване на приема на храна най-малко 3 седмици след инфузията на AAV-Cre и се запазва през цялото проучване (поне 5 седмици след инфузията). Намаленият разход на енергия правдоподобно също допринася за затлъстяването, както се посочва от намалената телесна температура и затлъстяването продължава дори когато мишките са били хранени по двойки към контролите (Фигура 3В). По-нататъшни проучвания с непряка калориметрия биха могли да изяснят тези механизми, въпреки че подходящото нормализиране остава основно предизвикателство в такива проучвания [38,39].
- Роля на разпределението на телесните мазнини и метаболитните усложнения на затлъстяването
- Метаболитни промени в слюнчените жлези на плъхове при предизвикано от глутамат затлъстяване
- Метаболитна адаптация към диета с ниско съдържание на въглехидрати и протеини („Традиционна“) в Австралия
- Метаболитни ефекти на упражненията върху детското затлъстяване съвременна перспектива - ScienceDirect
- Метаболитен синдром, затлъстяване и вътрешно слънце