Тудор Томас, Латифа Мах, Савио Джи Барето
Отделение по хирургия, болница Модбъри, Южна Австралия, Австралия
Щракнете тук за адрес за кореспонденция и имейл
| Дата на подаване | 21 септември 2011 г. |
| Дата на приемане | 29 март 2012 г. |
| Дата на публикуване в мрежата | 18 септември 2012 г. |
Ключови думи: Въглехидрати, мазнини, протеини
| Как да цитирам тази статия: Томас Т, Mah L, Barreto SG. Систематичен преглед на диетата в патогенезата на острия панкреатит: Приказка за твърде много или твърде малко ?. Saudi J Gastroenterol 2012; 18: 310-5 |
| Как да цитирам този URL: Томас Т, Mah L, Barreto SG. Систематичен преглед на диетата в патогенезата на острия панкреатит: Приказка за твърде много или твърде малко ?. Saudi J Gastroenterol [сериен онлайн] 2012 [цитирано от 2020 г. на 11 декември]; 18: 310-5. Достъпно от: https://www.saudijgastro.com/text.asp?2012/18/5/310/101124 |
Пациентите с остър панкреатит (AP) често съобщават, че болката им се появява след обилно хранене или след период на глад, който често може да бъде свързан с алкохолен запой. Това предполага роля на диетата в развитието на AP, роля, която е изследвана в животински модели [1], [2], [3], както и при хора. [4], [5], [6] От друга страна, липсата на хранене, както и недохранването също са свързани с развитието на AP. [7], [8] Освен това консумацията на големи количества ориз [9] и дори питейна вода [10] се предполага, че причинява AP.
Целта на настоящото проучване беше да се установи дали в публикуваната литература има достатъчно доказателства, свързващи диетата или липсата й с патогенезата на AP.
Извършено е систематично търсене на научната литература с помощта на Embase, PubMed, MEDLINE и Cochrane Central Register of Controlled Trials за годините 1965 - 2011, за да се получи достъп до всички публикации, особено рандомизирани контролирани проучвания (RCT), систематични прегледи и мета-анализи, включващи диетични фактори и патогенезата на AP. Стратегията за търсене беше тази, описана от Дикерсин и др. [11] със съответните специфични термини за търсене, а именно „остър панкреатит“, „протеини“, „мазнини“, „въглехидрати“, „систематични“ и „рандомизирани контролирани проучвания“. Бяха разгледани всички налични публикации от последните 50 години. Критерии за включване: Изследвания, специално разглеждащи патогенетичната роля на диетата и хранителните съставки в причинно-следствената връзка на AP.
Критерии за изключване
Изследвания върху патогенезата на диетата при хроничен панкреатит
Изследвания, свързани с диетичните аспекти при управлението на атака на AP.
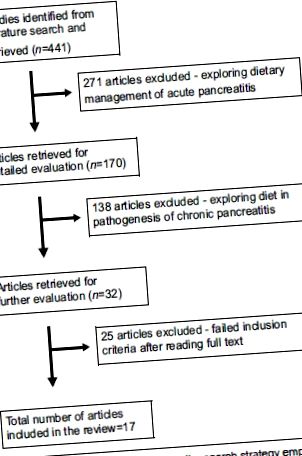
Използвайки горната стратегия за търсене, бяха извлечени общо 550 публикации, от които бяха идентифицирани 17 проучвания [Алгоритъм 1], описващи диетата в развитието на AP. Те включват 12 проучвания при хора (проучвания за контрол на случая и кохорта, серии от случаи и доклади) и 5 проучвания върху животни.
Ефекти на хранителните съставки (мазнини, протеини и въглехидрати)
Изследвания върху животни
Експериментални проучвания на миши модели потвърдиха, че диетите, богати на протеини, въглехидрати и мазнини, стимулират съответно съдържанието на трипсин, амилаза и липаза в панкреатичната тъкан. [12], [13], [14], [15] Уилсън и др. [16] установяват, че прилагането на диета с дефицит на протеин води до намаляване на съдържанието на ацинарна липаза при плъхове, докато хроничната консумация на етанол увеличава съдържанието на липаза, както и секреторния капацитет на ацините. По този начин те постулират, че ако ензимната секреторна способност определя риска от АР, тогава при хронични алкохолици диетата с високо съдържание на протеини може да потенцира атака на АР. Освен това при маймуни, хранени с диети с дефицит на протеин, се наблюдава лобуларна и ацинарна атрофия. [17]
Рамо и др. [3] демонстрира, че хистологично панкреатите на животни, хранени с етанол и въглехидрати, показват най-тежката форма на AP. Това обаче не корелира с наблюдаваната смъртност, отбелязана при животни, хранени с богати на мазнини и протеини диети. По този начин, има малко доказателства, които предполагат, че въглехидратите играят роля в инициирането или обострянето на експерименталния AP.
Човешки изследвания
Експериментални проучвания при хора за ролята на диетата върху освобождаването на панкреатични ензими показват, че в краткосрочен план ([20], както беше отбелязано по-рано в проучвания върху животни, или по-точно, модели на мишки. Въпреки това, Boivin и др. [21] демонстрират, че диетите, богати на протеини и мазнини, но с ниско съдържание на въглехидрати, стимулират между храносмилателния и постпрандиалния изход на трипсин и амилаза.
Трите големи проучвания върху хората за ролята на храненето в AP са публикувани преди 1985 г.
В първото ретроспективно проучване на Сарлес и др., [5] при сравняване на хранителния прием между 22 пациенти с AP и две контролни кохорти, те не откриха значителна разлика в приема на хранителни вещества (протеини/въглехидрати/и мазнини) между AP и контролните групи. Въпреки че пациентите с AP имат тенденция да консумират по-малко въглехидрати от контролите, не е установено, че разликата е статистически значима (P [4] след това проведе голямо международно проучване, включващо пациенти с аутопсия (н = 681), както и пациенти, на които е бил прилаган диетичен въпросник (н = 205) от всички континенти. Диетичният прием на случаите е сравнен с националните хранителни данни. Установена е положителна корелация между мазнините и протеините и AP при сравняване на националните хранителни данни с резултатите от аутопсията.
Уилсън и др. [6] сравнява диетичния прием на алкохолни пациенти с АП и цироза и установява, че въпреки че пациентите с АП консумират повече мазнини и протеини, отколкото тези с цироза, разликата не достига статистическа значимост.
Наскоро проспективно проучване на случая от Гоа, Индия [22], разглеждащо ролята на диетата в развитието на AP, отбелязва, че консумацията на сладководна риба (OR = 3,94, CI = 1,63-9,4, P [23] Основните механизми за такава асоциация включват окислително увреждане в система с лоши антиоксидантни резерви и възпалително увреждане, включващо интерлевкин-1, интерлевкин-6 и фактор на туморна некроза-α. Това може да доведе до активиране на звездни клетки на панкреаса и последващо възпаление и фиброза. [24] Експериментално е доказано, че продължителните периоди на недохранване причиняват увреждане на панкреаса. Доказано е, че маймуните Bonnet, хранени с диета с дефицит на протеини, показват лобуларна и ацинарна атрофия. [17] Това беше отбелязано и при аутопсични проучвания на деца с недохранване с IBO, при които се наблюдава ацинарна атрофия и фиброза. [25]
Прехранването след продължителен период на глад също е свързано с развитието на AP. Въз основа на проучванията на Грибоски и др. [30] и Кийн и др. [28] предполага се, че повторното хранене влошава разширяването на стомаха и дуоденалния илеус, което се свързва с нервна анорексия, което води до ретроградно налягане и рефлукс на дуоденалното съдържание в панкреатичния канал, предизвикващ атака на AP. Въпреки че това са единствените две проучвания, специално насочени към повторното хранене след анорексия, развитието на болка след повторно хранене дори при пациенти с AP поради други причини, които са гладували поради тяхното представяне, е било добре оценено през годините. [35] Съобщава се, че болката в тази обстановка се дължи на повторно стимулиране на панкреатичната секреция чрез перорално болусно хранене, което може да активира спящи ензими и възпалителния процес. [36]
В обобщение, горните проучвания показват, че хранителните съставки влияят на продукцията на панкреатичния ензим. При животните това може да се отбележи като остро явление. При хората обаче продължителното излагане на диета, богата на протеини и мазнини, променя нивата на ензимите в панкреаса. По отношение на диетичните фактори и тяхната връзка с риска от развитие на AP, проучвания при хора показват, че диетата може да играе роля. Няма обаче убедителни доказателства за пряката причинителна роля, въпреки че доказателствата подкрепят ролята на диетата като кофактор на други агенти (алкохол, камъни в жлъчката). Проучванията върху животни със сигурност предоставят възможни механизми за това как това може да се случи.
Ролята на диетата в развитието на AP често се разглежда. Проблемът с големите проучвания върху хора [4], [5], [6], изследващи такава асоциация, е, че те са публикувани преди 1985 г. Честотата на затлъстяване драстично се е увеличила в света оттогава. [37] Освен това затлъстяването е провъзпалително състояние с ниска степен. [38] Затлъстяването допринася за генерирането на медиатори, потенциално участващи в индукцията на системния възпалителен отговор. [39]
Хонг и др. [40] наскоро анализира връзката между високия индекс на телесна маса и риска от развитие на AP, както и риска от заболеваемост и установява, че затлъстяването е свързано не само с повишен риск от развитие на AP, но е и лош прогностичен фактор за AP.
Очарователно е също, че в другия край на спектъра недохранването също е свързано с развитието на AP. [7]
По отношение на проучвания върху хора, изследващи хранителните съставки, единственото проучване, изследващо подобна роля в AP, установява повишен относителен риск за AP сред хората, които ядат преварен ориз и сладководна риба. [22] Значението на тези констатации не е изяснено. Това изследване подкрепя статията на Чен [9], който предположи, че многократната консумация на големи количества ориз може да предразположи към развитието на АП за определен период от време. Чен [9] постулира развитието на промени, настъпващи в Сфинктера на Оди Повече подробности след многократна консумация на големи болуси от ориз и протеини, които се изпразват в дванадесетопръстника и свръхстимулират сфинктера, което води до оток. Тези констатации, въпреки че очевидно противоречат на констатациите на Сарлес и др. [5] посочвайки, че субектите с AP имат тенденция да консумират по-малки количества въглехидрати, може да осигури важна разлика в модела на консумация на ориз в двата континента.
В заключение, доказателства от литературата изглежда не подкрепят ролята на диетата като еднократно болусно хранене като причина за AP. Продължителната консумация на диети, богати на протеини и мазнини, може да действа синергично с камъни в жлъчката/алкохол, за да предизвика атака на AP, което показва възможна роля на диетата като кофактор в причината за AP, вероятно чрез намаляване на прага, необходим на тези други агенти, за да доведе до атака на AP.
Източник на подкрепа: Нито един, Конфликт на интереси: Нито един
- Систематичен преглед на средиземноморската диета за дългосрочно отслабване - ScienceDirect
- Каква диета е подходяща за остър идиопатичен панкреатит с псевдокиста
- Преглед на книгата за диетичните масла
- Вертикалната диета Диетолозите преглеждат идеалното хранене
- Диетата за обемни показатели за отслабване и здраве Преглед на диетата срещу болестта