Шон T Beug
1 лаборатория за молекулярна генетика Solange Gauthier Karsh; Център за изследване на апоптоза; Детска болница на Изследователския институт в Източен Онтарио; Отава, Канада
Ерик Си ЛаКас
1 лаборатория за молекулярна генетика Solange Gauthier Karsh; Център за изследване на апоптоза; Детска болница на Изследователския институт в Източен Онтарио; Отава, Канада
Робърт Дж Корнелук
1 лаборатория за молекулярна генетика Solange Gauthier Karsh; Център за изследване на апоптоза; Детска болница на Изследователския институт в Източен Онтарио; Отава, Канада
2 Катедра по биохимия, микробиология и имунология; Университет в Отава; Отава, Канада
Резюме
Двойният имунотерапевтичен подход, използващ маломолекулни инхибитори на апоптоза (IAP) протеинови антагонисти в комбинация с вродени имунни стимули, се оказа силно синергичен и ефективен при животински туморни модели. Тази стратегия преодолява много от ограниченията на терапията с един агент и нашите резултати показват, че комбинацията може лесно и ефективно да бъде преведена в клиниката.
Химичните миметици на проапоптотичния протеин, DIABLO, по-известен като втори активатор на каспази, получен от митохондрии (Smac), са малки молекулни антагонисти, които потискат ключови инхибитори на апоптоза (IAPs) протеини - клетъчен IAP1 (cIAP1) и клетъчен IAP2 (cIAP2 ) - чрез свързване и насочване към тях за влошаване. В зависимост от афинитета на съединението, специфичността и дозировката, миметиците на Smac също антагонизират или водят до разграждане на X-свързания IAP (XIAP), друг апоптотичен супресорен протеин. Понастоящем няколко от тези миметици на Smac са в клинични изпитвания в ранна фаза като противоракови средства. Индуцираната от Smac миметична загуба на cIAP1/cIAP2, два критични регулатора на суперсемейството на рецептора на туморния некротичен фактор (TNF) и сигнализиране на ядрен фактор-kB (NF-kB), сенсибилизира раковите клетки към TNF-или TNF-свързан с TNF лиганд, предизвикващ апоптоза (т.е. TRAIL) медиирана смърт. 1 Важно е, че миметиците на Smac изискват присъствието на тези про-смърт цитокинови лиганди за максимална ефикасност. Към днешна дата обаче тепърва предстои да бъдат разработени методи за безопасно и ефективно предоставяне на екзогенен източник на тези цитокини на пациенти с рак, подложени на лечение със Smac миметици, действие, което концептуално би могло да повиши антитуморната ефикасност.
Наскоро открихме, че заразяването на тумор-носещи мишки с онколитичен вирус или алтернативно лечение със синтетичен имунен миметик може да доведе до цитокинова буря (включително TNFα и TRAIL) с достатъчна интензивност, за да убие туморни клетки, съвместно третирани с различни моновалентни или двувалентни миметици на Smac (съдържащи съответно един или два IAP свързващи мотива). 2 Демонстрирахме синергично убиване на туморни клетки при множество резистентни към лечение модели на рак in vivo, като рак на гърдата и дебелото черво, което води до повишена преживяемост и в някои случаи при трайни лечения. В допълнение, лечението на много други видове злокачествени заболявания (напр. Бъбрек, глиобластом и множествен миелом) демонстрира синергични комбинаторни дейности in vitro. Това публикувано проучване демонстрира и следните ключови моменти:
1. Миметичната синергия на Smac с онколитичен вирус е силно потенцирана по-специално в класа на везикуловирусите, типизирана в нашето изследване от два примера за онколитични рабдовируси, вирус на везикуларен стоматит (VSV) и Maraba при проучвания in vitro. Атенюираните онколитични рабдовируси са отрицателни РНК вируси, които се репликират бързо и предизвикват силен интерферонов (IFN) отговор. Този имунен отговор ограничава разпространението на вируса, като по този начин потиска ефикасността на онколитичния вирус за убиване на рак, но предпазва гостоприемника от виремия. 3 Вирусната инфекция, лизисът и освобождаването на туморни антигени и свързаните с увреждания молекулярни модели (DAMP) обаче в крайна сметка предизвикват имунния отговор за подпомагане на ликвидирането на туморите. 4
2. Комбинираният ефект не изисква изключително локалното производство на цитокини на мястото на тумора, така че наблюдаваме системното производство на цитокини да бъде много ефективно. В допълнение, комбинацията се понася добре от животните с приемливи и преходни загуби на телесно тегло.
3. Цитотоксичните ефекти на рака са медиирани от различни цитокини, особено IFN от тип I или тип II, както и TNFα или TRAIL. Това беше първата демонстрация на миметична синергия на Smac с IFN. Нашите открития повдигат възможността за комбиниране на съществуващи имунотерапии, включващи рекомбинантен IFN, със Smac миметици при лечението на рак.
4. Противораковият ефект от комбинаторното лечение е основно медииран от вродения имунен отговор. Въпреки това, не бихме могли да изключим напълно участието на адаптивния отговор, тъй като е известно, че това рамо на имунната система допринася за дългосрочна ремисия или излекуване. В отделен доклад Dougan и колегите му показват, че миметиците на Smac подобряват Т-клетъчния противотуморен имунитет в модел на мишка срещу ваксина, 5 което предполага, че миметиците на Smac могат да упражняват множество полезни антитуморни имунни ефекти чрез различни механизми. Всъщност IAPs регулират много аспекти на имунитета (за преглед вж. Справка 6), а антагонизмът на IAP с миметици на Smac при пациенти с рак се очаква да има множество имуно-медиирани противоракови ефекти.
5. Онколитичният вирус, предизвикващ вродения имунен отговор, може да бъде заменен с неинфекциозни имуностимулиращи молекули, като адюванти поли (I: C) или CpG олигонуклеотиди. Тези синтезатори на синтетични патогени ефективно синергизират с миметиците на Smac, за да предизвикат значително регресия на тумора, което води до трайни лечения.
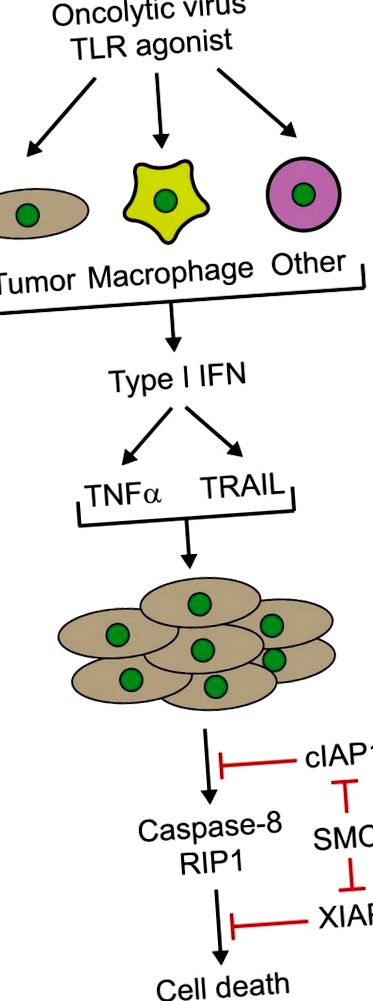
6. Не се изисква пряко заразяване на всички ракови клетки с онколитичен вирус, тъй като неинфектираните туморни клетки могат да бъдат унищожени чрез страничен механизъм, поне частично поради индуцирането на дифузируеми и циркулиращи цитокини (фиг. 1). Тази цитокинова буря създава облак от смърт на туморни клетки, който може да бъде ясно визуализиран в анализ за разпространение на вируса, като се използва агарозен слой (вижте допълнителни данни в справка 2).
Фигура 1. Цитокин-медиирана синергия на миметици на Smac и онколитичен вирус или синтетичен агонист на Toll-like receptor (TLR). Инфекцията с онколитични вируси или лечение с имуностимулиращи TLR агонисти в различни клетъчни типове (тумор, макрофаги или други клетки от гостоприемника) води до производството на интерферони, като IFNβ, което от своя страна води до производството на цитокини като туморна некроза фактор (TNFα) и свързан с TNF апоптоза индуциращ лиганд (TRAIL). За отбелязване е, че производството на тези цитокини се засилва в присъствието на Smac миметици. Лечението на туморни клетки със Smac миметици води до разграждане и/или инхибиране на клетъчните инхибитори на апоптоза (cIAP1/2) и X-свързани IAP (XIAP) протеини. Впоследствие цитокините индуцират каспаза-8- и RIP1-зависима смърт от странични наблюдатели на туморни клетки, третирани с миметик на Smac. RIP1, рецептор взаимодействаща протеин киназа 1; Smac, втори активатор на каспази, получен от митохондрии; SMC, Smac миметично съединение.
7. Миметичното лечение със Smac не променя или компрометира антивирусния отговор на гостоприемника към онколитична VSV инфекция, за разлика от предходния доклад, при който загубата на cIAP1/2 е показала, че води до увеличаване на титъра на VSV. 7 Всъщност две допълнителни проучвания също демонстрират, че миметичните лечения на Smac не възпрепятстват антивирусните отговори при мишки. 8, 9
Разкриване на потенциален конфликт на интереси
R.G.K. е научен основател и акционер на Aegera Therapeutics (Pharmascience Inc.), която има Smac миметик в клинично развитие.
Терминологичен речник
Съкращения:
| cIAP | клетъчен инхибитор на апоптозата |
| CTLA-4 | цитотоксичен Т-лимфоцитен антиген-4 |
| ВЛАГА | свързани с увреждане молекулярен модел |
| IFN | интерферон |
| NF-kB | ядрен фактор-kB |
| PD-1 | програмирана клетъчна смърт 1 |
| PD-L1 | програмиран лиганд за клетъчна смърт-1 |
| поли (I: C) | полиинозинова-полицитидилова киселина |
| Smac | втори активатор на каспази, получен от митохондрии |
| TLR | таксови рецептор |
| TNFα | фактор на туморна некроза α |
| ПЪТЯ | TNF-свързан апоптоза-индуциращ лиганд |
| VSV | Вирус на везикуларен стоматит |
| XIAP | Х-свързан инхибитор на апоптозата |
Бележки
Цитиране: Beug ST, LaCasse EC, Korneluk RG. Мимиците на Smac, комбинирани с вродени имунни стимули, създават перфектната цитокинова буря за убиване на туморни клетки. OncoImmunology 2014; 3: e28541; 10.4161/onci.28541
- Отговаряне на отслабването на кафе на зърна при печене - перфектно ежедневно смилане
- Моите Топ 3 остатъка от рецепти за закваска от закваска Перфектният хляб
- Сестри Аптека Фентермин Витал Макс Кето Отслабване Билков чай - Аюрведично изцеление - Буря
- Продукти за изгаряне на мазнини по корема и повишаване на физическото представяне BodyStart Keto - Storm Ventures Group
- Супермоделът разкрива перфектни кореми скоро след раждането - Emirates247