От катедрата по патология, Чикагски университет, Чикаго, Илинойс.
От катедрата по патология, Чикагски университет, Чикаго, Илинойс.
От катедрата по патология, Чикагски университет, Чикаго, Илинойс.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
За да развием тази хипотеза, разглеждаме накратко ограничените доказателства за регионални различия в човешката атеросклероза. Ние също така се докосваме до въздействието на параметрите на потока върху различните отговори на ендотела, за да послужим като фон за разглеждане на потенциални вариации, които могат да обяснят регионалните различия в атеросклеротичния отговор. Тъй като останалата част от прегледа се фокусира върху миша атеросклероза, ние накратко разглеждаме основните модели на атеросклероза при този вид и подходите, най-често използвани за оценка на степента и размера на артериалните лезии. И накрая, ние събираме наличните данни за селективността на мястото на атеросклероза в тези модели на мишки с кратка оценка на възможните общи механизми, които могат да бъдат в основата на тази селективност.
Регионални разлики в човешката атеросклероза
Хемодинамика и локализация на атеросклерозата
Съществуват огромни корелативни данни, които показват, че ниското срязване или нарушен поток отчита локализацията на атеросклерозата. Може би най-поразителното е патологичното наблюдение, че в рамките на дадено напречно сечение на податливо място първоначалната лезия е почти винаги ексцентрично разпределена по предсказуем начин. Например, в точките на разклонение в безименната артерия или илиачната бифуркация, първоначалната лезия се намира на страничната стена. Причината за тази специфична локализация може да се обясни с локалната хемодинамика, както е изследвана по-долу.
Caro et al 15 през 1969 г. посочват важната връзка между ниското напрежение на срязване и атеросклерозата във васкулатурата. Тази концепция е разработена допълнително от Глагов и колеги. Чрез възпроизвеждане на условията на потока в мащабни модели на човешка каротидна бифуркация те показват, че локализацията на атеросклероза, открита при аутопсия, корелира с областите на нарушаване на потока, което води до увеличено време на престой на частиците. 16,17 Подобно моделиране беше проведено на коремната аорта, при което както осцилиращ поток, така и ниско напрежение на срязване бяха наблюдавани по задната стена на инфрареналната аорта, където се развиват атеросклеротични лезии. 18.
Прелезионните области, които са податливи на развитието на атеросклероза, могат да бъдат разграничени от други по-малко податливи области. При млади индивиди по-вероятно е да се установи неатеросклеротично удебеляване на интимата в области на аортата, които са склонни да развият атеросклероза. 13,19 Фетални мастни ивици се откриват в присъствието на майчина хиперхолестеролемия и тези лезии отново се локализират в области, податливи на развитие на атеросклеротични плаки. 20 Освен това, проучвания върху мишки показват, че майчината хиперхолестеролемия по време на бременност, както и хемодинамиката, изглежда, че е основен генната експресия на съдовата стена при малките, която продължава дори след обратната хиперхолестеролемия. 21.
Тези гореспоменати хемодинамични явления се възприемат от ендотелната клетка и потенциалните сензорни механизми вече са разгледани подробно от Дейвис и колеги. Известно е, че 30–32 ендотелни клетки се подравняват с оста на ламинарен поток. Това подравняване се премахва в зони с нарушен поток, дори в малък пространствен мащаб, който представлява само няколко клетки. Реакцията, свързана с потока, се предава на вътреклетъчните цитоскелетни нишки, които се свързват с органелите и ядрените мембрани. Това разпределение на луминалния сигнал потенциално води до интегриран клетъчен отговор, който включва няколко молекули на клетъчната повърхност и вътреклетъчни сигнали, без да се засяга един първичен биомеханичен сензор.
Осцилаторното напрежение на срязване значително повишава VCAM-1, ICAM-1 и Е-селектина в култивирани човешки ендотелни клетки. 39 Интересното е, че експресията на тези молекули също се регулира при статични условия, когато ендотелните клетки се култивират с гладкомускулни клетки, но този индуциращ ефект на гладкомускулните клетки се инхибира от прилагания срязващ стрес. 40 Тези промени в генната експресия се медиират от активиране на ядрен фактор-кВ (NF-кВ), което се случва особено при условия на ниско срязване. 41 NF-κB активирането е свързано с намаляване на Iκ-Bα в зависимост от потока, 42 което от своя страна е свързано с активиране на IκB киназа. 43 Значението in vivo на тези находки в култивирани ендотелни клетки се отразява от високото ниво на експресия на NF-кВ в по-малката кривина на мишата аорта, която има нарушен модел на потока и е податлива на атеросклероза. Това контрастира с по-ограничената експресия на NF-кВ в по-голямата кривина, която има по-ламинарен поток и е относително устойчива на атеросклероза. 44 VCAM-1 също е регулиран нагоре в отговор на хиперхолестеролемия в тази и други области, податливи на атеросклероза. 45
Свръхекспресията на NO синтетаза на ендотелните клетки (eNOS) инхибира NF-κB активирането, индуцирано от ниско срязване. 42 eNOS се индуцира по дозозависим начин чрез ламинарно напрежение на срязване, 46,47, докато осцилаторното напрежение на срязване може да регулира eNOS. 48 Това активиране на eNOS е до голяма степен медиирано от специфично протеин киназа В-зависимо фосфорилиране. 49 Един от най-ранните отговори на хиперхолестеролемия е затихването на ендотел-зависимата артериална релаксация и производството на NO. 50 Наблюдавано е намаляване на eNOS в чувствителните на атеросклероза области на аортата при мишки с дефицит на LDL рецептор, 51 което предполага, че производството на NO може да бъде защитно срещу развитието на атеросклероза. eNOS се намира предимно в кавеолите и тази локализация се намалява от окисления липопротеин и се увеличава от HDL, 50 последният по начин, зависим от рецептора за почистване BI (SR-BI). Важно е, че съдържанието на холестерол в кавеолите може да повлияе на сигнализирането на ендотелните клетки. 52 Съдържанието на холестерол може да бъде регулирано отчасти чрез ендогенен синтез, медииран от пътя на SREBP, който отново се активира от напрежението на срязване. 36,37
Има все повече доказателства, че реактивните кислородни видове могат да бъдат силни проатерогенни медиатори. Най-важният фактор, допринасящ за повишените активни кислородни видове, е NADPH оксидазата, която се регулира диференцирано от ламинарно и осцилаторно напрежение на срязване, като последната е отговорна за активирането на тази оксидаза. 53 Повишената активност на NADPH оксидаза може да бъде посттранскрипционна, в зависимост от фосфорилирането на нейните субединици. 54,55 Има много агонисти за тази оксидаза, включително ангиотензин II. Други членове на системата с реактивни кислородни видове, които се влияят от параметрите на потока, включват хем оксигеназа и Cu/Zn супероксид дисмутаза. 53 Ясно е, че балансът между прооксидантните и антиоксидантните елементи може да определи вероятността от развитие на атеросклероза на определено съдово място и че този баланс се влияе от големината на срязващия стрес и трептенията. 54–56 Това понятие служи като прототип за балансиране на проатерогенни и антиатерогенни влияния. Други баланси между адхезионните молекули, хемоаттрактантните молекули, цитокините, растежните фактори и факторите за оцеляване потенциално играят роля или за насърчаване, или за инхибиране на процеса на атеросклероза на дадено съдово място.
Миша атеросклероза
Модели на мишката
Въпреки че констатациите, получени с култивирани ендотелни клетки, дават ценна информация за видовете in vitro регулация, свързана с потока, която тези гени и протеини показват, тези експерименти не могат точно да повторят ситуацията in vivo, особено ако възможността за регионални вариации и средната консистенция на се вземат предвид хемодинамиката за продължителен период от време. Следователно са необходими ефективни in vivo модели.
Поради очевидните трудности при изучаването на патогенни механизми при отделни хора, задължително е добре характеризиран експериментален модел на атеросклероза. През последното десетилетие мишката се превърна в най-добрия модел поради бързото си размножаване, обширните познания за нейната генетика, способността да манипулира своята генна експресия, относително бързото образуване на лезии при генетично модифицирани мишки и относителната лекота на лезията анализ. За съжаление способността да се изследва хемодинамиката на мишката е трудна поради ограниченията в размера. Независимо от тази резерва, през последните години се появи подобрено разбиране за ранната атерогенеза, базирано главно на модела на мишката (прегледано в Lusis 57 и Glass и Witztum 58).
Фигура 1. Надлъжно представяне на главната артериална васкулатура, илюстриращо наблюдаваното разпределение на атеросклероза (сиво засенчване) във васкулатурите на мишки с дефицит на LDL рецептор, хранени с атерогенна диета с високо съдържание на мазнини. 1 Показва аортен синус; 2, възходяща аорта; 3, по-малка кривина на аортната дъга; 4, по-голяма кривина на аортната дъга; 5, безименна артерия; 6, дясна обща каротидна артерия; 7, лява обща каротидна артерия; 8, лява субклавиална артерия; 9, гръдна аорта; 10, бъбречна артерия; 11, коремна аорта; и 12, илиачна артерия.
За да се оцени потенциалът за селективна модулация на атеросклероза при различни съдови места в риск, е необходимо да се проучат поне 2 такива места, което едва сега започва да се оценява. Начинът, по който лезията реагира на най-често изследваните места, не отразява непременно патогенезата на други места. 65 Всъщност, като се фокусира само върху аортата или аортния синус, ефективното моделиране на нестабилна напреднала плака остава неуловимо, докато изследователите не започнат да търсят другаде, а именно безномичната артерия. 66–68
По отношение на локалната хемодинамична среда, която влияе на мишата атеросклероза, периферната асиметрия на атеросклеротичните лезии както в аортния синус на мишката, така и в безноменната артерия са показани на фигура 2. Както е типично тук, лезията, открита в безножната артерия, винаги е локализирана към страничната стена и по-голямо количество лезия се развива върху аортния синус, близо до по-малката кривина на аортата, отколкото по-голямата страна на кривината (виж Фигура 1). За пореден път тези места са точно там, където преобладават турбулентни, пулсиращи и неламинарни сили на потока, насърчаващи развитието на атеросклероза. 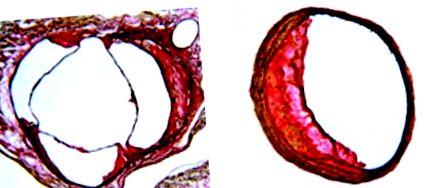
Фигура 2. Напречно сечение на аортния синус (A) и безноменната артерия (B) от апоЕ-дефицитна мишка, хранена с чау диета за 40 седмици, илюстрираща периферната асиметрия на атеросклеротичната лезия. Секции с дебелина десет микрометра; Петно на хематоксилин-ван Гийсън на Weigert; оригинално увеличение × 4 (A) и × 10 (B).
Измерване на атеросклероза
И накрая, когато се изследват регионални вариации на атеросклерозата, е важно да се има предвид скоростта на развитие на лезиите на всяко място. Времето за вземане на проби за измерване на атеросклероза може лесно да повлияе на докладвания резултат. Например, при свръхекспресия на 15-липоксигеназа, 83 зоната на поражение на аортния синус се увеличава значително, когато се изследва при мишки след 3 или 6 седмици хранене с високомаслена атерогенна диета, но не и след 9 седмици. На по-изискано ниво съставът на клетъчните лезии също може да се промени с течение на времето. Например, съдържанието на гладки мускулни клетки е значително намалено в лезиите на аортната дъга на мишки с двойно дефицит на интерферон (IFN) -γ/LDL, когато се вземат проби след 8 седмици на диета, но не и след 20 седмици на диета. 84 Следователно е важно да се разбере, че сложността на атеросклеротичната лезия може да не бъде непременно отразена в дадена оценка и трябва да се направят механистични заключения, като се имат предвид тези ограничения.
Специфичност на мястото на миша атеросклероза
Малко са проучванията, които позволяват да се обърне специално към въпроса за селективното развитие на атеросклерозата. Няколко от експериментите с модели на мишки, при които реакцията варира в зависимост от съдовата област, са обобщени в таблицата. Може да се очаква, че бъдещата работа ще разкрие много такива случаи и тези различия могат да осветят богатството на атерогенните механизми.
Специфични за мястото ефекти при атеросклерозата
Като се има предвид, че атеросклерозата се развива на места с ниско срязване и нарушен поток, ние предполагаме, че моделите на потока в различните региони се различават в количествени детайли и че тези вариации имат сложен ефект върху развитието на атеросклероза. Тези вариации могат да повлияят на относителното време на престой на липопротеините, кръвоносните молекули и възпалителните клетки, които влизат в контакт с ендотелните клетки във всеки от тези региони. Също така, хемодинамичните модели могат да променят генния експресионен профил на ендотелните клетки по фино различни начини, така че тези клетки да реагират на глобални рискови фактори като хиперлипидемия, пол и имунна система в регионално различна мода. Изследванията на тъканната култура, въпреки че ясно показват реакцията на ендотелните гени на потока, не моделират точно фините детайли на ситуацията in vivo, която се проявява при селективната атеросклероза. Само in vivo вземане на проби от определени съдови области за подробни сравнителни проучвания е вероятно да даде критична информация по тези въпроси.
До този момент по-голямата част от работата in vitro върху влиянието на моделите на потока върху генната експресия на ендотелните клетки използва клетки, получени или от човешката пъпна вена (място, което не е податливо на атеросклероза), или от човешки, говежди или заешки аорти. В никакъв случай ендотелните клетки за изследване на генната експресия не са получени от различни области на съдовото дърво, които са склонни към развитие на атеросклероза, макар и с различна скорост или при различни обстоятелства. Такова проучване може потенциално да покаже дали ендотелните клетки проявяват регионално специфичен фенотип, който би отчел селективността на атеросклеротичния сайт.
Това каза, че дори култивирани проучвания на ендотелни клетки са посочили баланса между гените, които насърчават или възпрепятстват атерогенезата, които са кандидати за изследване на регионалните различия in vivo. Това, което беше показано, е, че някои от реагиращите на потока гени варират, тъй като величината на параметъра на потока се променя (VCAM-1, 101 например), което прави такива гени потенциални кандидати за регионални вариации при атеросклероза. Следват някои от другите фактори, които биха могли да повлияят или да повлияят на регионално обособеното развитие на лезиите.
Възраст на Лезия
Профил на окисление
Генетичен фон
Горните специфични за мястото ефекти са проучени или при мишки с дефицит на апоЕ, или с дефицит на LDL рецептор, най-често обратни кръстоски в фона на C57BL/6. Сред разнообразието от инбредни щамове на мишки има големи различия в честотата и степента на атеросклероза в аортния синус дори в контекста на дефицит на апоЕ или LDL рецептор. Изследванията на разликите в щамовете в чувствителността към атеросклероза (например FVB 108–113) са фокусирани до голяма степен върху лезията на аортния синус. Това може да отклони избора на потенциално влиятелни гени за атеросклероза, които работят предимно на това място, докато други сайтове могат да бъдат засегнати от различен набор от модулаторни гени. Разполагаме с предварителни данни, че вариацията в безименната атеросклероза на артериите наистина може да се регулира от ген или гени, които не са толкова важни при образуването на аортна синусова лезия. 89 Във всеки случай специфичният генетичен произход на използвания миши модел е важно предупреждение, което трябва да се вземе предвид при анализа на гените, които влияят върху степента на атеросклеротичната лезия.
Ефекти, специфични за пола
Заключения
Фигура 3. Модел за концептуализиране на взаимодействието между множество фактори, които водят до специфична за мястото модулация на атеросклерозата. Локалните модели на хемодинамичен поток в 2 чувствителни на атеросклероза места, илюстрирани от аортния синус и неиноминирани, водят до диференциални профили на генна експресия на съдовите клетки на всяко от тези места. Специфичните отговори на тези грундови съдови клетки към рисковите фактори и модулатори на атеросклероза ще повлияят на атерогенните пътища, което от своя страна може да доведе до разлики в размера, състава или скоростта на прогресия за всяка атеросклеротична лезия. Въз основа на нашите проучвания за миша атеросклероза при мъжки мишки, ние предполагаме, че грундираните клетки на аортния синус са по-податливи на имунна недостатъчност, отколкото клетките в неноминираната артерия, докато генетичният фон влияе на атеросклерозата и на двете места.
Тази работа беше представена отчасти като отличена мемориална лекция на Джордж Лайман Дъф на годишната среща на Американската сърдечна асоциация, ноември 2003 г., в Орландо, Флорида.
Благодарности
Изследванията на авторите, цитирани в този преглед, са подкрепени от Националните здравни институти безвъзмездна помощ HL-56827 и DK-26678.
- Методи на биологията за опрашване за специалности II
- Ривароксабан (Xarelto) за лечение на дълбока венозна тромбоза и белодробна емболия и за
- Хранителни вещества и балансирана диета (Научете) Биология Клас 6 Amrita Vidyalayam eLearning Network
- Роли на периваскуларната мастна тъкан при хипертония и атеросклероза Антиоксиданти и редокс
- Псевдотуберкулоза Мястото за птици
