Галина И. Лепешева
1 Катедра по биохимия, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, 37232-0146, САЩ
Робърт Д. От
2 Катедра по микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, 37232-0146, САЩ
Татяна Й. Харгроув
1 Катедра по биохимия, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, 37232-0146, САЩ
Юлия Й. Клещенко
3 Катедра по микробна патогенеза и имунен отговор, Мехари Медицински колеж, Нешвил, TN 37208, САЩ
Инге Шустер
4 Институт по фармацевтична химия, Университет Виена, Oesterreich, Австрия
В. Дейвид Нес
5 Катедра по химия и биохимия, Тексаски технически университет, Лъбок, Тексас 79409-1061, САЩ
Джордж С. Хил
2 Катедра по микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, 37232-0146, САЩ
Фернандо Вилалта
3 Катедра по микробна патогенеза и имунен отговор, Мехари Медицински колеж, Нешвил, TN 37208, САЩ
Майкъл Р. Уотърман
1 Катедра по биохимия, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, 37232-0146, САЩ
Свързани данни
Обобщение
Стерол 14α-деметилазите (CYP51) служат като първични мишени за противогъбични лекарства и специфичното инхибиране на CYP51s при протозойни паразити Trypanosoma brucei (TB) и Trypanosoma cruzi (TC) може да осигури ефективна стратегия за лечение на човешките трипанозомиази. Изборът на първичен инхибитор се основава първоначално на спектралния отговор на цитохром Р450 към свързването на лиганда. Лигандите, които демонстрират най-силни параметри на свързване, бяха изследвани като инхибитори на възстановената активност на TB и TC CYP51 in vitro. Пряката корелация между ефикасността на съединенията като инхибитори на CYP51 и техния антипаразитен ефект в туберкулозни и ТС клетки предполага съществени изисквания за ендогенното производство на стерол в двете трипанозоми и предполага нова оловна структура с определен регион, най-обещаващ за по-нататъшни модификации. Разработеният тук подход може да се използва за по-нататъшно широкомащабно търсене на нови инхибитори на CYP51.
Въведение
Секвенирането на TB и TC геноми [7] разкри присъствие на всички стерилни биосинтетични ензими в паразитите, включително стерол 14α-деметилаза (CYP51), цитохром P450, който функционира в началните етапи на специфичната постскваленова част от пътя, катализирайки три- стъпкова реакция на окислително отстраняване на 14α-метиловата група от новоциклизираните стеролни предшественици [30]. CYP51 е основна цел за производни на азол при противогъбична терапия. Инхибирането на реакцията CYP51 при гъбички води до натрупване на 14α-метилирани стероли, които не могат да заместят ергостерола в мембраната поради стерично препятствие [11].
CYP51 от TB и TC имат само ∼25% аминокиселинна идентичност с техните гъбични ортолози и са 83% идентични помежду си. Показахме, че докато TCCYP51 изразява предпочитание към C4-диметилирания 24-метилендихидроланостерол, естественият субстрат на CYP51 от нишковидни гъби, TBCYP51 е строго специфичен към C4-монометилираните растителни субстрати (обтузифолиол и норланостерол) и този на базата на аминокиселина последователност всички останали секвенирани протозои CYP51 ще приличат на TBCYP51 в активност [31-33].
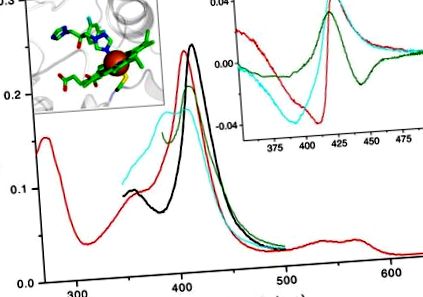
Основен панел: Абсолютни спектри на 2 μM TBCYP51: окислен без лиганд (червен), редуциран без лиганд (зелен), оксидиран 47% свързан обтусифолиол с висока скорост (циан), азол 4 -подвързан (черен). Синьото изместване в максимума на Соретовата лента (от 417 до 394 nm) се причинява от изтласкване на водна молекула от шестата координационна сфера на хем желязото (например от субстрат, който сам по себе си не образува координационна връзка с желязото). Тази спектрална реакция (тип 1) отразява прехода на желязото от хекса-координирано състояние на ниско спиново състояние към състояние на високо спин, координирано с пента. Директната координация на основен атом (напр. Алифатен или ароматен азот) с хем желязото причинява червено изместване в лентата на Сорет (до 426-429 nm), познато също като реакция тип 2 в различните спектри. Дясна вложка: различителни спектри тип 2, наблюдавани при свързване на азол към окислен, редуциран и свързан със субстрата TBCYP51 (цветен код, както по-горе). Вляво вляво: координация на флуконазол с хем желязото в кристалната структура на CYP51 от Mycobacterium tuberculosis [1ea1]. Желязото е показано като кафява сфера, координираният с хем остатък Cys (пети аксиален лиганд) е разположен под желязото, серният атом е оцветен в жълто, протеиновият остатък е показан в сиво.
А. Съединения, избрани въз основа на афинитета на свързване, оценен от спектралните отговори на P450. Б. Азоли, добавени след анализ на структурата/активността. Съединенията, използвани при клетъчни изследвания, са маркирани със сив фон. * Явни константи на дисоциация, μM. Инхибиращите ефекти на азоли с Kds по-високи от Kds за ензимно/субстратните комплекси (1,2 и 0,8 μM за взаимодействието на TBCYP51 с обтузифолиол и TCCYP51 с 24-метилендихидроланостерол, съответно [31, 32]) бяха много по-слаби; съединение 5 е включен като пример. ** инхибитор на моларно съотношение/P450, което води до двукратно намаляване на активността. *** I/E2, изчислено като влияние върху първоначалната скорост (5 ') на катализа (I/E2, изчислено като влияние върху процента на конверсия на субстрата след 1 час (60') реакция). Резултатите от четири експеримента са представени като средни; стандартното отклонение не надвишава 10%.
Идентифициране на най-мощните инхибитори на CYP51
Оценка на инхибиторната сила в възстановената ензимна реакция in vitro
В съответствие с техния висок афинитет на свързване съединенията произвеждат силен инхибиторен ефект върху началните скорости на катализа. Моларните съотношения инхибитор/ензим, необходими за забавяне на реакцията двукратно (I/E2), са по-ниски от едно във всички случаи, с изключение на съединението 5 (както за трипанозомни CYP51), кетоконазол и флуконазол за туберкулозен ортолог (Фигура 2).
Очевидно най-добрите инхибитори се различават с течение на времето при сравняване на ефектите на азолите при еквимоларно съотношение към ензимите (Фигура 3). При това условие не може да се установи преобразуване на субстрата дори след 1 час реакция при съединения 2 или 4 се добавят. Инкубационните интервали до 4 часа бяха тествани със същия резултат, докато повече от 90% от ензима в реакцията остава в активната форма P450. По този начин, в рамките на времето тестван ефектът на съединенията 2 и 4 и при двата трипанозомни CYP51s остава необратим.
- Лечение на болка Светлинна терапия Великобритания
- Нехирургично управление на частична адхезивна обструкция на тънките черва с орална терапия на случаен принцип
- Роля на нутрицевтиците в хиполипидемичната терапия
- Сестрински персонал, за да получи повече обучение по хранене, за да се насочи към времето за затлъстяване
- Нутрикология Протеолитичен ензим Панкреас