TRAVATAN Z ®
(травопрост) офталмологичен разтвор 0,004% за локално офталмологично приложение
ОПИСАНИЕ
Травопрост е синтетичен аналог на простагландин F. Химичното му наименование е [1R- [1α (Z), 2β (1E, 3R *), 3α, 5α]] - 7- [3,5Дихидрокси- 2- [3-хидрокси-4- [3- (трифлуорометил) фенокси ] -1-бутенил] циклопентил] -5-хептенова киселина, 1 метилетилестер. Той има молекулна формула на C26H35F3O6 и молекулно тегло 500,55. Химичната структура на травопрост е:
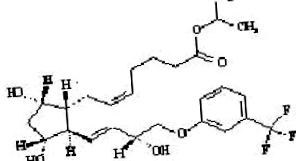 |
Травопрост е бистро, безцветно до леко жълто масло, което е много разтворимо в ацетонитрил, метанол, октанол и хлороформ. Той е практически неразтворим във вода.
TRAVATAN Z ® (офталмологичен разтвор на травопрост) 0,004% се доставя като стерилен, буфериран воден разтвор на травопрост с рН приблизително 5,7 и осмолалитет приблизително 290 mOsmol/kg.
TRAVATAN Z ® съдържа Активен: травопрост 0,04 mg/ml; Неактивни: полиоксил 40 хидрогенирано рициново масло, sofZia ® (борна киселина, пропилей гликол, сорбитол, цинков хлорид), натриев хидроксид и/или солна киселина (за регулиране на рН) и пречистена вода, USP. Съхранява се в бутилката с йонно буферирана система, sofZia ® .
ПОКАЗАНИЯ
TRAVATAN Z ® (офталмологичен разтвор на травопрост) 0,004% е показан за намаляване на повишеното вътреочно налягане при пациенти с глаукома с отворен ъгъл или очна хипертония.
ДОЗИРОВКА И АДМИНИСТРАЦИЯ
Препоръчителната доза е една капка в засегнатото око (очи) веднъж дневно вечер. TRAVATAN Z ® (офталмологичен разтвор на травопрост) не трябва да се прилага повече от веднъж дневно, тъй като е доказано, че по-честото приложение на аналози на простагландин може да намали ефекта на понижаване на вътреочното налягане.
Намаляването на вътреочното налягане започва приблизително 2 часа след първото приложение с максимален ефект, достигнат след 12 часа.
TRAVATAN Z ® може да се използва едновременно с други локални офталмологични лекарствени продукти за понижаване на вътреочното налягане (ВОН). Ако се използват повече от едно офталмологично лекарство за локално приложение, лекарствата трябва да се прилагат с интервал най-малко 5 минути.
КАК СЕ ДОСТАВЯ
Форми на дозиране и силни страни
Очен разтвор, съдържащ травопрост 0,04 mg/ml.
Съхранение и работа
TRAVATAN Z ® (офталмологичен разтвор на травопрост) 0,004% е стерилен, изотоничен, буфериран, консервиран, воден разтвор на травопрост (0,04 mg/ml), доставен в овалната опакова система DROP-TAINER ® на Alcon.
TRAVATAN Z ® се предлага като 2,5 ml разтвор в 4 ml и 5 ml разтвор в 7,5 ml бутилка от естествен полипропилен с дозатор с естествен полипропиленов капкомер и тюркоазен полипропилен или полиетилен с висока плътност. Доказателствата за подправяне се предоставят със свиваща се лента около затварянето и областта на врата на опаковката.
2.5 мл пълнеж -- NDC 0065-0260-25
5 ml пълнене ---- NDC 0065-0260-05
Съхранение
Съхранявайте при 2 ° C - 25 ° C (36 ° F - 77 ° F).
Разпространява се от: Alcon Laboratories, Inc. Форт Уърт, Тексас 76134. Ревизиран: септември 2017 г.
ВЪПРОС
СТРАНИЧНИ ЕФЕКТИ
Опит от клинични изпитвания
Тъй като клиничните изпитвания се провеждат при много различни условия, честотата на нежеланите реакции, наблюдавани в клиничните изпитвания на дадено лекарство, не може да бъде директно сравнена с честотата в клиничните изпитвания на друго лекарство и може да не отразява честотата, наблюдавана на практика.
Най-честата нежелана реакция, наблюдавана при контролирани клинични проучвания с TRAVATAN ® (офталмологичен разтвор на травопрост) 0,004% и TRAVATAN Z ® (офталмологичен разтвор на травопрост) 0,004%, е очна хиперемия, която се съобщава при 30% до 50% от пациентите. До 3% от пациентите са прекратили терапията поради конюнктивална хиперемия. Очните нежелани реакции, съобщени с честота от 5% до 10% в тези клинични проучвания, включват намалена зрителна острота, дискомфорт в очите, усещане за чуждо тяло, болка и сърбеж.
Очните нежелани реакции, съобщени с честота от 1% до 4% при клинични изпитвания с TRAVATAN ® или TRAVATAN Z ®, включват анормално зрение, блефарит, замъглено зрение, катаракта, конюнктивит, оцветяване на роговицата, сухо око, обезцветяване на ириса, кератит, коричка на капака, очно възпаление, фотофобия, субконюнктивален кръвоизлив и разкъсване.
Постмаркетингов опит
Допълнителни нежелани реакции са идентифицирани по време на употребата на TRAVATAN ® или TRAVATAN Z ® след одобрение в клиничната практика. Тъй като те се отчитат доброволно от популация с неизвестен размер, не могат да се правят оценки на честотата. Реакциите, които са избрани за включване поради тяхната сериозност, честота на докладване, възможна причинно-следствена връзка с TRAVATAN ® или TRAVATAN Z ®, или комбинация от тези фактори, включват: аритмия, повръщане, епистаксис, тахикардия и безсъние.
В постмаркетинговата употреба с аналози на простагландин са наблюдавани промени в периорбитала и капака, включително задълбочаване на браздата на клепачите.
ВЗАИМОДЕЙСТВИЯ НА ЛЕКАРСТВАТА
Не е предоставена информация
ПРЕДУПРЕЖДЕНИЯ
Включен като част от "ПРЕДПАЗНИ МЕРКИ" Раздел
ПРЕДПАЗНИ МЕРКИ
Пигментация
Съобщава се, че офталмологичният разтвор на Travoprost причинява промени в пигментираните тъкани. Най-често съобщаваните промени са повишена пигментация на ириса, периорбиталната тъкан (клепач) и миглите. Очаква се пигментацията да се увеличи, докато се прилага травопрост. Промяната в пигментацията се дължи на повишеното съдържание на меланин в меланоцитите, а не на увеличаването на броя на меланоцитите. След прекратяване на лечението с травопрост, пигментацията на ириса вероятно ще бъде постоянна, докато пигментацията на периорбиталната тъкан и измененията на миглите се съобщава за обратима при някои пациенти. Пациентите, които получават лечение, трябва да бъдат информирани за възможността за повишена пигментация. Дългосрочните ефекти на повишената пигментация не са известни.
Промяната в цвета на ириса може да не бъде забележима от няколко месеца до години. Обикновено кафявата пигментация около зеницата се разпространява концентрично към периферията на ириса и целият ирис или части от ириса стават по-кафеникави. Нито невусите, нито луничките на ириса изглежда са засегнати от лечението. Докато лечението с TRAVATAN Z ® (офталмологичен разтвор на травопрост) може да продължи 0,004% при пациенти, които развият значително повишена пигментация на ириса, тези пациенти трябва да се преглеждат редовно [вж. ИНФОРМАЦИЯ ЗА ПАЦИЕНТА].
Промени в миглите
TRAVATAN Z ® може постепенно да промени миглите и косата в третираното око. Тези промени включват увеличена дължина, дебелина и брой мигли. Промените в миглите обикновено са обратими при прекратяване на лечението.
Вътреочно възпаление
TRAVATAN Z ® трябва да се използва с повишено внимание при пациенти с активно вътреочно възпаление (напр. Увеит), тъй като възпалението може да се изостри.
Оток на макулата
По време на лечението с офталмологичен разтвор на травопрост се съобщава за оток на макулата, включително цистоиден оток на макулата. TRAVATAN Z ® трябва да се използва с повишено внимание при пациенти с афакия, при пациенти с псевдофакия с разкъсана капсула на задната леща или при пациенти с известни рискови фактори за оток на макулата.
Затваряне под ъгъл, възпалителна или неоваскуларна глаукома
TRAVATAN Z ® не е оценяван за лечение на закритоъгълна, възпалителна или неоваскуларна глаукома.
Бактериален кератит
Има съобщения за бактериален кератит, свързан с използването на многодозови контейнери с локални офталмологични продукти. Тези контейнери са били неволно замърсени от пациенти, които в повечето случаи са имали едновременно заболяване на роговицата или нарушение на очната епителна повърхност [вж. ИНФОРМАЦИЯ ЗА ПАЦИЕНТА].
Използвайте с контактни лещи
Контактните лещи трябва да бъдат премахнати преди вливането на TRAVATAN Z ® и могат да бъдат поставени отново 15 минути след приложението му.
Неклинична токсикология
Канцерогенеза, мутагенеза, увреждане на плодовитостта
Двугодишните проучвания за канцерогенност при мишки и плъхове при подкожни дози от 10, 30 или 100 mcg/kg/ден не показват никакви доказателства за канцерогенен потенциал. Въпреки това, при 100 mcg/kg/ден, мъжките плъхове са лекувани само в продължение на 82 седмици и максималната поносима доза (MTD) не е достигната в проучването на мишки. Високата доза (100 mcg/kg) съответства на нива на експозиция, надвишаващи 400 пъти експозицията на човека при максималната препоръчителна очна доза (MRHOD) при хора от 0,04 mcg/kg, въз основа на плазмените нива на активното лекарство.
Травопрост не е мутагенен при теста на Ames, теста на миши микронуклеус или анализа на хромозомни аберации на плъхове. Леко увеличение на мутантната честота се наблюдава при един от двата анализа на миши лимфом в присъствието на ензими за активиране на плъх S-9.
Травопрост не повлиява индексите на чифтосване или плодовитост при мъжки или женски плъхове при подкожни дози до 10 mcg/kg/ден (250 пъти MRHOD от 0,04 mcg/kg/ден на база mcg/kg). При 10 mcg/kg/ден средният брой на жълтите тела е намален и загубите след имплантацията са увеличени. Тези ефекти не са наблюдавани при 3 mcg/kg/ден (75 пъти MRHOD).
Използване в специфични популации
Бременност
Категория Бременност С
Тератогенни ефекти
Травопрост е тератогенен при плъхове, при интравенозна доза до 10 mcg/kg/ден [250 пъти максималната препоръчителна очна доза при хора (MRHOD)], доказано от увеличаване на честотата на скелетни малформации, както и външни и висцерални малформации, като слети стернебри, куполна глава и хидроцефалия. Травопрост не е тератогенен при плъхове при интравенозни дози до 3 mcg/kg/ден (75 пъти MRHOD) или при мишки при подкожни дози до 1 mcg/kg/ден (25 пъти MRHOD). Травопрост води до увеличаване на загубите след имплантацията и намаляване на жизнеспособността на плода при плъхове при интравенозни дози над 3 mcg/kg/ден (75 пъти MRHOD) и при мишки при подкожни дози над 0,3 mcg/kg/ден (7,5 по MRHOD).
При потомството на женски плъхове, получили травопрост подкожно от Ден 7 на бременността до Ден 21 на лактация при дози от = 0,12 mcg/kg/ден (3 пъти MRHOD), честотата на постнатална смъртност е увеличена и новороденото наддаване на телесно тегло е намалява. Засегнато е и развитието на новороденото, което се доказва от забавено отваряне на очите, отлепване на пина и препуциално отделяне и от намалена двигателна активност.
Няма адекватни и добре контролирани проучвания на TRAVATAN Z ® (офталмологичен разтвор на травопрост) 0,004% приложение при бременни жени. Тъй като репродуктивните проучвания при животни не винаги предсказват човешкия отговор, TRAVATAN Z ® трябва да се прилага по време на бременност само ако потенциалната полза оправдава потенциалния риск за плода.
Кърмещи майки
Проучване при кърмещи плъхове демонстрира, че радиоактивно маркиран травопрост и/или неговите метаболити се екскретират в млякото. Не е известно дали това лекарство или неговите метаболити се екскретират в кърмата. Тъй като много лекарства се екскретират в кърмата, трябва да се внимава, когато TRAVATAN Z ® се прилага на кърмачка.
Педиатрична употреба
Употребата при педиатрични пациенти на възраст под 16 години не се препоръчва поради потенциални опасения за безопасност, свързани с повишена пигментация след продължителна хронична употреба.
Гериатрична употреба
Не са наблюдавани общи клинични разлики в безопасността или ефективността между възрастни и други възрастни пациенти.
Чернодробно и бъбречно увреждане
Очен разтвор на Travoprost 0,004% е проучен при пациенти с чернодробно увреждане, а също и при пациенти с бъбречно увреждане. При тези пациенти не са наблюдавани клинично значими промени в хематологията, кръвната химия или лабораторните данни за изследване на урината.
ПРЕДОЗИРАНЕ
Не е предоставена информация
ПРОТИВОПОКАЗАНИЯ
КЛИНИЧНА ФАРМАКОЛОГИЯ
Механизъм на действие
Свободна киселина на травопрост, аналог на простагландин е селективен агонист на FP простаноиден рецептор, за който се смята, че намалява вътреочното налягане чрез увеличаване на увеосклералния отток. Точният механизъм на действие към момента не е известен.
Фармакокинетика
Травопрост се абсорбира през роговицата и се хидролизира до активната свободна киселина. Данните от 4 фармакокинетични проучвания с многократни дози (общо 107 пациенти) показват, че плазмените концентрации на свободната киселина са под 0,01 ng/ml (количествената граница на анализа) при две трети от пациентите. При тези индивиди с количествено измерими плазмени концентрации (N = 38) средната плазмена Cmax е 0,018 ± 0,007 ng/mL (варира от 0,01 до 0,052 ng/mL) и е достигната в рамките на 30 минути. От тези проучвания се очаква, че травопрост има плазмен полуживот от 45 минути. Няма разлика в плазмените концентрации между 1 и 7 ден, което показва, че стационарното състояние е достигнато рано и че няма значително натрупване.
Травопрост, пролекарство на изопропилов естер, се хидролизира от естерази в роговицата до неговата биологично активна свободна киселина. Системно свободната киселина на травопрост се метаболизира до неактивни метаболити чрез бета-окисление на веригата α (карбоксилна киселина), за да се получат аналози 1,2-динор и 1,2,3,4-тетранор, чрез окисляване на 15-хидроксилната част, както и чрез намаляване на двойната връзка 13, 14.
Елиминирането на свободната от травопрост киселина от плазмата е бързо и нивата обикновено са под границата на количествено определяне в рамките на един час след дозирането. Крайният елиминационен полуживот на свободна от травопрост киселина е оценен от четиринадесет пациенти и варира от 17 минути до 86 минути със среден полуживот от 45 минути. По-малко от 2% от локалната очна доза травопрост се екскретира с урината в рамките на 4 часа като свободна киселина на травопрост.
Клинични изследвания
В клинични проучвания пациенти с глаукома с отворен ъгъл или очна хипертония и изходно налягане 25-27 mmHg, които са били лекувани с TRAVATAN ® (офталмологичен разтвор на травопрост) 0,004% или TRAVATAN Z ® (офталмологичен разтвор на травопрост) 0,004% веднъж дневно в вечер демонстрира 7-8 mmHg намаление на вътреочното налягане. В подгруповите анализи на тези проучвания средното намаляване на ВОН при чернокожи пациенти е било до 1,8 mmHg по-голямо, отколкото при пациенти, които не са чернокожи. Понастоящем не е известно дали тази разлика се дължи на расата или на силно пигментираните ириди.
В многоцентрово, рандомизирано, контролирано проучване, пациенти със средно изходно вътреочно налягане от 24-26 mmHg на TIMOPTIC * 0,5% два пъти дневно, които са били лекувани с TRAVATAN ® (офталмологичен разтвор на травопрост) 0,004%, дозирани дневно като допълнение към TIMOPTIC * 0,5% два пъти дневно демонстрира 6-7 mmHg намаление на вътреочното налягане.
ИНФОРМАЦИЯ ЗА ПАЦИЕНТА
Потенциал за пигментация
Посъветвайте пациента за възможността за повишена кафява пигментация на ириса, която може да е постоянна. Информирайте пациента за възможността за потъмняване на кожата на клепачите, което може да бъде обратимо след прекратяване на лечението с TRAVATAN Z ® (офталмологичен разтвор на травопрост) 0,004%.
Потенциал за промени в миглите
Информирайте пациента за възможността за промени в окосмяването на миглите и велуса в третираното око по време на лечението с TRAVATAN Z ®. Тези промени могат да доведат до несъответствие между очите в дължината, дебелината, пигментацията, броя на миглите или велусните косми и/или посоката на растеж на миглите. Промените в миглите обикновено са обратими при прекратяване на лечението.
Работа с контейнера
Инструктирайте пациента да избягва да позволява на върха на контейнера за дозиране да контактува с окото, околните структури, пръсти или друга повърхност, за да се избегне замърсяване на разтвора от обикновени бактерии, за които е известно, че причиняват очни инфекции. Сериозно увреждане на окото и последваща загуба на зрение може да се получи в резултат на използването на замърсени разтвори.
Кога да потърсите съвет от лекар
Посъветвайте пациента, че ако развият интеркурентно очно състояние (напр. Травма или инфекция), претърпят очна операция или развият някакви очни реакции, особено конюнктивит и реакции на клепачите, те трябва незабавно да потърсят съвет от своя лекар относно продължаването на употребата на TRAVATAN Z ® .
Използвайте с контактни лещи
Контактните лещи трябва да бъдат премахнати преди вливането на TRAVATAN Z ® и могат да бъдат поставени отново 15 минути след приложението му.
Употреба с други офталмологични лекарства
Ако се използват повече от едно локално офталмологично лекарство, лекарствата трябва да се прилагат поне 5 минути между приложенията.
- Ултракратно отслабване, странични ефекти, взаимодействия, снимки, предупреждения; Дозиране - WebMD
- Употреба на тирозин, странични ефекти, взаимодействия, дозировка и предупреждение
- Xenical (Orlistat 120 mg) - Дозировка, Употреба, Взаимодействия, Предупреждения; Странични ефекти
- Тиамин Hcl (витамин В1) Инжекционни употреби, странични ефекти, взаимодействия, снимки, предупреждения; Дозиране -
- Вентолин през устата, странични ефекти, взаимодействия, снимки, предупреждения; Дозиране - WebMD
