Свързани термини:
- Фазови диаграми
- Йонна течност
- Разтворимост
- Налягане на парите
- Фазово равновесие
- Уравнение на държавата
- Течно-течно равновесие
- Термодинамика
Изтеглете като PDF
За тази страница
ОПРЕДЕЛЯНЕ НА ФАЗНИ ДИАГРАМИ С РЕАКТИВНИ ИЛИ ЛЕТКИ ЕЛЕМЕНТИ
Твърдо течно равновесие 315
Отслабване на твърдо вещество след уравновесяване с течност 315
Химичен анализ на отделена течност 316
Химичен анализ на закалени проби 318
Термичен анализ 319
320
Електрическо съпротивление 321
Анодно окисление 321
Магнитна възприемчивост 323
Енталпия на разреждане 325
Кинетика на разлагане или образуване на сплав 325
Коефициент на дифузия 327
Налягане на парите 327
Рентгенова абсорбционна спектрометрия 328
Оптична отражателна способност 328
Тестове за корозия 328
Движение на течни метални включвания в йонни кристали 330
Подготовка на пробата в хроматографията
Serban C. Moldoveanu, Victor David, в Journal of Chromatography Library, 2002
Течно-твърдо равновесие за двукомпонентни системи
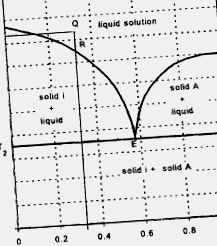
Твърдо-течно равновесие за двукомпонентна система, в която течностите се смесват и разтворимостта твърдо-твърдо вещество е незначителна, обикновено се описва чрез диаграма, както е показано на фигура 1.3.4. Налягането се поддържа постоянно в процеса, описан от този тип диаграма (максималният брой степени на свобода е три). За точка Q при температура T1 материалът се разтопява. Намалявайки температурата, съставът остава немодифициран до точката R, където твърдото „i” започва да кристализира и съставът се модифицира по линията RE до точката E (евтектична точка). Когато температурата достигне T2, съответстваща на евтектичната точка, целият материал става твърд. Съставът на разтвора, съответстващ на точка Е, е известен като евтектичен състав. Материалът под Т2 е твърдо вещество, образувано от кристали чист „i“ и микрокристална смес от „i“ и „A“ с евтектичен състав.
Фигура 1.3.4. Диаграма за равновесие твърдо-течно състояние на двукомпонентна система, при която течностите се смесват, а разтворимостта твърдо вещество - твърдо вещество е незначителна.
Дифузия в нанопорови хост системи
2.2 Течно-твърдо равновесие
Течно-твърдото равновесие в затворени пространства е по-малко разбираемо в сравнение с газово-течното. Една конкретна причина за това е сложността на преходите течност-твърдо вещество, които дори в насипно състояние могат да показват съвсем различни характеристики, произхождащи например от различните механизми, пораждащи фазовите преходи. 68 По този начин твърдите вещества или молекулярните кристали, съставени от едни и същи атоми или молекули, могат да имат доста различни кристални структури, които могат да бъдат допълнително определени от ограниченията, включително геометрията на ограничаващите пространства и повърхностната химия. 69–73 По-нататък обаче няма да се занимаваме с всички тези фини детайли, като атомни структури и ще се ограничим до разглеждане само на общите връзки между размера на порите, морфологията на порите и свойствата на макроскопичната течност и поведението на замръзване и топене. По-специално ще се вземат предвид само течности, които омокрят стените на порите.
При тези обстоятелства проблемът напомня за преходи газ-течност в затворено пространство. 74 Тази аналогия произтича от факта, че изместванията на точките за преход газ-течност в малки пори, в първо приближение, са уловени от уравнението на Келвин. Описание на твърдото течно равновесие може да се направи по подобен начин, като се използва уравнението на Гибс – Томсън със същата структура. И двамата прогнозират, че размерите на порите в зависимост от размера на преходното налягане и температурата са пропорционални на обратния размер на порите, в резултат на конкуренцията между общата и свободната енергия на интерфейса. Освен това има много експериментални доказателства, че при пълна аналогия с многослойната адсорбция феноменът на повърхностно предварително топене 75 води до съществуването на подобен на течност, неподреден слой между стените на порите и замръзналата кристална сърцевина в вътрешността на порите, чиято цел е да се сведе до минимум общата енергия поради несъответствие в кристалните структури между две твърди вещества. 76–78 По този начин много функции, обсъдени в предходния раздел, също се прилагат тук и следователно ще бъдат обсъдени само накратко.
Един от централните въпроси за разбиране на равновесие между течности и течности в порести твърди вещества на базата на макроскопична термодинамика е местоположението на равновесната температура на преход. При газовата сорбция за материали с идеални пористи структури тя е свързана с капилярно изпарение. Като пълна аналогия може да се свърже замразяващият преход с равновесния преход (трябва обаче да се приеме, че общата замразена фаза се подава към отворите на порите, за да се избегне всяко забавяне на нуклеацията). 79 По този начин, метастабилността в замразяващо-топящата се хистерезис е свързана със забавено топене поради бариерите в свободната енергия за зародиш на течни „мостове“ в порите със замръзнала течност в техните основни части. При отсъствие на външна замразена фаза при отворите на порите се наблюдава метастабилно замразяване, зависещо от размера на порите, поради забавено хомогенно нуклеиране за размери на порите над критичния. 80 Трябва да се отбележи обаче, че тази картина не е напълно подкрепена и температурата на съжителство също е свързана с температурата на топене (вж. Напр. Референции 81,82).
- Rubus Chamaemorus - общ преглед на ScienceDirect теми
- Техника за прочистване и улавяне - общ преглед на темите на ScienceDirect
- Пиелонефрит - общ преглед на ScienceDirect теми
- Натриев тиосулфат - общ преглед на ScienceDirect теми
- Натриев тиосулфат - общ преглед на ScienceDirect теми