Резюме
Тревожното нарастване както на честотата, така и на тежестта на хранителните алергии съвпадна с промени в начина на живот в западните общества, като диетични модификации и повишена употреба на антибиотици. Тези демографски промени променят дълбоко съвместно развитите взаимоотношения между гостоприемника и микробиотата, изчерпвайки бактериалните популации, критични за поддържането на лигавичната хомеостаза. Има все повече доказателства, че дисбиозата, свързана със сенсибилизация към храната, не успява да стимулира защитни толерогенни пътища, което води до развитието на имунни отговори тип 2, които характеризират алергично заболяване. Определянето на ролята на полезните, предпазващи от алергии членове на микробиотата в регулирането на толерантността към храната има вълнуващ потенциал за нови интервенции за лечение на диетични алергии чрез модулация на микробиотата.
Кожата и всички мукозни повърхности са населени от специфична за мястото микробиота (18). Присъстващите микроби могат да включват бактерии, вируси, бактериофаги, археи, гъби, паразитни червеи и протести (19, 20). Коменсалните бактерии са най-добре характеризирани, особено в стомашно-чревния тракт, където тяхната плътност се увеличава от приблизително 10 4 до 10 8 на милилитър луминално съдържание в тънките черва до приблизително 10 11 организма на милилитър луминално съдържание в дебелото черво, най-високата бактериална плътност на всяка анализирана досега среда на земята (21). В допълнение към тази голяма общност от бактерии, стомашно-чревният тракт съдържа и повече имунни клетки от всеки друг орган. Двамата са в интимна комуникация; поддържането на хомеостазата между тези микроби и имунната система е от съществено значение за здравето. Вълнуващите нови изследвания започват да идентифицират механизмите, чрез които полезните функции на микробиотата регулират толерантността към хранителните антигени (22, 23).
В този преглед ще обсъдим ролята на микробиотата в поддържането на толерантност към храната и ще разгледаме как коменсалната дисбиоза насърчава развитието на хранителна алергия. И накрая, ще разгледаме клиничните доказателства за ролята на микробиотата в регулирането на сенсибилизацията към хранителни алергени и ще проучим стратегии за разработване на микробиомодулиращи терапевтични средства за предотвратяване или лечение на хранителна алергия.
Разширяване на хигиенната хипотеза върху микробиотата
Устна толерантност към хранителни антигени
Микробиота-медиирана толерантност към хранителни антигени
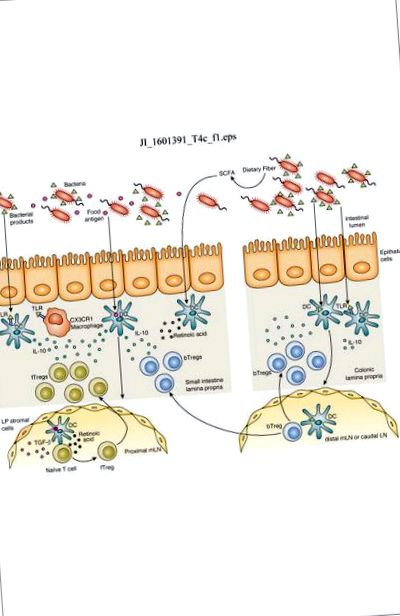
Хранителният антиген се поема от дендритни клетки (DC) в тънките черва, които мигрират към проксималния мезентериален лимфен възел (mLN). TGF-β и ретиноевата киселина, произведени от LN стромални клетки и DC, индуцират диференциация на специфичните Tregs на хранителния антиген (fTregs) и повишаване на регулацията на чревните самонасочващи се молекули. fTregs мигрират обратно към тънкочревната ламина проприа, където TLR сигнализирането от бактериални продукти индуцира производството на IL-10 от резидентни макрофаги и DC на CX3CR1, което поддържа разширяването на Treg и производството на IL-10. Бактериалните продукти също се поемат от DC на дебелото черво, които мигрират към дисталния mLN и каудалния LN, за да предизвикат диференциация на бактериални специфични Tregs (bTreg). Въпреки че преобладава в дебелото черво, bTregs също мигрират към тънките черва, където освобождават IL-10, за да поддържат толерогенната имунна среда. Ферментацията на диетични фибри до късоверижни мастни киселини (SCFA) може да засили производството на ретиноева киселина чрез DC и да насърчи диференциацията на Treg. TLR сигнализирането от бактериални продукти като LPS индуцира толерогенен фенотип в DC на дебелото черво и тънките черва, което насърчава диференциацията на Tregs.
Микробиота-медиирана модулация на чревната бариерна функция
А) Здравата микробиота ще индуцира бариерен защитен отговор в червата, отчасти, чрез производство на SCFA, които най-вероятно действат върху ILC3s, за да произведат IL-22. IL-22 индуцира производството на антимикробен пептид (AMP) от клетките на Paneth и производството на слуз от бокаловите клетки, за да подсили бариерната функция, контролирайки местоположението и състава на микробиотата. Тази бариерна защитна функция предотвратява неконтролиран достъп до собствената ламина от хранителни антигени, за да предотврати алергична сенсибилизация. Б) Дисбиозата не успява да индуцира тези защитни пътища. Дисрегулираната епителна бариерна функция и нарушеният слузен слой позволяват повишена пропускливост за хранителните антигени. Повредените или стресирани епителни клетки освобождават алармините IL-25, IL-33 и TSLP, които активират ILC2s, за да произведат IL-4 и IL-13, което насърчава развитието на алергична сенсибилизация към хранителни антигени чрез генериране на специфични за храната антиген Th2 клетки (fTh2 ).
Клинични съображения и потенциална терапия
Следователно, има колективни доказателства, че алергичните фенотипи са свързани с промени в чревния микробиом и че тази дисбиоза може да стимулира алергичния отговор. Също така е възможно самото алергично възпаление да предизвика промени в микробиотата. И двата сценария могат да допринесат за алергична сенсибилизация в различни моменти и етапи на заболяването, подчертавайки сложния и динамичен характер на взаимодействията между гостоприемника и микробите. Тъй като научаваме повече за специфичните имуномодулиращи ефекти на определени членове на микробиотата, може да успеем да идентифицираме микробни сигнатури, свързани с проалергични реакции, като освобождаване на алармини от епителните клетки, които допринасят за алергична сенсибилизация към храната. Обратно, идентифицирането на здрава микробиота, която засилва толерантността и бариерната функция в червата, ще позволи по-целенасочено лечение за използване на микробиотата за възстановяване на здравето.
Заключения
Значителното нарастване както на честотата, така и на тежестта на хранителните алергии, което се е случило успоредно с дълбоки промени в околната среда и начина на живот, предполага връзка между промените в микробиотата и нарастващото разпространение на алергичните заболявания. Повишаването на знанията за това как имунният отговор се влияе от микробиотата разкрива нови подходи за лечение на заболявания като хранителна алергия. Въпреки че вече има обещаващи доказателства в подкрепа на манипулирането на микробиотата по време на ранен живот за предотвратяване на алергична сенсибилизация, все още не е ясно дали стабилно установената чревна микробиота може да бъде ефективно манипулирана за лечение на хранителна алергия (109). Ние знаем, че при възрастни микробиотата може лесно да бъде променена, дори в ежедневни графици, чрез промени в компонентите на диетата, особено фибрите (4, 15, 110). Нещо повече, използването на микробни метаболити за лечение на сложни имунно-медиирани заболявания започва да дава резултати (111). Тези наблюдения дават обещание на визията, че модулиращите микробиотерапията ще имат ефективност по-късно в живота, особено като допълнителна стратегия за потенциране на антиген специфични протоколи за десенсибилизация и насърчаване на дълготрайна толерантност (112).
Благодарности
Тази работа беше подкрепена от Национален здравен институт Grant R01 AI 106302, Фондация „Съншайн“, Център за транслационна медицина в Учичаго, Основен център за изследване на храносмилателните заболявания на Учикаго (DK42086) и F.A.R.E. (Изследвания и образование за алергии към храни).
Авторите биха искали да благодарят на P. Belda Ferre и E. Beltran за критичния преглед на този ръкопис.
- Вие сте това, което ядете религия и морал; влияние върху избора на храни - The State Press
- Когато семейството не; t Вземете детето си; s Хранителни алергии - алергичен живот
- Защо светът става все по-алергичен към храната - BBC News
- Данни от проучването за акриламид в храните FDA
- Какво са яли древните римляни древна римска храна