Катедра по медицина, Университет на Алабама в Бирмингам, Бирмингам, Алабама;
Институт за сърдечно-съдови изследвания, Национална университетска здравна система, Национален университет в Сингапур, Сингапур; и
Катедра по медицина, Университет на Алабама в Бирмингам, Бирмингам, Алабама;
Катедра по медицина, Университет на Алабама в Бирмингам, Бирмингам, Алабама;
Катедра по медицина, Университет на Алабама в Бирмингам, Бирмингам, Алабама;
Катедра по медицина, Университет на Алабама в Бирмингам, Бирмингам, Алабама;
Медицински център в Бирмингам, Бирмингам, Алабама
Адрес за заявки за повторно отпечатване и друга кореспонденция: S. G. Lloyd, Катедра по медицина, Отдел по сърдечно-съдови заболявания, Унив. на Алабама в Бирмингам, D-101 Cardiac MRI, 1808 7th Ave. South, Бирмингам, AL 35294-0012 (имейл: [имейл защитен]).
Резюме
Окисляването на субстрата и реакцията към I/R са по-зависими от диетата, отколкото от промените във физиологичния обхват на циркулиращия субстрат и инсулина. Това е свързано с променена инсулинова чувствителност. След I/R имаше положителна (с кетон) и отрицателна (с FFA) корелация между възстановяването на функцията и окисляването на субстрата.
Животни и диети.
Всички експерименти с животни са одобрени от Институционалния комитет за грижи и употреба на животните към Университета на Алабама в Бирмингам и са следвани Ръководството за грижа и използване на лабораторни животни (Национална академия на науките, 1996). Възрастни мъжки плъхове Sprague-Dawley 300 ± 10 g (Taconic Farms, Hudson, NY) са хранени с една от двете диети, всяка от които е проектирана да бъде подобна на тези, използвани от хората за отслабване: HFLCD [60% калории от мазнини/30% от протеини/10% от въглехидрати, относително високо съдържание на протеини (30% от ккал) и много голямо количество наситени (40%) и мононенаситени (40%) мазнини, проектирани да бъдат подобни на индукционната фаза на Диета на Аткинс за хора (10) (TestDiet 5TSY, Richmond, IN)] или диета с ниско съдържание на мазнини (CONT) (16/19/65%; TestDiet 5TJM). Подробните компоненти на диетите, включително пропорциите на наситени, моно- и полиненаситени мазнини, както и n-3 и n-6 полиненаситени мастни киселини са описани по-рано (24, 25). Животните са хранени с диети в продължение на 14 дни преди извършване на експерименти с перфузия. Плъховете бяха настанени при 22 ° С при 12-часов цикъл светлина-тъмнина. На животните беше разрешен достъп ad libitum до храна и вода.
Изолирани сърдечни перфузии.
Таблица 1. Използвани инсулинови и кетонни буферни състави и обозначения/етикети
ЯМР спектроскопия.
След 30-минутно уравновесяване немаркираната глюкоза, лактат, палмитат и кетон в буфера се превключват на 13 С-маркирана глюкоза (равномерно маркирана на всички 6 въглерода, обозначени като [U-13 C] глюкоза), натриев лактат (равномерно маркирани при всичките 3 въглерода, обозначени [U-13 C] лактат), натриев пируват (с равномерно маркиране; [U-13 C] пируват), натриев палмитат (маркиран с 13 C само в 1-позиция; [1- 13 C] палмитат) и натриев 3-хидроксибутират като кетон (3-НВ, маркиран в позиции 2 и 4; [2,4-13 С] 3-НВ) при същите концентрации като немаркираните съединения, както е описано по-подробно по-долу . След 30 минути перфузия с етикетирани субстрати, цели сърца се фиксират, замразените сърца се пулверизират и сърдечната тъкан се хомогенизира и се екстрахира с ледено студена 6% перхлорна киселина. Екстрактът беше лиофилизиран и повторно разтворен в калиев фосфатен буфер (рН 7,5, 50 mM) с 2 H2O разтворител (99,9%; Кеймбридж изотоп лаборатории, Andover, МА).
Протонно отделени, усилени с NOE 13C NMR спектри бяха събрани на Bruker AVANCE 500 NMR спектрометър, работещ при 11.85 T, използвайки TBI хетероядрена широколентова сонда. Спектрите бяха събрани при 300 K със спектрална ширина 25 kHz и 32k точки от данни. Спектрите се събират със сумиране на сканирането, докато се постигне адекватно съотношение сигнал/шум (обикновено 4k – 64k сканиране). Спектрите бяха анализирани със софтуер Nuts (AcornNMR, Livermore, CA). Данните от 13 С времеви домейн се обработват с 1 до 2 Hz разширяване на линията, запълване с нула, трансформиране на Фурие и препратка към пика на метилов въглерод на лактат (при 21,1 ppm). Мултиплетните относителни зони на глутамат 13 С ЯМР при въглерод 1 до 5 и интегрираните зони на С3 и С4 резонансите (коригирани за релаксационни ефекти) бяха измерени, както е описано по-горе (26, 27).
13 С-глутамат изотомерен анализ.
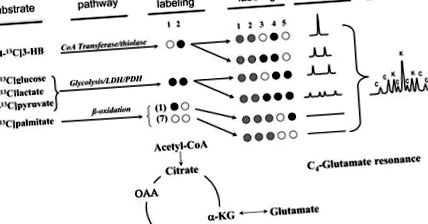
Фиг. 1.Схема на маркиране от субстрати в TCA цикъл, както се използва в тези експерименти, и получените глутамат C-4 спектрални изотопомери. Черните кръгове представляват етикетиране на въглерод-13 (обогатяване от 98 до 99%), етикети на естественото изобилие от отворени кръгове (т.е. 99% въглерод-12), а сивите кръгове могат да бъдат или въглерод-12, или въглерод-13, тъй като те не допринасят за глутаматният С-4 спектър. В 13 С ЯМР спектъра вдясно, К представлява изотопомерни пикове, получени от кетон (3-НВ); С представлява тези, получени от въглехидрати (глюкоза, лактат и пируват). Имайте предвид, че β-окислението на [1- 13 С] палмитат води до седем немаркирани ацетил-КоА фрагменти и един [1- 13 С] ацетил-КоА фрагмент, нито един от които не допринася за резонанса на глутамат С4. OAA, оксалоацетат; α-KG, α-кетоглутарат.
Изолирани измервания на чувствителност към инсулин на сърцето.
Сърца, изолирани от групите CONT или HFLCD, бяха перфузирани с четирите перфузионни буфера (HI-HK, HI-LK, LI-LK и LI-HK) по време на изходната перфузия и LFI (0,3 ml/min; продължителност 60 минути), последвано от 60 минути реперфузия. Замразените цели сърца бяха прахообразни и бе извлечен протеин от проби от 50 μg за Western blot. За да се оцени инсулиновата чувствителност, друга група сърца бяха перфузирани с четири дози инсулин: много ниска доза (5 μU/ml), доза от физиологичен обхват (15 μU/ml), междинна доза (100 μU/ml) и фармакологична висока доза за максимална стимулация (2000 μU/ml); н = 5 за всяка доза инсулин и диетична група. След 60-минутна перфузия всички сърца бяха бързо замразени, извлечени бяха протеини от проби от 50 μg от цяла сърдечна тъкан и бяха проведени Western blots с търговски антитела: anti-Akt и anti-phospho-Ser473-Akt (разреждане 1: 2000; Abcam, Кеймбридж, Масачузетс). Интензитетите на лентата бяха анализирани от ImageJ за количествено определяне на Akt и фосфо-Akt (p-Akt). Интензитетът на фосфо-Akt се разделя на интензитета на общия Akt.
статистически анализи.
Данните за сравнение на непрекъснатите променливи между двете групи бяха анализирани чрез общ линеен модел многовариатен тест и тестове за линейна регресия (IBM SPSS Statistics, GraphPad Prism). Стойностите бяха изразени като средни стойности ± SE. Разликите между групите се считат за значителни в P
Фиг. 2.HFLCD повишава чувствителността към миокардно исхемично увреждане. A:% възстановяване на базовия RPP. Б. и ° С:% възстановяване на изходното ниво ± dP/dt в края на 60-минутен LFI и 60-минутна реперфузия. Данните са показани за всяка буферна перфузионна комбинация. Означава ± SE, н = 4 до 6 всяка група, *P
Таблица 2. Общ линеен модел определяне на степента на ефектите от диетата, буферния инсулин, буферния кетон и всички възможни взаимодействия между тези фактори върху функцията на лявата камера след исхемия-реперфузия
Фиг. 3.Представителни 13 C NMR спектри, демонстриращи въвеждане на TCA цикъл на субстрата при базови и I/R условия. Представителни 13 С ЯМР спектри в 15 до 55 ppm (наляво) и в близост до 33 ppm (нали), фокусирайки се върху глутаматния С4-резонанс, при условия на изходно ниво (условия на нормален поток) (A) или I/R (Б.). Буква С обозначава пикове, произтичащи от СНО, а К обозначава пикове, произтичащи от включването на кетони.
Таблица 3. Ефекти от диетата, буферния инсулин, буферния кетон и взаимодействията между тези фактори върху навлизането на субстрата на TCA цикъла след исхемия-реперфузия
Таблица 4. Ефект на диетата, нивата на буферния инсулин и кетони върху фракцията от общия ацетил-КоА, влизащ в TCA цикъла при условия на нормоксия и I/R.
Означава ± SE, н = 4 до 6 всяка група. Стойностите се изразяват като% от общия брой на TCA цикъла от пула ацетил-КоА, получени от всеки субстрат и закръглени до най-близкия процент.
* P # P † P ‡ P
Фиг. 4.Връзка между сърдечната функция и TCA цикъла Влизане на FFA, CHO и кетон. Наляво: корелация между производството на скорост-налягане (RPP) (mmHg/min) и TCA цикъла чрез анализ на линейна регресия. Корелация P стойност
Ефект от диетата и исхемията-реперфузия върху инсулиновата сигнализация в миокарда на плъхове.
Съотношението на фосфо-Akt към общия Akt е сходно между HFLCD и CONT сърцата при нормоксия. Въпреки това, при I/R условия, хранени с HFLCD плъхове обикновено показват намаляване на p-Akt/общ Akt в обхвата на комбинации от буферен инсулин и кетон, което показва намален ефект на инсулинов сигнал при HFLCD (Фиг. 5).
Фиг. 5.Инсулинова сигнализация в миокард на плъх при нормоксични и I/R условия. Проби от сърдечна тъкан от CONT и HFLCD, перфузирани с различни буфери, бяха подложени на Western blot анализ, откриващ p-Ser473-Akt и общ Akt. Данни, показани като съотношение на p-Akt/общ Akt, нормализирано, за да направи групата CONT = 100% при нормоксични и I/R условия; *P
Инсулинова чувствителност.
За да се изследва въздействието на HFLCD върху присъщата инсулинова чувствителност, ние оценихме ефекта на доза-отговор на инсулина върху фосфорилирането на Akt. Както е показано на фиг. 6, Western blot разкрива зависима от диетата прогресия на инсулиновия ефект върху фосфорилирането на Akt в диапазона на концентрацията на инсулин от физиологично ниско ниво (5 μU/ml), нормално до междинно високи граници при 15 и 100 μU/ml, до фармакологично високо ниво (2000 μU/ml). С HFLCD относителното фосфорилиране на Akt има тенденция да бъде по-високо при по-ниски дози инсулин, но показва притъпен отговор на повишаващите се нива на инсулин в сравнение с диетата CONT (което демонстрира прогнозираното зависимо от дозата относително увеличение на p-Akt с увеличаване на дозата инсулин; ).
Фиг. 6.Инсулинозависимо Akt фосфорилиране в миокард на плъхове на CONT и HFLCD. Western blot анализи на нивата на общия Akt и фосфо-Akt (p-Akt) в сърцата на CONT и HFLCD. Показаните данни са p-Akt/общо Akt, стандартизирани така, че групата CONT да е 100% за всяко условие. Стойностите се изразяват като средни стойности ± SE; н = 5 всеки, **P
Изследването на цялата група данни разкри, че както HFLCD, така и I/R повишават FFA окислението и намаляват CHO или кетонното окисление. Други групи съобщават, че стимулирането на окисляването на глюкозата предпазва от остър миокарден инфаркт и реперфузионно увреждане (42), а повишеното окисление на FFA е свързано с намален миокарден толеранс към исхемия-реперфузия (13); следователно всяко увеличаване на FFA и намаляване на CHO или кетонното окисление, индуцирано от HFLCD, може да доведе до влошена сърдечна функция по време на I/R. Това доведе до концепцията, че потискането на окислението на FFA на миокарда може да бъде терапевтична цел за подобряване на сърдечната ефективност в исхемичното сърце (40). Освен това излишъкът на хранителни вещества от диетата с високо съдържание на мазнини може да доведе до натрупване на токсични междинни продукти на метаболизма на мастните киселини от непълно окисление на митохондриалните мастни киселини (1) и да допринесе за инсулинова резистентност, оксидативен стрес и разединяване на окислителния метаболизъм от електронен трансфер (15, 20, 28, 38). Всъщност открихме, че относителната степен на окисление на FFA е в отрицателна корелация с възстановяването на функцията след I/R.
Докато нашите резултати показват, че храненето с HFLCD преди I/R е вредно, в други условия диетата с високо съдържание на мазнини може да бъде от полза. Rennison et al. (32) установяват, че храненето с високо съдържание на мазнини след лигиране на коронарните артерии подобрява митохондриалната и контрактилната функция при хронична сърдечна недостатъчност. Те също така съобщават, че диетата с високо съдържание на мазнини не е довела до влошена дисфункция на лявата камера, когато се яде след експериментален инфаркт на миокарда; въпреки че в същата поредица от експерименти прилагането на диета с високо съдържание на мазнини в продължение на 2 седмици преди лигиране на коронарните артерии води до повишен процент на хирургична смъртност (33). Следователно изглежда, че храненето с високо съдържание на мазнини преди инфаркт на миокарда може да бъде вредно, докато яденето на тази диета след инфаркт е вероятно полезно.
Специфичният състав на мастните киселини може да бъде важен при определяне на ефекта върху миокарда. Някои проучвания показват, че високо диетичните полиненаситени мастни киселини осигуряват кардиопротекция и подобряват сърдечната дейност чрез противовъзпалителни и антиоксидантни ефекти (11, 47) и чрез възстановяване на митохондриалните дихателни дейности и смекчаване на липидната пероксидация (11) по време или след I/R увреждане. Въпреки това, много високонаситените и мононенаситени диети, съдържащи мастни киселини (както в използвания от нас HFLCD, с 40% наситени и 40% мононенаситени, отразяващи диетите, които обикновено се консумират от хората), могат да бъдат вредни поради повишен оксидативен стрес (24).
Инсулинът може да бъде важна връзка между метаболизма на миокарда, функцията и отговора на исхемично увреждане (14, 18). Инсулинът намалява индуцираната от исхемия кардиомиоцитна некроза чрез Akt/NF-κB-зависим механизъм (7). Този защитен ефект може да зависи както от нивото на циркулиращия инсулин, така и от специфичната инсулинова чувствителност. В тази работа показахме, че сърцата, хранени с HFLCD, имат по-ниско фосфорилиране на Akt след I/R във физиологичен спектър на перфузионния буферен състав (фиг. 5), което показва, че присъщата чувствителност на миокарда към инсулина е по-ниска при тази диета при тези условия на перфузия . Този ефект не се дължи изцяло на ефекта върху окислението на глюкозата, тъй като е независим от ефекта му върху усвояването на глюкозата в постишемично изолираното работещо сърце на плъх (48). Наблюдаваното намаляване на фосфорилирането на Akt в HFLCD под I/R, без промяна в окисляването на СНО в сравнение с диетата CONT, е в съответствие с предишната ни работа, която установява, че HFLCD не променя експресията на поглъщане на глюкоза (GLUT4) и гени за окисление на глюкоза под I/R R (25). По този начин кардиопротективните ефекти на инсулина и неговото въздействие върху усвояването на глюкозата изглеждат поне частично несвързани.
В заключение установихме, че диетите, използвани в нашите проучвания, но не и концентрацията на инсулин или кетон в перфузионните смеси в нашите изолирани сърдечни експерименти, имат голям ефект върху окисляването на субстрата на миокарда и възстановяването на постишемичната функция (с по-лошо възстановяване на функцията при животните хранене с HFLCD). При I/R условия възстановяването на сърдечната функция е в отрицателна корелация с FFA окисление и положително корелирано с кетон окисление. Също така демонстрирахме, че HFLCD променя чувствителността на инсулина към миокарда. Нарушенията в инсулиновата чувствителност и метаболитните субстратни окислителни промени, наблюдавани при HFLCD, са в посока, която може да допринесе за намалено възстановяване на систолната функция с реперфузирана миокардна исхемия/инфаркт.
Тази работа бе подкрепена отчасти от Американската асоциация за сърдечни асоциации за развитие на гранта 0735212N и от Националния институт по диабет и храносмилателни и бъбречни заболявания P30 DK-056336 .
Не се декларират конфликти на интереси, финансови или други, от автора (авторите).
- Диетата с високо съдържание на мазнини и ниско съдържание на въглехидрати насърчава аритмичната смърт и увеличава миокарда
- Корейската диета предотвратява затлъстяването и подобрява инсулиновата резистентност при мишки, хранени с диета с високо съдържание на мазнини -
- Диетата с нисък гликемичен индекс може да подобри инсулиновата чувствителност при деца със затлъстяване Педиатрични изследвания
- Инсулиновата чувствителност и глюкозната толерантност се променят чрез поддържане на кетогенна диета
- Влияние на диетата с високо съдържание на мазнини върху вазоконстрикторната реактивност на устойчивостта на бяла и кафява мастна тъкан
- Alpha Services Limited Trust Company Белиз
- Затлъстяване, скованост на артериите и сърдечно-съдов риск Американско дружество по нефрология
- Подуване под кожата (ангиоедем)
- OKTYABRSKAYA HOTEL KRASNOYARSK 4 (Русия) - от £ 39 HOTELMIX
- Списък на лекарствата за диабет, алтернативи и разработки
- Как да започнете и да се придържате към онлайн хранителен вестник - организирайте себе си слаби
- Active Health Chiropractic Clinic Inc Идеален протеин - Открийте пълно отслабване и стабилност
- Може ли да се излекува преддиабет
- Citrus aurantium - Western New York Urology Associates, LLC
- 20 бързи и лесни закуски за кърмене; Сродни смело