Резюме
Кетогенната диета (KD) е диета с ниско съдържание на въглехидрати и високо съдържание на мазнини, която се използва за различни ефекти, свързани със здравето. Този тип диета е ефективна при потискане на припадъчната активност при деца с рефрактерна епилепсия (1) и може би по-често се прилага като диетична стратегия, при която поддържането на теглото или отслабването е желаният резултат. Доказано е, че ограничаването на диетичните въглехидрати води до положителни ефекти върху сърдечно-съдовите параметри. Консумирането на този тип диета влияе благоприятно на телесното затлъстяване и подобрява характеристиките на метаболитния синдром при хората (2,3,4,5,6). Въпреки че проучванията за оценка на ефикасността и метаболитните ефекти на KD са се увеличили през последните години, ефектите от контролираните с макронутриенти диети остават противоречиви в литературата.
Инсулинът има мощни краткосрочни и дългосрочни ефекти върху приема на енергия и хомеостазата на глюкозата. В краткосрочен план освобождаването на инсулин е главно; мозъкът инициира секрецията на инсулин, като насочва съобщения през блуждаещите нерви към панкреаса, за разлика от директната панкреатична стимулация на клетките, секретиращи инсулин. Цефаловият инсулин се наблюдава най-лесно в началото на храненето и се състои от кратък прилив на инсулин, който е абсорбиращ по отношение на погълнатата храна. След консумация на храна, секрецията на инсулин се увеличава и се поддържа, тъй като една от ролите на инсулина е да подготви тялото за увеличаване на глюкозата, съпътстващо приема на храна, и да контролира повишените нива и употребата на глюкоза (7). В дългосрочен план ролята на инсулина като сигнал за затлъстяване е добре известна, с повишени нива на инсулин в плазмата в резултат на повишено телесно тегло. Заедно краткосрочните и дългосрочните ефекти на инсулина позволяват правилната хомеостаза на глюкозата и подпомагат регулирането на телесното тегло.
Способността на инсулина да регулира нивата на кръвната глюкоза може да бъде променена от съдържанието на макроелементи в обичайната диета. Когато консумират диета с високо съдържание на мазнини, хората развиват повишени нива на инсулин в плазмата, което в крайна сметка води до инсулинова резистентност и невъзможност за поддържане на глюкозната хомеостаза. Въпреки това, диета с високо съдържание на мазнини, която също е с ниско съдържание на въглехидрати, а именно KD, често се използва за отслабване и за контрол на симптомите на диабет тип 2 в човешката популация (8,9,10). Понастоящем не е известно дали ефектите на KD върху хомеостазата на глюкозата са резултат от загуба на тегло, свързано с употребата на KD, или резултат от сериозно ограничаване на приема на диетични въглехидрати.
И накрая, инсулинът в централната нервна система има известна роля в енергийната хомеостаза. Инсулиновите рецептори са концентрирани в области на мозъка, критично участващи в контрола на приема на храна, включително ядрото на хипоталамуса, а приложението на инсулин в мозъка предизвиква дозозависимо намаляване на приема на храна и загуба на телесно тегло (за преглед вж. Ref 7). Поради това оценихме реакцията на интрацеребровентрикуларен (icv) инсулин, както и нивата на експресия на иРНК рецепторни иРНК в хипоталамуса.
Материали и методи
Животни и диети
За всички проучвания мъжките плъхове Long Evans (Harlan, Indianapolis, IN) с тегло 200–225 g, са били поместени индивидуално в окачени телени клетки от неръждаема стомана и поддържани при постоянна температура (25 C) на 12-часова светлина, 12-h тъмен цикъл (светва в 0400 ч). Плъховете бяха на възраст 8 седмици при пристигането си в лабораторията. След 1 седмица аклиматизация в лабораторията, по време на която беше разрешен достъп ad libitum до гризач за гризачи (Harlan Teklad 2018), плъховете бяха съпоставени по тегло и разделени на две групи. Едната група поддържаше ad libitum достъп до чау, а другата беше поставена върху KD, от която 5% от калориите бяха получени от въглехидрати, 80% от мазнини и 15% от протеини (Research Diets D06040601, 6,1 kcal/g; Research Diets Inc., New Brunswick, NJ). Източниците на мазнини в KD са соево масло и свинска мас, така че диетата е съставена от наситени и ненаситени мастни киселини с дълга верига. Калоричният прием и телесното тегло се измерват и записват ежедневно. Всички експерименти започнаха веднага след осмата седмица на поддържане на диетата. В съответствие с предишни доклади (12,20), приемът на калории и телесното тегло не се различават между диетичните групи. Всички процедури бяха одобрени от Комитета за грижа и употреба на животните в университета Purdue.
Експеримент 1: ефекти на ip инсулина върху приема на храна от плъхове, поддържани върху KD
Плъховете (chow, n = 9; или KD, n = 11), получават ip инсулин, за да определят ефекта от диетата върху отговорите на екзогенен инсулин. Инжекциите се уравновесяват и всеки плъх получава инжекция с физиологичен разтвор или инсулин (говежди; Sigma-Aldrich, Сейнт Луис, Мисури) в един от двата инжекционни дни, разделени от 5 дни. За инжекции храната се отстранява 2 часа преди изгасването на светлините. Деветдесет минути по-късно на всеки плъх се инжектира ip с 1 ml физиологичен разтвор или инсулин (1,0 U/kg телесно тегло). Тази доза е избрана въз основа на предишни изследвания, показващи, че 1,0 U/kg телесно тегло ефективно намалява кръвната захар при възрастни мъжки плъхове (21). При изключено осветление на всеки плъх се дава претеглено количество храна, като приемът на храна се измерва 1, 2, 4 и 24 часа след инжектирането. Под всяка клетка бяха поставени хартии, за да се събере разливът, и изчисленията на приема бяха коригирани съответно.
Експеримент 2: ефекти на поддържането върху KD върху глюкозния толеранс
Тестове за интраперитонеална толерантност към глюкоза (IPGTT) бяха проведени след 8 седмици консумация на чау или KD (чау, n = 12; или KD, n = 9). Храната се отстранява 16 часа преди началото на IPGTT, а телесното тегло след лишаване от храна се използва за изчисляване на дозите глюкоза (1,5 g глюкоза/kg телесно тегло). Кръвта се събира чрез опашка бързо, за да се сведе до минимум стресът на животното (22,23) преди инжектиране на глюкоза. След инжектиране на глюкоза се вземат кръвни проби на 15, 30, 45, 60 и 120 минути. Глюкозата се определя чрез дублиран анализ с Precision Xtra Glucose Monitoring System (Abbott Laboratories, Abbott, IL). Остатъкът от кръвната проба беше поставен върху лед. След събирането на всички проби, всяка се центрофугира при 2000 rpm в продължение на 15 минути при 4 С. Плазмата се събира за анализ на концентрацията на инсулин чрез ултрачувствителен инсулин ELISA от плъх (Crystal Chem Inc., Downers Grove, IL).
Тест за толерантност към ip инсулин (IPITT) беше извършен при отделна група плъхове (chow, n = 8; KD, n = 8), които получиха 1 U/kg телесно тегло инсулин ip. Храната беше премахната 16 часа преди началото на IPITT и за изчисляване на дозите инсулин бяха използвани телесни тегла след лишаване от храна. Кръвта беше взета през опашката на същите интервали като за IPGTT и нивата на глюкоза и инсулин бяха определени, както е описано по-горе.
Експеримент 3: поддържане на KD и нива на инсулин и глюкоза, предизвикани от храненето
Плъховете, поддържани на чау (n = 12), получиха достъп до Ensure с вкус на ванилия (67,6% въглехидрати) на три отделни тренировъчни сесии преди тестване, а плъховете KD (n = 12) получиха достъп до нисковъглехидратни, с вкус на ванилия Аткинс се разклаща (7,7% въглехидрати) в три отделни тренировки, при които храната и водата се отстраняват 3 часа преди началото на тъмния цикъл и предварително претеглена бутилка с хранителната добавка се поставя върху клетката при изключване на осветлението. Достъпът беше разрешен за 1 час. За тестване, същата процедура беше последвана с добавяне на вземане на кръв. Кръвта е взета през опашната вена непосредствено преди получаване на достъп до хранителната добавка (изходно ниво) и след това 15 и 30 минути и 1 и 2 часа след първото облизване. Кръвната глюкоза се измерва в два екземпляра по всяко време и останалата проба се поставя върху лед за времето на теста. Пробите бяха третирани, както е описано в експеримент 2 и по-късно анализирани за нива на инсулин. Хранителната добавка се претегля след 1 час, като по това време тя се изважда от клетката. Храната и водата бяха заменени след 2-часовото вземане на кръв.
Една седмица по-късно KD плъховете получиха достъп до Ensure с вкус на ванилия, за да определят ефектите от консумацията на високо въглехидратна хранителна добавка след продължителна поддръжка на KD. Плъховете получиха достъп до гаранцията с вкус на ванилия и се събира кръв, както е описано по-горе. Глюкозата в кръвта се определя чрез дублиран анализ и плазменият инсулин се измерва чрез ултрачувствителен ELISA инсулин от плъх.
Експеримент 4: преминаване от KD към чау - реакция към инсулин и ефекти върху глюкозния толеранс
Плъховете се поддържат на чау (n = 8) или KD (n = 7) в продължение на 8 седмици, след което KD се отстранява от плъховете KD и се заменя с чау (група KD/чау). Пет дни по-късно на плъховете се дава периферен инсулин, за да се определи ефектът от диетата върху отговорите на екзогенен инсулин, както в експеримент 1. Всеки плъх получава физиологичен разтвор или инсулин в един от двата инжекционни дни, както е описано в експеримент 1 (1,0 U/kg тяло тегло).
За да се определи дали преминаването от KD към чау повлиява толерантността към глюкозата, допълнителна група плъхове се поддържа на чау или KD в продължение на 8 седмици, след което KD се заменя с чау. Една седмица по-късно се изследва глюкозният толеранс, както е описано в експеримент 2 по-горе.
Експеримент 5: ефект на icv инсулин
Плъховете се поддържат на чау или KD в продължение на 8 седмици и след това всеки е стереотаксично имплантиран с канюла в страничната церебрална камера (icv), както е описано по-рано (24). Накратко, плъховете се упояват с 1 ml/kg 4: 3 смес от кетамин (100 mg/ml) и ксилазин (20 mg/ml) и се поставят в стереотаксичен инструмент. Вкара се 23-габаритна направляваща канюла (10 mm дължина) 1,8 mm отзад на брегма, 1,6 mm странично до средната линия (с брегма и ламбда в една и съща вертикална координата) и 3,3 mm вентрално към твърдата мозъчна обвивка. Поставянето на канюла беше проверено чрез тестване на ангиотензин II. Плъховете се инжектират icv с 5 nmol ангиотензин II, след което се измерва приемът на вода. Всички са изпили поне 5 ml повече, отколкото са пили след инжектиране на физиологичен разтвор (за 30 минути) и следователно се счита, че имат правилно поставяне на канюла.
Една седмица след възстановяване на предхирургичното телесно тегло, плъховете претърпяха поредица инжекции с icv, за да определят ефективността на инсулина за намаляване на калорийния прием при плъхове, поддържани на чау или KD. Използван е дизайн на субекти, така че плъховете са получавали icv инжекции с физиологичен разтвор или инсулин (6 и 9 mU в 2 μl физиологичен разтвор). Дозите са избрани въз основа на проучвания, при които 8 mU е надеждно показано, че намалява приема на храна (25, 26), а 6 и 9 mU са тествани, за да се определи дали плъховете с KD са имали повишена чувствителност към аноректичните ефекти на централно администрирания инсулин. Всеки плъх получава физиологичен разтвор и двете дози инсулин, с не по-малко от 5 дни между инжекциите, в балансирана последователност. В тестовите дни храната се отстранява 1 час преди инжектирането. Плъховете се инжектират 30 минути преди началото на тъмния цикъл, по това време храната се подменя в клетката. Приемът беше измерен 1, 2, 4 и 24 часа по-късно.
Експеримент 6: ефекти от хроничното поглъщане на KD върху експресията на инсулиновия рецептор в хипоталамуса
Допълнителна кохорта от плъхове се поддържа на chow (n = 8) или KD (n = 8) в продължение на 8 седмици и след това се убива за измерване на експресията на mRNA на инсулиновия рецептор в хипоталамуса. В деня на убиването храната се отстранява за 6 часа и плъховете се убиват 2 часа преди началото на тъмния цикъл. Плъховете бяха бързо обезглавени под етерна инхалационна анестезия и мозъците бяха отстранени и поставени в RNAlater (Ambion, Austin, TX) за последващ анализ на експресията на инсулиновия рецептор в хипоталамуса чрез количествена RT-PCR (Q-PCR).
За Q-PCR целият хипоталамус на всеки плъх се дисектира от мозъка и се хомогенизира в 1 ml реактив Trizol (Invitrogen, Carlsbad, CA). След центрофугиране на тази смес, РНК се възстановява от водната фаза чрез утаяване с изопропанол. След това всяка замърсяваща геномна ДНК се отстранява чрез обработка с реагенти за третиране и отстраняване на дезоксирибонуклеаза без ДНК (Applied Biosystems/Ambion, Austin, TX). cDNA се синтезира от 5 μg РНК, като се използва система за синтез на първа верига SuperScript III (Invitrogen, Карлсбад, Калифорния) за RT-PCR и се разрежда 1: 3 в вода без нуклеаза за съхранение при -20 ° С.
Всеки набор от праймери е оптимизиран така, че коефициентът на корелация да е 0,99–1,0, а ефективността на PCR е 90–100%. Целостта на сДНК е потвърдена чрез конвенционално RT-PCR усилване на L32, домакински ген. Проведена е и контролна реакция за всяка РНК проба без добавен ензим за обратна транскриптаза. Q-PCR се извършва в два екземпляра, използвайки iCycler и iQ SYBR Green Supermix (Bio-Rad, Hercules, CA) с двустепенно усилване (95 ° С за 10 секунди и 60 ° С за 45 секунди) за 40 цикъла. L32 се амплифицира от всяка проба за използване като ендогенен контрол.
статистически анализи
Ефектите на ip и icv инсулин върху приема на калории се оценяват чрез повторни измервания ANOVA и се използва тест Bonferroni за post hoc анализ. Всички данни за глюкозата и инсулина са анализирани чрез двупосочен ANOVA с повторни измервания и тестове на Bonferroni за post hoc анализи. Площта под кривата беше анализирана с помощта на t тест. Всички статистически данни са извършени с помощта на статистически софтуер Prism и значимостта е зададена на P sem .
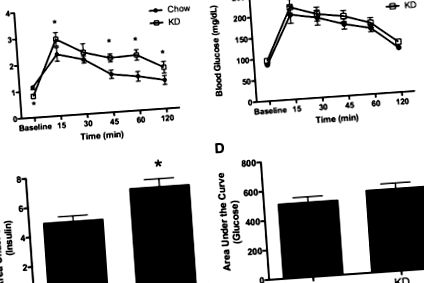
За Q-PCR анализи се изчислява приблизителната кратна разлика, 2 ΔΔCT (27). За INSR, стойностите на chow бяха сравнени със стойностите на KD чрез t тест на Student. Стойността на P 1A, краткосрочен прием на калории е значително увеличена и при двете групи плъхове след ip приложение на инсулин. Четири часа след инжектирането, средният калориен прием от плъхове от чау е 18,9 ± 1,4 kcal в отговор на физиологичен разтвор и 27,7 ± 2,9 kcal след ip инсулин (P 1B). ). Сравнението на стимулираната от инсулина промяна в приема на калории разкрива значително по-голяма промяна в приема на чау след инсулин и в сравнение с промяната в приема на калории, предизвикана при плъхове KD (P sem. *, P 2A, P 2B)) е значително по-голяма при KD плъхове от контролите (P 2C). ). AUC на глюкозата (фиг. 2D 2D)) не се различава между диетичните групи.
Инсулин и глюкоза след IPGTT. A и B, измерва се плазмен инсулин (A) и се изчислява AUC за инсулин (B) в отговор на ip приложение на глюкоза; Получени са също C и D, кръвна глюкоза (C) и AUC за кръвна глюкоза (D) след ip инсулин. Данните са представени като средно ± sem. *, P 3A, глюкозата е значително намалена при плъхове, хранени с чау 15 минути след ip инжектиране на инсулин и остава потисната през останалата част от 120-минутния период на тестване, в сравнение с изходното ниво. За разлика от това, глюкозата не е била намалена от изходното ниво при плъхове с KD 15 минути след приложението на инсулин. Глюкозата е значително по-ниска при KD плъхове 30–120 минути след инжектиране (P 3B)) показва значително по-голяма площ за KD плъхове след IPITT, демонстрирайки по-малко индуцирана от инсулина хипогликемия.
Калоричен прием след преминаване от KD към чау и в отговор на ip инсулин. Плъховете бяха превключени от KD в чау и им беше даден ip инсулин. Калоричният прием е измерен 4 h (A) и 24 h (B) по-късно. Данните са представени като среден кумулативен калориен прием ± sem. *, P sem .
Отговорност към централния инсулин и експресия на mRNA на инсулиновия рецептор в хипоталамуса
- Диетата с нисък гликемичен индекс може да подобри инсулиновата чувствителност при деца със затлъстяване Педиатрични изследвания
- Влияние на диета с високо съдържание на мазнини и ниско съдържание на въглехидрати върху окисляването на миокарден субстрат, чувствителност към инсулин,
- Как да проследявате резултатите от кетогенната диета - Перфектното кето
- Как да използваме кетогенната диета за подобряване на телесния състав - InBody USA
- Колко мазнини в кетогенна диета Блог KetoDiet