Резюме
Анемията при пациенти с рак е доста често срещана, със забележителни отрицателни въздействия върху качеството на живот и цялостната прогноза. Патогенезата е сложна и обикновено е многофакторна, като дефицитът на желязо (ID) често е основен и потенциално лечим фактор. На свой ред, ИД при пациенти с рак може да се дължи на множество съвпадащи механизми, включително кървене (напр. При рак на стомашно-чревния тракт или след операция), недохранване, лекарства и хепцидиново задвижване на желязото в макрофаги с последваща еритропоеза с ограничено желязо. Всъщност може да възникне или абсолютен, или функционален дефицит на желязо (AID или FID). Докато за абсолютната идентификация има общ консенсус относно лабораторната дефиниция (това са нивата на феритин. Ключови думи: дефицит на желязо, анемия, рак, хепцидин, управление на кръвта на пациента
1. Анемия при рак: Разпространение, патофизиология и прогностично въздействие
Анемията е често срещано и потенциално вредно усложнение при пациенти с рак, което компрометира качеството и продължителността на живота. Бързото разпознаване и управление се свързват с подобряване на клиничните резултати, благоприятствайки също така по-добра толерантност и отговор на противотуморна терапия.
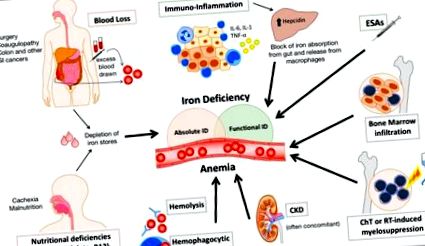
Схематична илюстрация на основните механизми, допринасящи за анемия и дефицит на желязо при пациенти с рак. Загубите на кръв поради растеж на тумора (особено при рак на стомашно-чревния тракт) или след операция, вероятно благоприятна от съпътстваща коагулопатия, и неадекватен прием на желязо поради кахексия и недохранване водят до абсолютен дефицит на желязо (ID). Възпалението увеличава синтеза на хепцидин в черния дроб, което води до функционална идентификация. Лечението със стимулиращи еритропоезата средства може да допринесе за функционалната идентификация, определяйки несъответствие между нуждата от желязо за еритропоеза и доставката на желязо от магазините. Други фактори, като инфилтрация на костен мозък от туморни клетки, миелосупресия, причинена от химио- или радиотерапия и съпътстващо хронично бъбречно заболяване (ХБН), често допринасят за развитието на анемия при пациенти с рак.
Раковата анемия може да бъде свързана с широк спектър от симптоми, в зависимост от тежестта и бързината на развитие. Умората е най-изтощителният симптом [8,9], последван от нарушен умствен капацитет, объркване и депресия, особено при възрастни хора. Може да се появят и гадене, загуба на апетит, диспнея, синкоп и падания, особено при пациенти със съпътстващи заболявания като кардио-белодробни и бъбречни дисфункции. Трябва да се отбележи, че намаляването на качеството на живот (QoL) е особено очевидно, когато Hb спадне между 11,5 и 10 g/dL, което класически се счита за лека анемия и не се възприема като проблем от повечето лекари [10]. Не рядко симптомите, свързани с анемия, представляват първия алармен признак за окултна неоплазма, тъй като тя се наблюдава класически при пациенти с рак на дебелото черво.
Анемията е призната за независим предиктор за лоша прогноза при пациенти с рак. В цялостен систематичен преглед на 60 проучвания, оценяващи преживяемостта, се наблюдава 65% общо увеличение на риска от смъртност при пациенти с рак с анемия в сравнение с тези без анемия. Това варира от 19% при пациенти с белодробна неоплазия до близо 75% при пациенти с карцином на главата и шията или лимфом [11]. Въздействието на анемията върху оцеляването е свързано със закъснение при започване или неуспешно завършване на режимите на ChT. По-лош отговор на противораково лечение също е установен, тъй като цитотоксичността, предизвикана от лъчетерапия (RT) и някои ChT агенти изискват адекватни нива на кислород в тъканите. Освен това, намаляването на кислородния (O2) транспортния капацитет на кръвта може да улесни интратуморна хипоксия, с активиране на индуцируеми фактори на хипоксия (HIFs). В действителност HIF се считат за главни регулатори на прогресията на рака [12,13,14,15] чрез повишаване на регулацията на целевите гени, участващи в ангиогенезата, имунното избягване и метаболитното препрограмиране на раковите клетки [16], което ги прави устойчиви на ChT и RT [17,18].
Предвид въздействието на анемията върху QoL, прогресирането на заболяването и оцеляването при пациенти с рак, адекватните стратегии за лечение изглеждат от първостепенно значение. Няколко проучвания показват, че лечението на ракова анемия определя значително подобрение на QoL [19], особено при пациенти с лека до умерена анемия. Той може също така да има потенциала да подобри поносимостта и ефикасността на противораковото лечение, с възможно въздействие върху прогнозата [9,20,21].
2. Преливане на кръв и стимулиращи еритропоезата агенти: нож с две остриета
Като се имат предвид потенциалните рискове, свързани с използването на кръвопреливане и ESA, както и нарастващите познания по отношение на патофизиологията на желязото и неговото значение при раковата анемия, IV приложението на желязо представлява обещаващ, потенциално ценен терапевтичен подход.
- Анемия; Дефицит на желязо - Детски плюс педиатрия
- Анемия и дефицит на желязо - често срещан проблем Анемичен ли съм
- 4 съвета за приемане на добавки с желязо при анемия
- Анемия, причинена от ниско съдържание на желязо - деца Медицинска енциклопедия MedlinePlus
- Анемия Бъдете наясно с този риск, свързан с рака, Център за рак на Fox Chase - Филаделфия, Пенсилвания