Кореспонденция на: професор Cai-Fang Xue или д-р Jun Liu, катедра по етиология, Четвърти военномедицински университет, Xi’an 710032, провинция Shaanxi, Китай. nc.ude.ummf@ygoloite
Телефон: + 86-029-3374536 Факс: + 86-029-3374594
Резюме
ЦЕЛ: Да се подготви и пречисти TAT-HBV целенасочен рибонуклеазен слят протеин, да се оцени неговата трансдукционна активност и да се изследва ефекта му върху репликацията на HBV в 2.2.15 клетки.
МЕТОДИ: Прокариотният експресионен вектор pTAT, съдържащ TR ген, се използва за трансформиране на E.coli BL21 (DE3) LysS и TR се експресира с индукция на IPTG. TAT-TR слетият протеин се пречиства, използвайки Ni-NTA-агроза и PD-10 обезсоляващи колони, и се анализира чрез SDS-PAGE. Ефективността на трансдукция на TAT-TR се открива с имунофлуоресцентен анализ и концентрацията на HBeAg в супернатанта на 2.2.15 клетките се определя чрез твърдофазен радиоимуноанализ (spRIA). МТТ анализът е използван за откриване на цитотоксичността на TAT-TR.
РЕЗУЛТАТИ: SDS-PAGE показа, че сливаният протеин TAT-TR се пречиства успешно и чистотата на TAT-TR е 90%. Визуализирането на TAT-TR чрез имунофлуоресцентен анализ показва неговата висока ефективност при трансдуциране на 2.2.15 клетки. Резултатът от RIA предполага, че TAT-TR може ефективно да инхибира репликацията на HBV, не влияе върху растежа на клетките и няма цитотоксичност.
ЗАКЛЮЧЕНИЕ: TAT-TR притежава значителна анти-HBV активност и приготвянето на TAT-TR слят протеин постави основата за използването на TR в терапевтичното изпитване на HBV инфекция.
ВЪВЕДЕНИЕ
Въвеждането на протеини в клетките на бозайници е постигнато чрез трансфекция на експресионни вектори, микроинжекция или инфекциозен вирус и др. Въпреки че тези подходи са донякъде успешни, класическите методи за манипулация не се регулират лесно и могат да бъдат трудни. Един от подходите за решаване на тези проблеми е използването на PTD-медиирана протеинова трансдукция [1,2]. Свързан ковалентно с протеини, пептиди, нуклеинови киселини или като сливания в рамка с протеини с пълна дължина, PTD ще им позволи да влязат във всеки клетъчен тип по независим от рецептора и транспортера начин [3]. HIV-TAT е член на домейни за трансдукция на протеини и изглежда притежава високо ниво на ефективност на трансдукция на протеини [4,5]. Показано е, че TAT слетите протеини трансдуцират във всички клетки и тъкани, присъстващи при мишки [6], включително тези, присъстващи през кръвно-мозъчната бариера [7,8]. И много, ако не и повечето, протеини могат да бъдат трансдуцирани в клетки с помощта на тази технология. Следователно TAT PTD може да ни позволи да адресираме нови въпроси в предклиничната изследователска работа и дори да помогнем при лечението на човешки заболявания.
Хепатит В е основен световен здравен проблем [9-13]. Хроничната инфекция е свързана с висок риск от чернодробна цироза и първичен карцином на черния дроб [14-22]. Наличните в момента терапии са с ограничена ефективност [23-35]. HBV насочен ген на рибонуклеаза (TR), синтезен ген на HBVc и hEDN, е конструиран от Liu et al [36] в нашата лаборатория, според теорията за насочена към капсиди вирусна инактивация (CTVI), която е обещаваща стратегия в анти- вирусни изследвания. HBVc се използва като целевата молекула, която е структурен протеин на HBV и е незаменима по време на опаковането на HBV частици. Ефекторната молекула е hEDN, вид човешка рибонуклеаза, която може да разгради pgRNA на HBV. Трансфекцията на 2.2.15 клетки с еукариотния експресионен вектор, носещ TR ген, предполага, че TR инхибира значително репликацията на HBV [37]. Следователно, свързването на HIV-TAT с TR би ни осигурило по-ефективен подход за доставяне на TR в хепатоцитите и значително ще ни помогне да използваме TR при лечението на HBV инфекция. Тук са докладвани пречистването на TAT-TR слетия протеин, идентифицирането на неговата трансдукция и анти-HBV ефекта върху 2.2.15 клетките. За да потвърдим неговия анти-HBV механизъм, ние също подготвихме и пречистихме TAT-TRmut, TAT-hEDN и TAT-HBVc протеини за използване като отрицателни контроли.
МАТЕРИАЛИ И МЕТОДИ
Материали
Ni-NTA-агрозата е закупена от Qiagen Company. Обезсоляващи колони PD-10 са закупени от Amersham Pharmacia Biotech. Анти-неговият mAb беше от компанията Santa Cruz. Маркерите за молекулна маса на протеини, IPTG и G418, имидазол и MTT, са от Sino-American Biotech. Комплектът за анализ на RIA HBVeAg е закупен от Института по биотехнологии Beimian Dongya. 2.2.15 клетки беше любезен подарък на проф. Ченг, 302 болница на китайския PLA. hEDN се пречиства от Li et al [36]. pTAT-HA/TR, TAT-HA/TRmut, pTAT-HA/hEDN и pTAT-HA/HBVc бяха приготвени в нашата лаборатория [38]. PET-30a/TR, PET-30a/TRmut, PET-30a/HBVc и E.coli BL21 (DE3) LysS бяха поддържани в нашата лаборатория.
Методи
Експресия и пречистване на TAT слети протеини pTAT-HA/TR, TAT-HA/TRmut, pTAT-HA/hEDN, pTAT-HA/HBVc и pTAT-HA бяха използвани за трансформиране на E.coli BL21 (DE3) LysS чрез използване на CaCl2 перфорация. Трансформантите се култивират поотделно в 3 mL TB amp (100 μg/L) при 37 ° С за една нощ. 100 μL култура се инокулира в 10 ml свеж TB усилвател и се инкубира до 4 часа при 37 ° С. След това IPTG се добавя към всяка епруветка до крайна концентрация от 100 μmol/L и културата се инкубира за допълнителни 4 часа. Индуцираните клетки се събират чрез центрофугиране и клетъчните лизати се анализират чрез 120 g/L SDS-PAGE. Неговите маркирани слети протеини се пречистват чрез използване на Ni-NTA-агроза и PD-10 обезсоляващи колони, съгласно препоръките на производителя (Qiagen и Amersham Pharmacia). Пречистените протеини се анализират чрез 120 g/L SDS-PAGE.
Експресия и пречистване на протеини без TAT PTD PET-30a/TR, pET-30a/TRmut и pET-30a/HBVc трансформират E.coli BL21 (DE3) LysS. След анализа на нивата на експресия, трите протеина се пречистват по същия начин, както и за TAT слетите протеини.
Култура от 2.2.15 клетки Клетките се култивират в DMEM, съдържащ 150 ml/L фетален говежди серум при 37 ° C в 50 ml/L CO2 и 100 mg/L G418.
Идентифициране на TAT трансдукция на слет протеин 2.2.15 клетки (2 × 10 8/L) се поставят в 6-ямкови плаки с покривни кораби и се оставят да залепнат за 24 часа. TAT-TR, TAT-TRmut, TAT-hEDN, TAT-HBVc, TR, TRmut, hEDN и HBVc бяха добавени в ямките, съответно, с крайна концентрация 100 nmol/L. Инкубирани в продължение на 30 минути при 37 ° С, всички клетки веднага се измиват със стерилен PBS (рН 8,0), фиксират се в 20 g/L параформалдехид и 1 g/L TritonX-100, разреден в PBS и се поставят върху лед за 30 минути. Клетките се промиват три пъти със студен PBS. Неспецифичните епитопи бяха блокирани чрез използване на 10 g/L BSA за 10 минути при 42 ° C. Клетките бяха промити три пъти със студен PBS и след това инкубирани с миши анти-His mAb (1: 500) в продължение на 15 минути при 42 ° C . След трикратно измиване в студен PBS, заешкият антимиши IgG, белязан с FITC (1: 1000), се добавя към всяка ямка и се инкубира в продължение на 10 минути при 42 ° С. Изплаква се с PBS в продължение на 1 час и покриващите кораби се монтират на предметни стъкла с използване на 500 ml/L глицерол. Клетките се наблюдават чрез флуоресцентна микроскопия.
Определяне на анти-HBV ефект на TAT-TR 2.2.15 клетки се посяват с плътност 2 × 10 8/L в 12-ямкови плаки. TAT-TR, TAT-TRmut, TAT-hEDN и TAT-HBVc бяха добавени в ямките, съответно, при крайна концентрация от 100 nmol/L. 20 μL DMEM бяха добавени в ямките като фалшива група. За всяка група бяха зададени четири паралела. 24 часа по-късно HBVeAg в супернатанта се определя чрез използване на spRIA комплект, както е описано от производителя.
MTT анализ 2.2.15 клетки се посяват при плътност 2 × 10 8/L в 96-ямкови плаки. След 24 часа TAT-TR, TAT-TRmut, TAT-HEDN, TAT-HBVc се добавят в (A), (B), (C), (D) групи при крайна концентрация от 100 nmol/L. 20 μL DMEM се добавят в ямка (Е). 72 часа по-късно, морфологията на клетките се наблюдава чрез обърната микроскопия и МТТ се прилага във всяка ямка при крайна концентрация 5 g/L. След още 4 часа култивиране, 150 μL DMSO се добавя във всички ямки и се открива абсорбцията на светлина при A490.
Статистически анализ
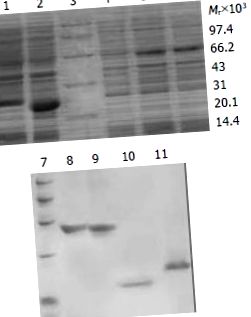
Всички получени данни са обработени от софтуера SPSS. P (Фигура 1). 1). Степента на чистота на слетите протеини е съответно 90%, 88%, 80% и 85%.
SDS-PAGE анализ на експресия и пречистване за TAT слети протеини. 1: Трансформиран от pTAT-HA/HBVc; 2: Трансформиран от pTAT-HA/hEDN; 3: Протеинов маркер; 4: Трансформиран от pTAT-HA; 5: Трансформиран от pTAT-HA/TR; 6: Трансформиран от pTAT-HA/TRmut; 7: Протеинов маркер; 8: Пречистен TAT-TN; 9: Пречистен TAT-TNmut; 10: Пречистен TAT-hEDN; 11. Пречистен TAT-HBVc.
Експресия и пречистване на протеини без TAT PTD
По подобен начин pET-30a/TR, pET-30a/TRmut и pET-30a/HBVc са индуцирани да експресират протеини без TAT PTD чрез IPTG в BL21 (DE3) LysS и те произвеждат протеини с предвидени молекулни маси (Фигура (Фигура 2). 2). След това протеините се пречистват чрез използване на Ni-NTA афинитетни колони и PD-10 обезсоляващи колони. Степента на чистота на слетите протеини е съответно 88%, 76% и 81%.
SDS-PAGE анализ на пречистени контролни протеини. 1: Протеинов маркер; 2: Пречистен HBVc; 3: Продукт на експресия на BL21, трансформиран от pET30-a/HBVc; 4: Продукт на експресия на BL21, трансформиран от pET30-a; 5: Експресионен продукт на BL21, трансформиран от pET30-a/TR; 6. Продукт на експресия на BL21, трансформиран от pET30-a/TRmut; 7: Пречистен TR; 8: Пречистен TRmut.
Идентифициране на трансдукция на протеини
Да се оцени способността за трансдукция на слетите протеини при преминаване през мембраната на 2.2.15 клетки. TAT-TR, TAT-TR mut, TAT-hEDN и TAT-HBVc се добавят в културалната среда при крайна концентрация 100 nmol/L. TR, TRmut, hEDN и HBVc без TAT PTD бяха използвани като отрицателни контроли. Под флуоресцентния микроскоп може да се види обилна флуоресценция в цитоплазмата на клетките, трансдуцирани с TAT слети протеини, но не може да се открие флуоресценция в контролните клетки (Фигура (Фигура 3). 3). Този резултат ясно подсказва, че TAT слетите протеини могат да преминат през мембраната на 2.2.15 клетки с висока ефективност.
Откриване на трансдукцията на TAT слети протеини в 2.2.15 клетки. A: Добавено с TAT-TR; B: Добавено с TAT-hEDN; C: Добавено с TAT-HBVc; D: Добавено с TAT-TRmut; a: Добавено с TR; b: Добавено с hEDN; c: Добавено с HBVc; d: Добавено с TRmut.
Анализ на анти-HBV активност за TAT-TR
Статистическият анализ със софтуера SPSS показа, че средната концентрация на HBeAg в групата TAT-TR намалява значително в сравнение с контролните групи (Средната разлика е значителна на ниво 0,05). В допълнение, няма значителна разлика между средната концентрация на контролните групи (P> 0,05). Концентрацията на HBeAg в групата TAT-TR намалява с 60,3% (Фигура (Фигура 4 4).
Сравнение на концентрацията на HBeAg между различните групи.
MTT анализ
След 72 h култура, морфологията на клетките се наблюдава под обърнат микроскоп и се установява, че няма забележима разлика между четирите експериментални групи и контрола DMEM. MTT анализът не показа значителна разлика между петте групи. Техните стойности на абсорбция A490 (¯x ± s, n = 4) са съответно 0,4875 ± 0,018, 0,4675 ± 0,022, 0,4690 ± 0,028, 0,4800 ± 0,029 и 0,4855 ± 0,050 (P> 0,05).
ДИСКУСИЯ
- Състав на тялото при деца с ювенилен идиопатичен артрит ефект на диетичен прием на
- Ефект за отслабване на тялото
- Всички групи за отслабване в света се затвориха с незабавен ефект след най-новите съвети за коронавирус -
- Всички групи за отслабване в света се затвориха с незабавен ефект след най-новите съвети за коронавирус -
- Ползи и страничен ефект на кафе с мед за отслабване