Крис Рундфелдт
1 Drug-Consult.Net, Toepfferspark 2a, 39108 Магдебург, Германия
Катажина Соцала
2 Катедра по физиология на животните, Институт по биология, Университет Мария Кюри-Склодовска, Академика 19, 20-033 Люблин, Полша
Piotr Wlaź
2 Катедра по физиология на животните, Институт по биология, Университет Мария Кюри-Склодовска, Академика 19, 20-033 Люблин, Полша
Резюме
Въведение
Докато някои 2,3-BDZ и отчасти също тофизопам са показали, че индуцират антипсихотични ефекти при класически модели на психоза при животни, свързани с положителните симптоми на заболяването, т.е. в теста за катерене на апоморфин, реакцията на условно избягване и— в по-малка степен - при теста за каталепсия, фармакологичният профил и профилът на страничните ефекти на тофизопама при човека се различава от класическите антипсихотици (Horváth et al. 2000). Поради докладваната лека стимулаторна активност (Szegő et al. 1993), която е за разлика от активността на класическите антипсихотици, ние се интересувахме дали тофисопам може да бъде активен в модел на негативни симптоми на психоза, който имитира състоянието на склонност. Съответният модел е описан от Noda et al. (1995).
Поради интересния фармакологичен профил на тофисопам, ние също се интересувахме да научим повече за механизма на действие. Ранните проучвания за свързване идентифицират специфично и изключително свързване на 2,3-BDZ в рамките на стриатума и свързаните с него структури (Horváth et al. 2000). Сайтът за свързване беше наречен girisopam свързващ сайт, тъй като бе установено, че това 2,3-BDZ производно има най-висок афинитет. Разпределението на това предложено място на свързване се припокрива до голяма степен с разпределението на фосфодиестераза 10 изоензима (PDE-10), което е силно и селективно изразено в стриатум (Seeger et al. 2003). Освен това се обсъжда, че PDE-10 инхибиторите са интересни цели за антипсихотични агенти (Siuciak et al. 2006). Horváth и сътр. (2000) предлагат, че механизмът на действие на тофисопама може да бъде свързан с промяна във фосфорилирането на протеина (ите). Докато инхибирането на фосфодиестеразата не води пряко до протеиново фосфорилиране, вторите посланици - цикличен аденозин монофосфат (cAMP) или цикличен гуанозин монофосфат (cGMP) - които се разцепват от фосфодиестерази, могат да активират протеинкинази, водещи до повишено протеиново фосфорилиране. Поради тези причини ние проверихме различни PDE изоензими, включително PDE-10, за специфично взаимодействие с тофизопам.
Материали и методи
Екран на фосфодиестераза
Животни
Експериментите с животни са проведени върху общо 49 мъжки мишки Albino Swiss с тегло 25–30 g, закупени от лицензирания животновъд (Laboratory Animals Breeding, Górzkowska, Варшава, Полша). Те бяха използвани в това проучване след най-малко 1 седмица аклиматизация. Животните бяха настанени в поликарбонатни клетки на групи от 6–10 при строго контролирани лабораторни условия (околна температура 22–23 ° C, относителна влажност около 45–55%, цикъл 12/12 светлина/тъмнина, светлина в 6:00 h; пелети с чау и вода от чешмата са постоянно на разположение). Експерименталният протокол беше одобрен от Местната комисия по етика в Медицинския университет в Люблин (лиценз № 18/2007) и всички процедури бяха в строго съответствие с Директивата на Съвета на Европейските общности от 24 ноември 1986 г. (86/609/ЕИО).
Наркотици
Тофисопам [1- (3,4-диметоксифенил) -5-етил-7,8-диметокси-4-метил-5Н-2,3-бензодиазепин, рацемична смес, любезно предоставена от EGIS Pharmaceuticals PLC (Будапеща, Унгария)], е прясно суспендиран в 0,5% воден разтвор на метил целулоза (Sigma, Сейнт Луис, МО, САЩ) и се прилага интраперитонеално (ip) при обем от 5 ml/kg. Дизоцилпин [(+) - 5-метил-10,11-дихидро-Н-дибензоциклохептен-5,10-имин хидрогенмалеат, MK-801; закупен от Sigma] се разтваря extempore във физиологичен разтвор и се прилага i.p. при обем 5 ml/kg. Контролните животни получиха съответните носители в подходящи обеми.
Тест за принудително плуване при мишки, хронично третирани с дизоцилпин
Острото приложение на мощния антагонист на N-метил-d-аспартат (NMDA) фенциклидин може да предизвика както положителни, така и отрицателни симптоми на психоза при човека и обостря психозата при пациенти с шизофрения (Abdel-Naby et al. 2001). При животните фенциклидин може да предизвика широк спектър от ненормално поведение, което може да бъде свързано с психотично поведение. При многократно приложение на фенциклидин при мишки може да се предизвика състояние на отклонение, което продължава няколко дни след прекратяване на лечението с фенциклидин. Аволицията е един от негативните симптоми на шизофренията; той се определя количествено в тест за принудително плуване и животните показват състояние на продължителна неподвижност като индикатор за склонност (Abdel-Naby et al. 2001). Този модел беше предложен да бъде идеален модел на негативни симптоми на психоза (Noda et al. 1995), но той е ограничен до депресивния компонент и може да не е полезен за моделиране на други негативни симптоми като дефицит на обучение и памет или социално прибиране.
Тъй като фенциклидинът е контролирано вещество, ние възстановихме модела, използвайки вместо него антагониста на NMDA-рецептора дизоцилпин. Тестът за принудително плуване и протоколът за медикаментозно лечение се провеждат върху мишки по същество, както е описано от Noda et al. (1995). Дозата на дизоцилпин и схемата на лечение са избрани въз основа на предварителни експерименти (данните не са представени). На първия ден (петък) всяко животно беше поставено поотделно в стъклен цилиндър (височина 20 см, диаметър 15 см), съдържащ 11 см вода, поддържана при 23 ° С, и беше принуден да плува в продължение на 3 минути и времето за обездвижване е записано (първо измерване на обездвижването като измерване на базова линия). Мишката е била преценена като неподвижна, когато е оставала да плава пасивно във водата. За индуциране на склонност, мишките са били хронично третирани с 0,2 mg/kg дизоцилпин i.p. всеки ден, с изключение на уикендите, започващи на четвъртия ден (понеделник) след първия тест за плуване, до ден 19 (петък). След 2-дневен период без наркотици, на 22-ия ден (понеделник), всяка мишка се поставя отново във вода за 3 минути и неподвижността се записва, за да се тества за удължаване на неподвижността (второ измерване на неподвижността).
Статистически анализ
Всички данни са представени като средни стойности ± стандартна грешка на средната стойност (SEM), където е подходящо. Статистическият анализ на ефекта на тофисопам върху продължителната неподвижност след прекратяване на лечението е извършен чрез еднопосочен дисперсионен анализ (ANOVA) на индивидуалните разлики между двете измервания на неподвижност, последван от post hoc тест на Tukey. Използването на индивидуални разлики води до корекция на изходното ниво. Стойността на р, по-малка или равна на 0,05, се счита за статистически значима.
За да се тества ефектът от повтарящо се определяне на неподвижност в същата група, отделните групи също се сравняват с помощта на сдвоен t тест.
Резултати
Екран на фосфодиестераза (Таблица 1)
маса 1
Инхибиране на фосфодиестераза (PDE) изоензими от тофизопам
| PDE-1A3 | 37.8 | n.d. |
| PDE-2A3 | 83.4 | 2,11 ± 1,8 |
| PDE-3A | 81.7 | 1,98 ± 1,7 |
| PDE-4A1 | 92.1 | 0,42 ± 0,8 |
| PDE-5 (каталитичен домейн) | 42,0 | n.d. |
| PDE-6C | 5.3 | n.d. |
| PDE-8A1 | 7.9 | n.d. |
| PDE-9A1 | 2.8 | n.d. |
| PDE-10A1 | 89.6 | 0,92 ± 1,2 |
| PDE-11A1 | 4.2 | n.d. |
Ефект на тофизопам (10 000 nM) върху активността на различни PDE изоензими, както се определя с помощта на IMAP технологията (Molecular Devices, Inc., Сънивейл, Калифорния, САЩ). Процентните стойности на инхибиране се определят от двойни определяния. За изоензими, при които инхибирането надвишава 50%, стойностите на IC50 се определят с 8-точков анализ, като се използват 3 паралелни експеримента за всеки отделен изоензим. Стойностите на IC50 са дадени като средни стойности ± стандартна грешка на средната стойност от 3 измервания
Установено е, че тофизопам действа като блокер с нисък афинитет на редица PDE изоензими. Въпреки че не е установено взаимодействие с PDE-6, PDE-8, PDE-9 и PDE-11, слабото инхибиране е установено за PDE-1 и PDE-5. Поради инхибиране под 50%, измерено при 10 000 μM, не е определен IC50 за тези изоензими. Установено е инхибиране в диапазона от високи до наномоларни до ниски микромолари за PDE-2A3 (2,11 ± 1,8 μM), PDE-3A (1,98 ± 1,7 μM), PDE-4A1 (0,42 ± 0,8 μM) и PDE-10A1 (0,92 ± 1,2 μM).
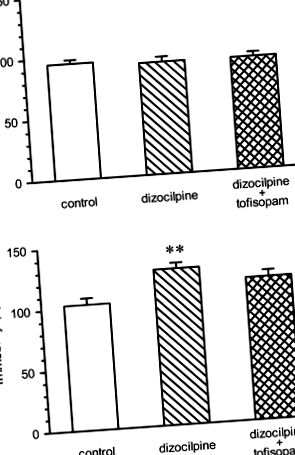
Ефекти на тофизопама в модел на негативни симптоми на психоза (фиг. 1)
Неподвижност на мишки в силовия тест за плуване преди многократно приложение на дизоцилпин (0,2 mg/kg i.p. веднъж дневно 5 дни в седмицата) или дизоцилпин плюс тофизопам, 50 mg/kg i.p. два пъти дневно, 5 дни в седмицата (панел а) и на 22-ия ден, 3 дни след прекратяване на лечението с наркотици (панел б). Обездвижването на 1-ви ден е сходно и за трите групи [ANOVA: F (2, 46) = 0,2696, без значение]. На 21 ден (панел б), неподвижността на третираните с дизоцилпин мишки беше значително увеличена в сравнение с контролната група; ANOVA за индивидуални разлики: F (2, 46) = 6,005, p = 0,0048. Неподвижността на третираната с тофизопам група не се различава съществено от групата на носителя. ** p -1, което показва, че тофисопам има по-висока концентрация в екстраваскуларната тъкан, отколкото в съдовия отдел. Установено е, че полуживотът е в диапазона от 4 часа, което показва, че след три пъти дневно приложение на 100 mg може да се очаква известно натрупване (Tóth et al. 2006). Тези данни показват, че може да се очаква стационарната тъканна концентрация да бъде в диапазона или дори по-висока от IC50 на PDE-4, PDE-10 и потенциално също PDE-2, което води до частичен блок на тези ензими.
В in vivo модела многократното приложение на дизоцилпин води до очакваното удължаване на обездвижването при тестваните мишки. Трябва да се отбележи, че реактивността на мишките не може да бъде свързана с остър лекарствен ефект на дизоцилпин, за който е известно, че предизвиква хиперактивност, ако се прилага на животни. Поради времето на измиване от 3 дни след последната доза и с оглед на полуживота на дизоцилпин при гризачи в диапазона от 2 часа (Vezzani et al. 1989), поведенческата модификация на мишките може по-скоро да бъде свързана с хронична пластичност. Нашите данни показват, че първоначално описаният модел, използващ фенциклидин, може да бъде генериран, използвайки вместо това дизоцилпин (Noda et al. 1995).
Тофисопам, прилаган два пъти дневно на мишките, е способен да намали повишената неподвижност в нашия модел. Ефектът е очевиден 3 дни след последната доза тофисопам, което показва, че ефектът не може да бъде свързан с остър ефект на тофисопам върху поведението на мишката. Повишаването на неподвижността, индуцирано от субхронично приложение на NMDA антагонисти, се отслабва от клозапин и рисперидон, за които е известно, че подобряват негативните симптоми при пациентите, но не и от халоперидол, който не ги подобрява (Noda et al. 1995, 2000). По този начин тофизопамът има потенциала да подобри негативните симптоми на психоза, като например аволюция; обаче не може да се получи пълна нормализация. Това може да е свързано с краткия полуживот на тофизопам при гризачи, но са необходими допълнителни експерименти за оценка на потенциала на тофизопам или други (по-мощни) 2,3-BZD при психоза. Трябва да се използват и други модели на негативни симптоми на психоза, за да се оцени дали негативните симптоми извън отклонението също са модифицирани.
Други 2,3-BZD могат да бъдат систематично оценявани за тяхното взаимодействие с PDE изоензими и съединения с комбиниран афинитет към PDE-4 и PDE-10, но също така и към PDE-2 могат да бъдат тествани в съответните животински модели, с фокус върху двойни или дори тройни инхибитори.
Благодарности
Авторите искат да благодарят на EGIS Pharmaceuticals PLC (Будапеща, Унгария) за щедрия подарък тофисопам.
Конфликт на интереси Авторите заявяват, че нямат конфликт на интереси.
Свободен достъп Тази статия се разпространява при условията на некоммерческия лиценз Creative Commons Attribution, който позволява всякакво нетърговско използване, разпространение и възпроизвеждане на какъвто и да е носител, при условие че оригиналните автори и източник са кредитирани.
- Информация за лекарството за симвастатин MedlinePlus
- Едноцентрово проучване на терапевтично лекарствено наблюдение на позаконазол при реципиенти на белодробна трансплантация
- ROSUVASTATIN - ORAL (Crestor) странични ефекти, медицинска употреба и лекарствени взаимодействия
- Rolex; наркотикът вкарва мъжа на Дъмфрис в болница - BBC News
- NEOMYCINGRAMICIDINNYSTATINTRIAMCINOLONE - ТОПИЧЕН КРЕМ странични ефекти, медицинска употреба и лекарство