Субекти
Резюме
Адаптивният имунитет е замесен в възпалението на мастната тъкан, затлъстяването и неговите неблагоприятни метаболитни последици. Все още не е установен автоантиген, свързан със затлъстяването, въпреки че протеинът на топлинен шок 60 (HSP60) е замесен в други автоимунни заболявания. Изследвахме дали храненето с високомаслена диета на мишки C57BL/6J би причинило автоимунитет към HSP60 и дали имуномодулацията с пептиди от HSP60 ще обърне полученото затлъстяване или метаболитна дисфункция. Затлъстелите мишки са имали по-високи нива на циркулация на HSP60, свързани с повишени реакции на пролиферация на Т-лимфоцити и поява на нива на циркулиращи IgG1 и IgG2c антитела срещу HSP60. Лечението с ескалиращи дози от смес от три доказани имуномодулиращи HSP60 пептиди не намалява теглото, но напълно обръща увеличението на нивата на VLDL/LDL и частично обръща непоносимостта към глюкоза при затлъстели мишки. Затлъстелите мишки създават автоимунен отговор на HSP60, който отчасти е в основата на получените метаболитни нарушения.
Въведение
Затлъстяването се увеличава в световен мащаб, придружено от повишаване на нивата на диабет тип 2 и метаболитния синдром, мастна чернодробна болест, рак на гърдата и дебелото черво, мускулно-скелетни нарушения и сърдечно-съдови заболявания, включително атеросклероза и инсулт. 1, 2 Много вредни последици от затлъстяването се дължат на възпалението на мастната тъкан (AT), 3 с вроден и адаптивен имунитет. 4 Доказателствата, че Т лимфоцитите допринасят за възпалението на AT, включват: (1) Т клетките се натрупват в AT дори преди макрофагите. 5, 6, 7 (2) Ограничено Vα репертоарите предполагат антиген-специфично клонално разширение. 8 (3) Делецията на молекули MHC клас II в световен мащаб или върху макрофаги намалява затлъстяването, инсулиновата резистентност и възпалението на AT. 9, 10 (4) Обратно, усилването на антиген-представящата клетъчна функция благоприятства AT възпалението и насърчава инсулиновата резистентност. 11 Тези доказателства предполагат автоимунен компонент в затлъстяването, но досега не са установени виновни автоантигени.
HSP60 е еволюционно запазен митохондриален шаперонин, който може да се транслоцира в цитозола и клетъчната мембрана и да бъде освободен в циркулацията при условия на стрес. 12 HSP60 е свързан с автоимунния компонент на няколко възпалителни заболявания, включително атеросклероза. 12 Съвсем наскоро беше демонстрирано освобождаването на HSP60 от AT, както и способността му да предизвиква инсулинова резистентност и освобождаване на противовъзпалителни цитокини (TNF-α, IL-6 и IL-8) от адипоцитите. 13 Също така бяха установени циркулиращи нива на HSP60 при затлъстели индивиди, отколкото слабите контроли. Всички тези наблюдения правят HSP60 кандидат-автоантиген при затлъстяване, въпреки че това все още не е доказано. Поради това изследвахме дали храненето с високо съдържание на мазнини (HFD) поражда автоимунитет срещу HSP60 при мишки и дали имуномодулацията със специфични за HSP60 пептиди може да намали затлъстяването или свързаното с него метаболитно увреждане.
Материали и методи
Повече подробности са дадени във файла с допълнителни методи, достъпен на уебсайта на International Journal of Obesity. Накратко: Мишките C57BL/6J (на 6 седмици), закупени от Charles River Laboratories (Margate, UK), бяха хранени с нормална чау (ND) или HFD, допълнена с 21% свинска мас и 0,15% холестерол (Special Diets Services, Witham, Essex, UK ) в продължение на 16–20 седмици за предизвикване на затлъстяване. За лечение с пептиди, 6-седмични мишки бяха предварително дозирани подкожно с HSP60 пептиди (GL Biochem, Шанхай, Китай), започвайки от 0,1 μg на мишка. Дозата се увеличава 10 пъти всяка седмица до 100 μg на мишка, която се дава седмично още три пъти, след това на всеки 2 седмици до края на проучването. HFD е започнал на 11-седмична възраст (след третата максимална доза) и е продължил 20 седмици 14, когато е бил убит от дислокация на шийката на матката съгласно лиценза на Home Office 70/22957. Ръководство за грижа и използване на лабораторни животни, осмо издание (2011) (http://grants.nih.gov/grants/olaw/guide-for-the-care-and-use-of-laboratory-animals.pdf ) беше последвано. Процедурите бяха проведени съгласно лицензи за вътрешен офис 30/3064 и 70/22957. Всички животни оцеляха, докато не бъдат убити и бяха включени в анализа.
След убиването се събират, претеглят епидидимални мастни накладки и се отделя стромалната съдова фракция (SVF) чрез разграждане на колагеназа. За анализ на популации от макрофаги, 1 милион SVF клетки бяха изследвани чрез анализ на поточна цитометрия, използвайки антитела срещу CD11b, F4/80, CD11c и CD206. Т-клетъчните популации бяха анализирани с помощта на антитела срещу CD45, CD3ɛ, CD4, CD25 и FoxP3.
Нивата на серумен HSP60 бяха измерени с мишка HSP60 ELISA (NeoSciaching, Cambridge, MA, USA). Нивата на серумни анти-HSP60 антитела се измерват с направена по поръчка ELISA, използвайки рекомбинантен, изчерпан ендотоксин миши HSP60 протеин (Enzo Life Sciences, Farmingdale, NY, USA), свързан с Nunc Immuno MaxiSorp 96-гнездови плаки. За анализа на реактивна Т-клетъчна пролиферация на HSP60, общите клетъчни пелети от хомогенизиран далак се пулсират с 3 Н-тимидин в продължение на 18 часа след предварително третиране с буферен контрол, рекомбинантен HSP60 или пептиди.
Тестовете за толерантност към глюкоза са проведени след 16 седмици ND или HFD. След 6 часа бързо, 2 g kg -1 телесно тегло глюкоза се инжектира интраперитонеално и концентрацията на глюкоза в кръвта от изрезките на опашката се измерва 0, 15, 30, 60 и 90 минути по-късно. Тест за инсулинов толеранс е проведен една седмица по-късно. След 4 часа бърз, бързодействащ човешки инсулин (NovoRapid; Novo Nordisk A/S, Bagsvaerd, Дания) се инжектира интраперитонеално, за да се получи крайна доза от 1 U kg -1 телесно тегло. Кръвната глюкоза се измерва по едно и също време. За определяне на нивата на инсулин на гладно се използва миши свръхчувствителен инсулинов ELISA комплект (Alpco, Salem, NH, USA).
За нормално разпределени променливи (тест на Колмогоров – Смиронов), двустранен, несдвоен студент т-тестът е използван за определяне на значителни разлики между 2 средства. За многобройни сравнения беше извършена еднопосочна ANOVA или двупосочна ANOVA, както е подходящо, последвана от корекция на Bonferroni. Различията се считат за значителни, ако P
Резултати
Повишени нива на циркулиращ HSP60, антитела срещу HSP60 и Т-клетъчни отговори на HSP60 при мишки C57BL/6J, хранени с HFD
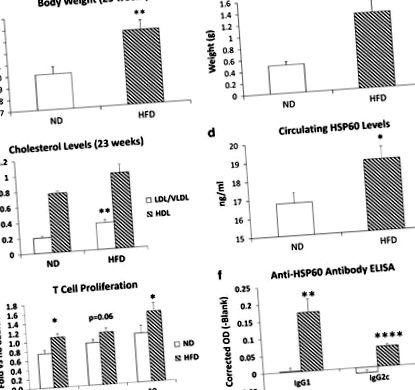
Мишките C57BL/6J, хранени с HFD в продължение на 16 седмици, са с 3 g по-тежки от ND мишките (Фигура 1а) и техните епидидимални мастни накладки са почти три пъти по-тежки (Фигура 1b). Плазмените нива на LDL/VLDL са значително увеличени (74%) от HFD, въпреки че нивата на HDL са непроменени (Фигура 1в). HFD значително повишава нивата на циркулиращ HSP60 с 12% (Фигура 1г), което предполага, че затлъстяването е стресов фактор, способен да стимулира освобождаването на HSP60.
Ефект на HFD върху наддаването на тегло, метаболизма и автоимунитета към HSP60. Групи мишки (н= 7) са били хранени с HFD или ND в продължение на 16 седмици. (а) Тегло на тялото (P= 0,007) и (б) тежести на епидидималните мазнини (P= 0,004) са значително увеличени от HFD. (° С) Нивата на циркулиращ LDL/VLDL също са значително увеличени (P= 0,005). (д) Нивата на HSP60 при мишки, измерени в серумни проби чрез ELISA, са значително по-високи при HFD в сравнение с мишки, хранени с ND (P= 0,039; н= 19 всяка). (д) Т-клетъчната пролиферация (изразена по отношение на само средата отрицателен контрол) се увеличава значително при HFD в сравнение с ND спленокти, когато се стимулира с 0,1 μg ml -1 (P= 0,013) или 10 μg ml -1 (P= 0,038) на рекомбинантна мишка HSP60. (е) И двете анти-HSP60 IgG1 и IgG2c нива на циркулиращи антитела са значително повишени от HFD (Pmax = 0,008 за IgG1; Pмакс. = 0,00009 за IgG2c).
Като доказателство за автоимунна реакция към HSP60, рекомбинантният HSP60 увеличава пролиферацията на Т-лимфоцитите на далака спрямо контролите на буфера с 20–40% повече при HFD от ND мишки. Това увеличение беше значително при 0,1 и 10 μg ml -1 и беше с гранично значение (P= 0,063) при концентрация 1,0 μg ml -1 (Фигура 1д). Отговорът на HSP60 е много по-слаб от положителната контрола ConA (13 пъти, не е показан), не е изненадващо, защото мишките не са хипер имунизирани. Циркулиращите нива на анти-HSP60 са неоткриваеми при ND мишки, но HFD значително повишава както анти-HSP60 IgG1, който зависи главно от Thelper2 (Th2) лимфоцитите, така и IgG2c, който се задвижва от Th1 лимфоцити 15 (Фигура 1f). Разликите между HFD и ND мишки са много значими над разреждане 1/16; много по-ниско от очакваното за хипер-имунен серум (обикновено> 1/1000). Ясно е, че кратките периоди на затлъстяване предизвикват автоимунитет срещу миши HSP60, макар и на ниско ниво.
Ефект от лечението с HSP60 пептид върху затлъстяването и свързаната с него метаболитна дисфункция
За да изследваме въздействието на HSP60 автоимунитет, използвахме подкожно лечение с HSP60 пептид с комбинация от равни концентрации на три пептида, за които е известно, че причиняват благоприятна имуномодулация в модели на автоимунен диабет или атеросклероза. Това бяха vlgggcallrcipaldslkpaned, 16 aelkkqskpvt 17 и dgealstlvlnrlkvg. 18 Всеки от тези пептиди имаше добра разтворимост във вода (резултатите не са показани). Използвахме протокол за повишаване на дозата, който се оказа безопасен и ефективен срещу експериментален автоимунен енцефаломиелит. 14.
Обработката с пептид с HSP60 не реверсира нарастването на теглото, индуцирано от HFD (Фигура 2а), или увеличението на епидидималната мастна маса (Фигура 2b), които са по-големи в този експеримент поради по-дългия период на HFD хранене. Въпреки това, лечението с пептид обърна значително увеличените нива на циркулиращ LDL/VLDL при HFD мишки (Фигура 2в).
Глюкозният толеранс е значително нарушен при HFD в сравнение с ND мишки. Обработката с пептид с HSP60 направи HFD мишките значително по-толерантни към глюкозата, макар и не толкова толерантни като ND мишки (Фигура 2г). Нивата на инсулин на гладно бяха повишени до същата степен спрямо ND (0,64 ± 0,05 ng ml -1) от HFD, независимо от лечението с пептиди (1,01 ± 0,22 и 1,18 ± 0,22 ng ml -1) и не можеха да отчетат подобрения глюкозен толеранс . Инсулиновата чувствителност, измерена при тест за инсулинов толеранс, също е сходна в групите за лечение на ND, HFD и пептиди (Фигура 2д).
За да се изследва дали лечението с HSP60 пептид потиска свързаното със затлъстяването възпаление, ние подложихме SVF клетките на поточна цитометрия. Регистрирахме значително увеличение на макрофагите (Фигура 2f), без промяна в общите CD4 + или CD4 - Т лимфоцити (не е показано) и намаляване на Treg клетките (Фигура 2g) в HFD в сравнение с ND мишки, но няма ефект на HSP60 пептидно третиране (Фигури 2f и g). Също така не наблюдавахме никаква разлика в реакциите на Т-клетъчна пролиферация на далака към рекомбинантен HSP60 при HFD-хранени мишки със и без третиране с HSP60 пептид. Нито открихме каквато и да е разлика в нивата на IL-2, IL-4, IL-6, IL-10, IL-17, IFN-y или TNFα, освободени спонтанно или в отговор на предизвикателство HSP60 (резултатите не са показани). Въпреки това, лечението с HSP60 пептид повишава титъра на анти-HSP60 IgG1 (Фигура 2h), но не и IgG2c антитела (Фигура 2i), което предполага засилване на Th2-управляваното производство на антитела.
Дискусия
HFD увеличава AT макрофагите и намалява Treg, както е съобщено по-рано от други (прегледано от Lolmede и др. 4), но не видяхме промени при лечението с пептид HSP60. Нито открихме влияние върху индуцираната от пептид Т-клетъчна пролиферация на далака или освобождаването на цитокини. Видяхме обаче преминаване към Th2-управлявано производство на IgG1, което предполага, че лечението с HSP60 пептид причинява имуномодулация, а не имунна толеризация, което ще изисква по-задълбочено проучване. В обобщение, за първи път показахме, че ниското ниво на автоимунитет към HSP60 допринася и лечението с пептид с HSP60 частично обръща метаболитни нарушения в модел на затлъстяване при мишки.
Препратки
Raghavan VA. Инсулинова резистентност и атеросклероза. Сърдечна недостатъчност Clin 2012; 8: 575–587.
Hotamisligil GS. Възпаление и метаболитни нарушения. Природата 2006; 444: 860–867.
Gregor MF, Hotamisligil GS. Възпалителни механизми при затлъстяване. Annu Rev Immunol 2011; 29: 415–445.
Lolmede K, Duffaut C, Zakaroff-Girard A, Bouloumie A. Имунни клетки в мастната тъкан: ключови участници в метаболитните нарушения. Диабет Metab 2011; 37: 283–290.
Duffaut C, Galitzky J, Lafontan M, Bouloumie A. Неочакван трафик на имунни клетки в мастната тъкан по време на появата на затлъстяване. Biochem Biophys Res Commun 2009; 384: 482–485.
Kintscher U, Hartge M, Hess K, Foryst-Ludwig A, Clemenz M, Wabitsch M и др. Инфилтрация на Т-лимфоцити във висцерална мастна тъкан: първично събитие при възпаление на мастната тъкан и развитие на инсулинова резистентност, медиирана от затлъстяване. Arterioscler Thromb Vasc Biol 2008; 28: 1304–1310.
Wu H, Ghosh S, Perrard XD, Feng L, Garcia GE, Perrard JL и др. Т-клетъчно натрупване и регулиране при активиране, нормална Т-клетка, експресирана и секретираща регулация в мастната тъкан при затлъстяване. Тираж 2007; 115: 1029–1038.
Winer S, Chan Y, Paltser G, Truong D, Tsui H, Bahrami J и др. Нормализиране на свързаната със затлъстяването инсулинова резистентност чрез имунотерапия. Nat Med 2009; 15: 921–929.
Cho KW, Morris DL, DelProposto JL, Geletka L, Zamarron B, Martinez-Santibanez G и др. Зависим от MHC II цикъл за активиране между макрофагите на мастната тъкан и CD4 + Т клетките контролира възпалението, предизвикано от затлъстяването. Представител на клетката 2014; 9: 605–617.
Deng T, Lyon CJ, Minze LJ, Lin J, Zou J, Liu JZ и др. Основният комплекс за хистосъвместимост от клас II играе съществена роля при индуцираното от затлъстяването мастно възпаление. Cell Metab 2013; 17: 411–422.
Moraes-Vieira PM, Yore MM, Dwyer PM, Syed I, Aryal P, Kahn BB. RBP4 активира антиген-представящи клетки, което води до възпаление на мастната тъкан и системна инсулинова резистентност. Cell Metab 2014; 19.: 512–526.
Wick G, Jakic B, Buszko M, Wick MC, Grundtman C. Ролята на протеините на топлинен шок в атеросклерозата. Nat Rev Cardiol 2014; 11.: 516–529.
Marker T, Sell H, Zillessen P, Glode A, Kriebel J, Ouwens DM и др. Протеин на топлинен шок 60 като медиатор на възпаление на мастната тъкан и инсулинова резистентност. Диабет 2012; 61: 615–625.
Burton BR, Britton GJ, Fang H, Verhagen J, Smithers B, Sabatos-Peyton CA и др. Последователните промени в транскрипцията диктуват безопасна и ефективна антиген-специфична имунотерапия. Nat Commun 2014; 5: 4741.
Петрушина I, Трън М, Саджикава Н, Гочикян А, Василевко V, Агаджанян М.Г. и др. Значение на изотипа IgG2c в имунния отговор на бета-амилоид в амилоиден предшественик протеин/трансгенни мишки. Neurosci Lett 2003; 338: 5-8.
Jin L, Zhu AH, Wang Y, Lu Y, Liu JJ. HSP65 служи като имуногенен носител за диабетогенен пептид P277, предизвикващ противовъзпалителен имунен отговор при NOD мишки чрез назално приложение. Ваксина 2010; 28: 3312–3317.
Mundkur L, Mukhopadhyay R, Samson S, Varma M, Kale D, Chen DX и др. Мукозната толерантност към комбинация от ApoB и HSP60 пептиди контролира прогресията на плаката и стабилизира уязвимата плака при Apob (tm2Sgy) Ldlr (tm1Her)/J мишки. Plos One 2013; 8: e58364.
ван Puijvelde HM, ван Es T, ван Wanrooij EJA, Habets KLL, de Vos P, van der Zee R и др. Индукцията на орален толеранс към HSP60 или HSP60-пептид активира регулацията на Т-клетките и намалява атеросклерозата. Arterioscl Thromb Vasc Biol 2007; 27: 2677–2683.
Krauss RM, Winston M, Fletcher BJ, Grundy SM. Затлъстяване: въздействие върху сърдечно-съдови заболявания. Тираж 1998; 98: 1472–1476.
Клингенберг R, Гердес N, Badeau RM, Гистера A, Strodthoff D, Ketelhuth DF и др. Изчерпването на регулаторните Т-клетки на FOXP3 + насърчава хиперхолестеролемия и атеросклероза. J Clin Invest 2013; 123: 1323–1334.
Благодарности
Работата беше подкрепена от следдипломна стипендия за МОН от турското министерство на образованието и от Поддръжка на председател на British Heart Foundation CH95/001.
Информация за автора
Настоящ адрес: 4 Текущ адрес: Институт по имунология и имунотерапия, Колеж по медицински и дентални науки, Университет в Бирмингам, Бирмингам B15 2TT, Великобритания.,
Принадлежности
Училище за клинични науки и Институт за сърце на Бристол, Британски кралски лазарет, Университет в Бристол, Бристол, Великобритания
M E Şelli & A C Newby
Отдел за експериментална патология и имунология, Лаборатория за автоимунитет, Биоцентър Инсбрук Медицински университет, Инсбрук, Австрия
Училище за клетъчна и молекулярна медицина, Университет в Бристол, Бристол, Великобритания
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
Авторите не декларират конфликт на интереси.
Допълнителна информация
Допълнителната информация придружава този документ на уебсайта на International Journal of Obesity
- Асоциации между диетичните модели и фенотипите на затлъстяването International Journal of Obesity
- Краката на затлъстелите деца са дебели или плоски Преразглеждане на дебата International Journal of Obesity
- Антиретровирусната терапия засилва затлъстяването и непоносимостта към глюкоза, предизвикани от диети -
- Alpha Lipid Ultra Diet 2 New Image International New Image International Нова Зеландия
- Британската нова диета 400-600-600 планира да се противопостави на затлъстяването