Свързани термини:
- Хипоталамус
- Будност
- Кортизол
- Мелатонин
- Циркаден ритъм
- Сън за бързо движение на очите
- Супрахиазматично ядро
- Болест на Алцхаймер
- Сън Събуждане цикъл
- Качество на съня
Изтеглете като PDF
За тази страница
Хормоналните секрети и отговорите се влияят от биологичните часовници
Доналд У. Пфаф,. Geoffrey A. Head, в Principles of Hormone/Behavior Relations, 2018
Резюме
Известно е, че биологичните часовници влияят на хормоналните секрети и реакциите. При голямо разнообразие от експериментални животни и при хора могат да се наблюдават много редовни 24-часови колебания в нивата на циркулиращия хормон. Някои поведенчески отговори на прилагането на хормони варират по амплитуда в зависимост от времето на деня. При бозайниците циркадният часовник на мозъка се проявява в активността на невроните в малка част от хипоталамуса, супрахиазматичното ядро (SCN). SCN управлява подчинени часовници в повечето периферни клетки, които са синхронизирани с SCN. Тази система отчита ежедневните трептения и циркадните ритми на нивата на хормоните и поведенческите навици. В цялото животинско царство храненето се извършва по ритмичен начин. Сезоните, цикълът ден/нощ и наличността на храна влияят върху храненето, но има основен ритъм, контролиран от хормони и нервни механизми. При хората ежедневните промени в хормоналната секреция и поведението се управляват от поне два вида сили: увлечени от светлина 24-часови ритми и стремеж към сън.
Хомеостаза и общи реакции на стрес
J.A. Симпсън MD, FRCP, FRCP (Ed), FRCP (Glas), FRS (Ed), W. Fitch PhD, MB ChB, FFARCS, в Приложна неврофизиология, 1988
ЧИРКАДСКИ И ДЪЛГОСРОЧНИ РИТМИ
Съществуването на „биологични часовници“, които регулират повече или по-малко ритмични промени в телесната температура, теглото, химията на кръвта, състоянието на възбуда и други параметри, вече е добре прието, въпреки че естеството и местата на осцилаторите са предмет на дискусии. Вариацията на невроендокринната секреция може да бъде циркадна (напр. ACTH), менструална (напр. Гонадотропини), сезонна (евентуално хормон на растежа) или в сравнително кратки цикли (напр. Сън-будност) и един ритъм може да бъде наложен върху друг (напр. Освобождаване на растежен хормон по време на сън без REM, стр. 142).
Тези основни ритми се изкривяват от взаимодействието между една дейност и друга. Освен това цикълът може да бъде увлечен от външни стимули. Важен пример за това е ефектът на светлината върху зададените точки на някои функции, регулирани от хипоталамуса. Стимулирането на ретините от дневна светлина активира ретинохипоталамична проекция към супрахиазматичното ядро на хипоталамуса (фиг. 25.1). Надрахиазматичното ядро се проектира към вентромедиалните, дорзомедиалните и дъговидните ядра на хипоталамуса, за да модулира освобождаването на гонадотропни хормони (и вероятно ACTH и хормон на растежа), факт, известен на птицевъдната индустрия. Той не е идентифициран като отделно ядро при човека, но персоналът на реанимацията трябва да е наясно с изискванията на човешкия субект за редовни периоди на мрак (и вероятно на тишина).
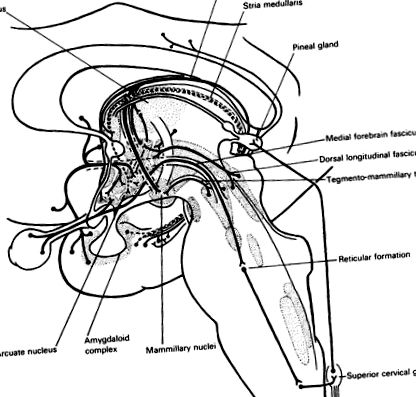
Фиг. 25.1. Привърженик на хипоталамуса. Медиалният сноп на предния мозък събира аферентни влакна от преоптичните области, включително орбитофронталната кора и септалните ядра. Амигдалоидният комплекс се проектира към дъгообразното ядро през хипокампалната формация andstria terminalis (···). Средният мозък се проектира към задния хипоталамус от дорзалния надлъжен фасцикул и тегменто-мамиларен тракт и допаминергична система (вж. Фиг. 3.3). Системата хипокампус-форникс включва издатини към преградата и предния хипоталамус, но основният й принос към ядрото на бозайника се предава в таламуса. Ретината изпраща неврони към супраоптичното ядро. Медиалният надлъжен сноп се проектира към понтомедуларна ретикуларна формация и в крайна сметка симпатиковите нервни влакна на горната гръдна връв. Екстра-гръбначните симпатикови влакна се издигат от горния цервикален ганглий до епифизната жлеза, която следователно е индиректно под оптичен контрол.
Суперхиазматичният контрол се модулира от серотонин, възходящ от ядрата на raphe. Ретинохипоталамусната проекция към супрахиазматичното ядро се предава също през медиалния сноп на предния мозък и мезенцефалната ретикуларна формация, страничната клетъчна колона на горния гръден гръбначен мозък и горния шиен симпатиков ганглий към епифизната жлеза. Епифизата се намира извън кръвно-мозъчната бариера (фиг. 25.1). Освободеният там норадреналин стимулира бета-адренергичните рецептори, които регулират синтеза на серотонин-свързан хормон, мелатонин. Екологичната светлина задържа ендогенния цикъл на секреция. Метаболизмът на този индол хормон реагира много на норадреналин и на стрес. Въпреки че функциите на мелатонин (или другите идентифицирани хормони в епифизата) са неизвестни, това откритие е важен указател за регулирането на хипоталамусните хормони чрез сензорна стимулация и чрез норадренергични и серотонинергични секрети, тъй като ензимната основа на епифизната реакция е била идентифицирани.
Току-що описаният епифизен механизъм е пример за общ принцип на нервната система. Светлинните вълни действат върху родопсин-подобен пигмент в ретината, за да предизвикат стимулация на ганглиозни клетки, която след това се предава от нормални невротрансмитерни механизми към β1-адренергичните рецептори в ефекторния орган. Там (с посредника на сАМР) се повишава активността на регулиращия ензим, което води до синтез на хормон, който се секретира в кръвния поток. Епифизата се доставя от горните мозъчни и задни хориоидални артерии.
Наръчник за изследване на съня
Тереза Лиу-Амброуз, Райън С. Фалк, в Наръчник по поведенческа неврология, 2019
III циркадни ритми и сън при нормално стареене
Основният увлекателен цайтгебер за човешкия биологичен часовник е светлината (Roenneberg & Foster, 1997; Sharma & Chandrashekaran, 2005), оказваща своето влияние върху ганглийните клетки на ретината, съдържащи меланопсин (Blanks, Hinton, Sadun и Miller, 1989; La Morgia et al. ., 2016; Schmidt, Chen, & Hattar, 2011; Sekaran, Foster, Lucas, & Hankins, 2003). Излагането на светлина на ретината директно стимулира дейността на SCN, която фаза забавя биологичния часовник така, че желанието за сън намалява и будността се увеличава (или се поддържа); намаленото излагане на светлина на ретината води до по-малка активност на SCN и увеличава желанието за сън чрез фаза, напредваща биологичния часовник (Shirani & Louis, 2009). По този начин, при нормални обстоятелства, биологичният часовник се увлича в цикъла на слънчевата светлина-тъмнина чрез регулирането на SCN - което помага на хората да поддържат редовен цикъл сън-будност (Mistlberger, 2005).
Стареенето обаче значително променя функционирането на циркадните ритми. Стареенето е свързано с биологичния часовник, иницииращ механизмите за насърчаване на съня по-рано през деня (Czeisler et al., 1992; Duffy, Dijk, Klerman, & Czeisler, 1998) и намалената амплитуда в циркадните сигнали, които увеличават нуждата от сън (Dijk, Duffy, Riel, Shanahan, & Czeisler, 1999; van Someren, Mirmiran, & Swaab, 1993). Това отслабване на циркадната регулация със стареенето вероятно играе видна роля във фрагментирането на ритмите на сън и събуждане, наблюдавани при възрастни възрастни по време на (1) зоната за поддържане на събуждането, което се случва 2-3 часа преди обичайното лягане, и (2) поддържането на съня зона, която се случва 2-3 часа преди обичайното време за събуждане (Landry & Liu-Ambrose, 2014). В допълнение, възрастните възрастни имат намалена чувствителност към светлина, поради свързана с възрастта загуба на ганглиозни клетки и аксони на ретината (Harwerth, Wheat, & Rangaswamy, 2008), което води до по-лошо функциониране на SCN и отклонение на биологичния часовник от слънчев цикъл светлина-тъмнина (Neikrug & Ancoli-Israel, 2010). Промените в поведението в по-напреднала възраст - като прекарването на по-малко време на открито - също могат допълнително да намалят излагането на ярка светлина, което може да е фактор, допринасящ за намалената амплитуда на циркадните ритми (Landry & Liu-Ambrose, 2014).
Това свързано с възрастта отслабване на циркадната регулация може да бъде свързано и с понижаване на качеството на съня в по-напреднала възраст. Промените в съня като функция на нормалното стареене, както по отношение на намаленото качество, така и количеството (Crowley, 2011; Espiritu, 2008). Повече от половината възрастни над 65 години съобщават за поне едно хронично оплакване от съня - най-често срещаните оплаквания са невъзможността да се спи през нощта и прекомерната сънливост през деня, водеща до чести дневни сънливи (Foley et al., 1995). Тези оплаквания, по-специално докладите за прекомерна сънливост през деня (ключов показател за натрупания дълг на съня (Carskadon, 1986; Johns, 1991)), предполагат, че свързаните с възрастта промени в съня вероятно са резултат от нещо извън намалената нужда от сън. Следователно доказателствата сочат, че (1) нормалното стареене може да наруши функцията на циркадните ритми и (2) тези свързани с възрастта промени във функционирането на циркадните ритми могат да обяснят спада както в качеството на съня, така и в количеството, когато хората стареят.
Електрофизиологични корелати на цикъла сън-събуждане
2.2.2 Архитектура на съня на животните
Болест на Алцхаймер
Промяна с течение на времето: (iii) Растежът и натрупването на ядра на плаката
Диенцефалон и вътрешна капсула
Различни връзки
. Висцерални и соматични аферентни . Общите висцерални аферентни пристигат от вагусното сетивно ядро, вкусовите аферентни от ядрото солитариус и соматичните аферентни от зърната и гениталиите. Аферентите на ретината, загрижени за интензивността на светлината, програмират „биологичен часовник“. Има вход от обонятелната кора на медиалния сноп на предния мозък.
Лимбична система, таламус и кора. Хипокампусът, в пода на долния рог на страничната камера, е свързан от форникса с тялото на мамиларите, с обезпечения с други хипоталамусни ядра. Ядрото на амигдалоида, в покрива на долния рог, има еференти, образуващи stria terminalis, които достигат до предните хипоталамусни и септални области. И двата пътя, форниксът и кривата на стриите около таламуса (фиг. 8.1, 8.10, виж фиг. 10.2). Медиалният сноп на предния мозък носи аферентни от преградната област. Мамилоталамичният тракт свързва хипоталамуса с предното таламусно ядро, което има реципрочни връзки с цингуларната извивка. Всички те са част от лимбичната система, образувайки гранична зона (limbus) между диенцефалона и теленцефалона.
Префронталната кора предава емоционална, афективна информация през дорзалното медиално ядро на таламуса до хипоталамуса чрез перивентрикуларна система от влакна на медиалната повърхност на таламуса.
Епифизна жлеза: взаимна връзка (вж. стр. 178).
Директни физични и химични рецептори. Циркулиращата кръв се наблюдава постоянно от хипоталамусните клетки, които функционират като терморецептори, осморецептори или хеморецептори.
Упражнение за здравето на мозъка
Джеси С.М. Чан,. Сесилия Л.В. Чан, в International Review of Neurobiology, 2019
1.3 Психологически дистрес, нарушение на съня и ускорено стареене при CFS
Настоящите и доживотни психиатрични разстройства са често срещани сред хората с CFS (Nater et al., 2011). Повечето хора с CFS са недолекувани поради психични заболявания (Nater et al., 2011). Лицата с CFS отчитат по-лошо психично здраве от тези, които не са CFS (Wong & Fielding, 2010). Като се имат предвид неблагоприятните физически и психически резултати от хроничната умора (CF) и CFS, които засягат ежедневното функциониране и трудовите постижения, тежестта на тези условия върху икономиката и здравеопазването не трябва да се подценява, но обикновено се пренебрегва (McCrone, Darbishire, Ridsdale, & Seed, 2003).
Физиологията на съня се показа като важен фактор в патофизиологията на CFS. Нарушенията на вътрешния биологичен часовник се проявяват като освежаващ сън или нарушения на съня, лоша концентрация и умора. Това са симптоми, свързани и с CFS (Fukuda et al., 1994). Въпреки че няма данни за нарушение на циркадния ритъм при CFS, субективно оплакване от съня, измерено от индекса за качество на съня в Питсбърг (PSQI) и субективни съобщения за неопресняване на съня са по-чести при пациенти с CFS в сравнение със здрави контролни субекти (Reeves, Heim, Maloney, et al., 2006).
Пациентите с CFS са значително по-склонни да имат високо алостатично натоварване, което би довело до нарушен отговор на продължителен стрес. Текущите и доживотните психиатрични разстройства са често срещани при пациенти с CF/CFS (Nater, Lin, Maloney, et al., 2009; Wong & Fielding, 2010). CFS и голямата депресия споделят симптомите и и двете могат да се разглеждат като дисрегулация на стресовата система, характеризираща се съответно с недостатъчна реакция на стрес и преувеличена реакция на стрес. Психиатричните разстройства, като депресия и тревожност, разстройство на съня и болка, също са свързани със свързани с възрастта заболявания и могат да предизвикат ускорено стареене (Wolkowitz, Epel, Reus и Mellon, 2010).
Цикълът сън-събуждане: Общ преглед
1.4.2 Циркаден
Независим от хомеостатичния процес е циркаден процес, който организира съня и събуждането и други биологични процеси (раздел 1.4.3) според 24-часовия дневен цикъл светлина-тъмнина. 12 Това е сложна система, която контролира функциите в цялото тяло, включително сън и събуждане. Нашето разбиране за циркадната система е по-напреднало от това за хомеостатичната система. Нобеловата награда за физиология или медицина за 2017 г. бе присъдена на Джефри К. Хол, Майкъл Росбаш и Майкъл У. Янг „за техните открития на молекулярни механизми, контролиращи циркадния ритъм“. 14 На клетъчно ниво те описват гени и протеини, които контролират циркадните ритми. Отвъд клетъчното ниво, светло-тъмно постъпване от ретино-хипоталамусния тракт се подава към супрахиазматичното ядро (SCN), което се счита за главен биологичен часовник. След това Eferences от SCN предават циркадни сигнали за синхронизация, които синхронизират различни физиологични системи и органи.
Циркадната фаза при хората обикновено се документира чрез регистриране на телесната температура или появата на слаба светлина на секрецията на мелатонин и при плъхове и мишки чрез бягане с колело. 14 Най-ниската дневна температура на човешкото тяло настъпва между 3 и 5 сутринта, като вторичното корито се случва през обяд, а пикът е между 17 и 20 часа. Продължителността на сънните епизоди и латентността за настъпване на съня са успоредни на ритъма на телесната температура. При пикови температури латентността се забавя и продължителността се съкращава, докато при най-ниските латентността е бърза и продължителността се увеличава.
SCN също така управлява хормонални и метаболитни ритми. За да назовем няколко, тиреоид-стимулиращият хормон, кортизол, пролактин, растежен хормон и мелатонин показват циркаден ритъм. Остро пролактинът и растежният хормон са свързани със съня, което означава, че освобождаването им се забавя, когато сънят се забави, независимо от циркадната фаза. За разлика от тях, кортизолът е пряко свързан с цикъла светлина-тъмнина и неговият циркаден ритъм остава независимо от времето на съня. Хормонът мелатонин комуникира светлинно-тъмния цикъл през SCN с часовници в тялото. Производството и освобождаването му се контролира от SCN и се изразява по време на тъмнина и потиска по време на светлина. Кратък импулс на светлината по време на тъмната фаза потиска нивата на мелатонин, което продължава за времето на светлината. Освобождаването на мелатонин вечер по здрач отслабва предупредителния пулс на SCN, като по този начин улеснява началото на нощния сън. Неговият хипнотичен капацитет отвъд хронобиотичната му характеристика, т.е. сигнализирането му за тъмнина, не е ясен.
Циркадни ритми и зависимост
Кели Барко,. Райън У. Логан, в Невронни механизми на пристрастяване, 2019
Упътвания за бъдещето
Нараства скептицизмът по отношение на това дали циркадните ритми са основните механизми, движещи употребата на вещества и пристрастяването, въпреки появяващите се доказателства, доказващи противното. Това може да се дължи отчасти на общата липса на изследвания, пряко и причинно-следствена връзка дали действителните ритми в рамките на предложените молекулярни, физиологични или биологични часовници са наистина важни за ритъма на поведенческите фенотипове и дали тези циркадни зависими механизми дори не имат важна роля, след като някой стане зависим. Тежестта върху полето се крие в необходимостта от проектиране на прагматични експериментални модели, които ясно дефинират въздействието на циркадното разрушаване върху уязвимостта към употребата на вещества, отделено от ролята на ритмите върху апетита, зависимостта и оттеглянето. Например, циркадните генни мутации могат да допринесат за риска от употребата на вещества чрез циркадни зависими механизми или генетична плейотропия [293]. В допълнение, светлината може да повлияе на настроението и възнаграждението и поведението чрез механизми, които привидно са независими от „класическите“ циркадни пътища [6,224,294] .
- Тежест на затлъстяването - общ преглед на ScienceDirect теми
- Антиалергични - общ преглед на ScienceDirect теми
- Фиброаденома на гърдата - общ преглед на ScienceDirect теми
- Афтозен стоматит - общ преглед на ScienceDirect теми
- Антифолат - общ преглед на ScienceDirect теми