Ние характеризирахме пълния геном на нов кучешки цирковирус (DogCV) от черния дроб на куче с тежък хеморагичен гастроентерит, васкулит и грануломатозен лимфаденит. DogCV е открит чрез PCR във фекални проби от 19/168 (11,3%) кучета с диария и 14/204 (6,9%) здрави кучета и в кръв от 19/409 (3,3%) от кучета с тромбоцитопения и неутропения, треска с неизвестен произход или минало ухапване от кърлеж. Ко-инфекция с други кучешки патогени е открита за 13/19 (68%) кучета, положителни за кучета с диария. DogCV капсидните протеини от различни кучета варират с до 8%. In situ хибридизация и трансмисионна електронна микроскопия открива DogCV в лимфните възли и далаците на 4 кучета със съдов компромис и хистиоцитно възпаление. Откриването на цирковирус в тъканите на кучета разширява известния тропизъм на тези вируси до втори бозайник гостоприемник. Нашите резултати показват, че цирковирусът, самостоятелно или при коинфекция с други патогени, може да допринесе за заболяване и смърт при кучета.
Цирковирусите са сферични вируси с едноверижен кръгов ДНК геном ≈2 kb; те се групират като род в семейството Circoviridae, заедно с предложения род Cyclovirus и филогенетично по-обособения род Gyrovirus (1). Повечето от известните видове от рода Circovirus заразяват птиците и причиняват признаци, включително малформации и некроза на кожата, лимфоидно изчерпване и имуносупресия (2).
Преди 2012 г. единствените цирковируси, за които се съобщава, че заразяват бозайници, са 2-те тясно свързани свински цирковируси (PCV) (3). PCV2 е основният патоген, свързан със спектър от болести по свинете, наречени свински цирковирусни заболявания, които са описани при свине по целия свят. Инфекцията с PCV2 причинява сериозни икономически загуби поради повишената смъртност и намаленото производство, което я прави един от икономически най-важните вируси в световната свинарска индустрия. Сред лезиите, които са приписани на PCV2 инфекция, са пневмония, ентерит, лимфаденит, васкулит, нефрит и репродуктивни заболявания (4). В случаите, при които PCV2 се счита за причинител, анализите на имунохистохимична и in situ хибридизация (ISH) показват големи количества PCV2 антиген или нуклеинови киселини в цитоплазмата на макрофагите и дендритни клетки в изчерпаните фоликули в лимфоидните тъкани (4,5). Естествените заболявания, свързани със свински цирковируси, често се ускоряват или обострят от едновременни вирусни или бактериални инфекции, а вторичните инфекции често се появяват в резултат на имуносупресия (6).
Случайното амплифициране на нуклеинова киселина със или без предварително обогатяване на свързани с вирусни частици нуклеинови киселини (7,8), последвано от дълбоко секвениране и търсене на сходство в силико за последователности, свързани с тези на известни вируси, са били високо продуктивни в областта на животинския вирус откритие (9–11). Използвахме тази техника за идентифициране на вирусни последователности в засегнатите тъкани от домашни животни със заболявания с неизвестна причина. Идентифицирахме кучешки цирковирус в черния дроб на куче, което имаше некротизиращ васкулит и грануломатозен лимфаденит, като и двата са описани при заразени с PCV2 свине (4). Ние нарекохме този вирус кучешки цирковирус (DogCV), а не кучешки цирковирус, за да се избегне объркване с обозначението на CaCV, използвано за канарски цирковирус (12,13), кучешки калицивирус (14,15) и вирус Capsicum chlorosis (16). Тесно свързан вариант на DogCV е секвениран независимо в кучешки серумни проби и е публикуван наскоро (17); обаче не е описана връзка с болестта с вируса. За да определим дали DogCV може да бъде свързан с кучешка съдова болест, идентифицирахме допълнителни кучета със съдови и грануломатозни лезии и изследвахме разпределението на DogCV чрез ISH анализ.
Материали и методи
Събиране на проби от животни
Приготвяне на проби и екстракция на нуклеинова киселина
Проба от чернодробна тъкан (≈25 mg) се потапя в 1 ml студен балансиран физиологичен разтвор на Hank и се разрушава с тъканен хомогенизатор за 30 секунди върху лед. Получените хомогенати се поставят върху сух лед за 5 минути и след това се размразяват при стайна температура (18). Замразяването и размразяването се повтаряха два пъти. Пробите се избистрят чрез центрофугиране при 10 000 х g за 3 минути; супернатантите след това се филтрират и се подлагат на нуклеазна обработка, както е описано (19). Вирусните нуклеинови киселини се екстрахират с помощта на QIAamp Viral RNA Mini Kit (QIAGEN, Валенсия, Калифорния, САЩ) и се съхраняват при -80 ° C.
Подготовка и последователност на библиотеките
Библиотеките с вирусни нуклеинови киселини бяха подготвени, както е описано (19). Библиотеката от едноверижни ДНК фрагменти беше секвенирана с помощта на Genome Sequencer FLX Instrument (Roche, Indianapolis, IN, USA).
Анализ на последователни данни
Пиросеквенционните отчитания бяха сортирани и изрязани, както е описано (19). Подрязаните четения от всяка проба бяха събрани de novo с помощта на програмата за сглобяване MIRA (20), с критерий> 95% идентичност над 35 bp. Сглобените последователности и синглетите> 100 bp бяха сравнени с базата данни на GenBank за ненужни нуклеотиди и протеини (www.ncbi.nlm.nih.gov/genbank) чрез използване съответно на BLASTn и BLASTx (http: //blast.ncbi.nlm.nih .gov/Blast.cgi). Потенциални вирусни последователности със значителни попадения (E-стойност 100 аа бяха предвидени от Vector NTI Advance 11 (Invitrogen, Карлсбад, Калифорния, САЩ). Структурата на стволовата верига беше предсказана с помощта на Mfold (21).
Филогенетичен анализ
Филогенетичните анализи, базирани на подравнени аминокиселинни последователности от реплицирани протеини с пълна дължина (Rep), бяха генерирани чрез използване на метода за присъединяване на съседи в MEGA4 (22), като се използваха аминокиселинните p-разстояния с 1000 повторения на bootstrap. Други методи за изграждане на дървета, включително максимална съобразителност и максимална вероятност, бяха използвани за потвърждаване на топологията на съседното дърво.
Проучване на разпространението на DogCV в примерни кохорти
PCR в реално време, използвайки 2 праймера и конвенционална сонда за хидролиза с 5-праймер 6-FAM и 3-праймер TAMRA етикет и TaqMan Universal PCR Master Mix (Applied Biosystems, Foster City, CA, USA) беше използван за откриване на DogCV в ДНК екстракти от 3 кохорти от кучешки проби: 1) фекални проби от 204 здрави кучета; 2) фекални проби от 168 кучета с диария; и 3) кръвни проби от 480 кучета с тромбоцитопения и неутропения, треска с неизвестен произход или минало ухапване от кърлеж. Двойките праймери и сондите за кучешки цирковирус са дадени в таблицата. Общата нуклеинова киселина беше извлечена с помощта на платформата Corbett X-Tractor Gene (QIAGEN). PCR в реално време се провежда с помощта на PCR инструмента в реално време LightCycler 480 (Roche, Indianapolis, IN, USA) при тези условия: 50 ° C за 2 минути, след това 95 ° C за 10 минути, последвано от 40 цикъла от 95 ° C за 15 секунди и 60 ° C за 1 минута. Синтетични ДНК фрагменти (≈150 bp) от съответните региони бяха използвани за получаване на стандартна крива и аналитична чувствителност от 10 молекули.
ISH анализ
Четвърта кохорта от проби се състои от тъканни проби от 21 случая на некропсия на кучета, чиито клинични признаци или микроскопични лезии съвпадат с часовниковото животно (т.е. хеморагична диария, васкулит и/или грануломатозно заболяване); тези проби бяха избрани от тъканните архиви на Анатомичната патология във ветеринарната медицинска болница UC Davis. Контролни тъкани са получени от 5 кучета, чиято причина за смъртта не е свързана със съдови заболявания. Избраните за анализ тъканни участъци отчасти зависят от случая, тъй като наличието на васкулит или възпаление сред тези случаи не е ограничено до един тип тъкан. Във всички случаи бяха изследвани далак, лимфни възли, йеюнум и илеум; други изследвани тъкани са бъбреци, мозък, надбъбречна жлеза, панкреас, дванадесетопръстник, сърце и бял дроб. В този анализ са включени тъкани от кучето-страж.
Електронна микроскопия
Избрани парчета от фиксирана с формалин лимфна възлова тъкан от кучето-сентинел бяха фиксирани след това в 2.0% глутаралдехид и след това рутинно обработени и вградени в епоксидна смола (комплект Eponate12; Ted Pella, Inc., Redding, CA, USA). Избраните дебели участъци бяха оцветени с толуидиново синьо, както е описано (26). Ултратънки срезове от избрани области на лимфните възли бяха изследвани с помощта на Zeiss (Gottingen, Germany) 906E електронен микроскоп за предаване.
Метагеномна идентификация на кучешки цирковирус
От ≈10 000 четения на последователност, 5 контига и синглета, съставени от 52 четения на последователности от чернодробната тъкан, имат значително сходство с Rep протеина на цирковирусите (Е-стойност -10). Бяха открити и две последователности на бокавирус. Тъй като цирковирусите имат кръгов геном, пълният вирусен геном след това се усилва чрез обратно вложено PCR и ампликонът се секвенира чрез прохождане на праймера. Сглобеният геном беше наречен щам DogCV UCD1 (DogCV-UCD1).
Резултати
Анализ на генома и филогенетична връзка
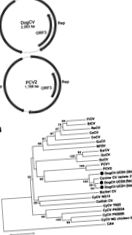
Фигура 1. . . А) Геномна организация на кучешки цирковирус (DogCV) и свински цирковирус 2 (PCV2). Б) Филогенетичен анализ на щамове DogCV (UCD1–3, изолирани съответно от тъкан, изпражнения и кръв) въз основа на.
Пълният кръгов геном на DogCV-UCD1 е бил 2 063 nt (GenBank номер за присъединяване KC241982). Анализът на геномната последователност показа характеристики, характерни за цирковирусите, включително организация на ambisense с 2 основни обратно подредени ORF, кодиращи предполагаемите свързани с репликация (Rep, 303 aa) и капсидни (Cap, 270 aa) протеини. Характерна структура на стволови цикли със запазен ненуклеотиден мотив (5′-TAGTATTAC-3 ′, подобен на консенсуса на цирковирусите на птици и свине) също е намерена в 5′-интергенния регион (135 nt, между началните кодони на 2 основни ORF). 3′-интергенният регион на DogCV-UCD1 между стоп кодоните на 2-те основни ORF е 203 nt (Фигура 1, панел А) (27).
Пълният геном на друг щам DogCV (DogCV-UCD2, присъединителен номер на GenBank № KC241984) беше амплифициран и секвениран от фекална проба от куче, настанено в приют, което имаше повръщане и диария. Този щам споделя 95% обща идентичност на геномния нуклеотид с DogCV-UCD1 и двата щама показват 96% -97% нуклеотидна идентичност с наскоро докладвания кучешки цирковирусен изолат 214 от кръв (17).
Предполагаемите Rep протеини на DogCV-UCD1 показват 42% -54% аминокиселинна идентичност с Rep протеините на свински и птичи цирковируси, с най-близката идентичност до PCV1. Капсидът DogCV-UCD1 показва 0,05 при χ2 тест). От 19 кучета с диария, при които DogCV е открит във фекални проби, 13 (68%) са били коинфектирани с> 1 други патогени, включително кучешки ентеричен коронавирус, Cryptosporidium spp., C. perfringens α токсин, Giardia spp., Salmonella spp. ., Campylobacter jejuni и Campylobacter coli (тествани чрез PCR).
Разпространението на DogCV в кръвни проби от кохортата на кучета с тромбоцитопения и неутропения, треска с неизвестен произход или ухапване от минали кърлежи е 3,3% (16/480), подобно на съобщеното за кучешки серумни проби (2,9%, 6/205 ) (17). Частичните Rep и/или Cap протеинови области (≈350 bp) се усилват от 11/16 проби. Всички показаха> 96% нуклеотидна идентичност, с изключение на 1 ампликон, който имаше> 2 от тези 3 признака: васкулит, кръвоизлив или грануломатозно заболяване. В тази група е представен широк спектър от засегнати тъкани; съответстващи тъкани бяха изследвани и от 5 контролни кучета, при които тези признаци не присъстваха. Проби от куче-страж (куче 1) и 3 други кучета (кучета 2–4) са положителни за DogCV чрез анализ на ISH. Всички други тъканни проби от контролни кучета са отрицателни чрез ISH анализ. Клинични признаци, груби и хистологични находки и разпределение на ДНК на вируса, определени от ISH, бяха използвани за изследване на възможната причинно-следствена роля за DogCV.
Куче 1 беше мъжко гонче, което имаше остра поява на повръщане и хеморагична диария. Куче 2 беше 5-годишна, женска, стерилизиран бостънски териер, който имаше повръщане и диария. Куче 3 беше 1-годишна, женска, стерилизиран боксьор с 5-дневна история на куцота и прогресивна тетрапареза. Куче 4 беше 2-годишен хрътка, намерен мъртъв с бикавитарен кръвоизлив; кръвна цитонамазка и PCR показаха, че това куче е коинфектирано с Babesia conradae.
Фигура 2. . Органни тъкани от куче сентинел (куче 1) и 2 други кучета (кучета 2 и 3), които са положителни чрез анализ на хибридизация in situ (ISH) за цирковирус на кучета (DogCV). А).
Чрез анализ на ISH се открива изобилна цитоплазмена вирусна нуклеинова киселина в макрофаги в зародишни центрове и субкапсулни и медуларни синуси на мезентериалните лимфни възли от всички 4 кучета (Фигура 2, панел Н), долночелюстни лимфни възли от 2 кучета, илеални пеери от всички 4 кучета (фигури 2, панели D, F), елипсоиди (крайни артериоли) на далака за 1 куче и зародишни центрове в бяла пулпа на далак за 2 кучета. Въпреки че ретикуларната мрежа беше обилно положителна при куче 1 (Фигура 2, панел H), често срещаният модел беше локализацията в центровете на лимфоидните или фоликулите на Пайер (Фигура 2, панели D, F), съответстваща на морфологията и разпределението на дендрита клетки. Редките ядра на удължени клетки (предполагаем ендотел), покриващи малки съдове на надбъбречната кора или чревна ламина proprija, разположени в близост до петна на Peyer, са положителни при 2 кучета. Не е открита нуклеинова киселина чрез ISH анализ в други тъкани, независимо от характера или интензивността на възпалението. Нито едно от 5-те контролни кучета не показва ДНК на DogCV от ISH.
Анализ на трансмисионната електронна микроскопия
Фигура 3. . Лимфен възел от куче-страж, от който е идентифициран цирковирус на кучето. А) Толуидиново синьо петно показва множество макрофаги в медуларния синус, съдържащи вакуоли и дискретни, продълговати до кръгли.
Ултраструктурният анализ на мезентериалния лимфен възел от куче 1 разкри макрофаги, натоварени с голям брой интрацитоплазмени включвания (Фигура 3, панел А). Включенията бяха кръгли, продълговати или неправилни; бяха
Дискусия
Идентифицирахме нов цирковирус, DogCV, в черния дроб на куче, което имаше некротизиращ васкулит и грануломатозен лимфаденит. Охарактеризирахме генома на множество щамове DogCV, определихме разпространението на DogCV в фекални и плазмени проби на кучета и тъканно разпределение при заразени животни и открихме паракристални масиви в тела на включване в макрофаги. PCR анализът в реално време показва разпространение съответно от 11,3% и 6,9% във фекални проби от кучета с диария и здрави кучета. ДНК на DogCV е открита и в 3,3% от кръвни проби от кучета с тромбоцитопения и неутропения, треска с неизвестен произход и ухапване от минали кърлежи, което е приблизително същия процент, както беше съобщено по-рано (17).
ISH анализът на кучето-сентинел и 21 допълнителни кучета, избрани ретроспективно от минали некропсии, открива вирусна нуклеинова киселина при 4 кучета, включително кучето-сентинел, и се оценяват хистопатологичните характеристики и разпространението на вируса в тъканни проби от тези кучета. Засегнатите органи варират дори при този малък набор от животни, но всички кучета са имали некротизиращ васкулит и кръвоизлив, а всички освен 1 са имали лимфаденит и грануломатозна болест. Тъй като тестваните ретроспективни животни са избрани така, че да отговарят на случая на сентинел, извадката ни е пристрастна и спектърът от заболявания, свързани с този вирус, може да е по-широк, отколкото сме открили. Сред кучетата, положителни по ISH, признаците на заболяването варират, а клиничните, грубите и микроскопските характеристики при някои от болестните синдроми са подобни на тези, свързани с PCV2 инфекция (4,5). По-специално, синдромът на свински дерматит и нефропатия споделя много от хистологичните характеристики, наблюдавани при DogCV-позитивни кучета (28,29), и PCV2 е съобщено, че причинява некротизиращ лимфаденит, васкулит или неврологично заболяване (4,30,31). Разпределението на вируси, както се оценява чрез анализ на ISH, също е подобно между DogCV и PCV2.
Вирусната ДНК последователно се открива в цитоплазмата на макрофагите и моноцитите в лимфоидните тъкани на заразени кучета. Разпространението на вируси при прасета, заразени с PCV2, е най-последователно в лимфоидната тъкан, като спорадични съобщения за вирус в други тъкани (4,23,32,33). Например, при прасета със синдром на дерматит и нефропатия често се съобщава за грануломатозно възпаление на бъбреците; обаче вирусът се открива в бъбречната тъкан само в няколко случая по какъвто и да е метод. В нашето проучване, DogCV ДНК е открита в лимфоидни тъкани, включително пластири на Peyer, дори при кучета 3 и 4, където не са открити клинични или хистологични ентерични лезии. DogCV ДНК е открита и в малки, крайно-капилярни ендотелни канали на чревната ламина propria и надбъбречната кора; потвърждаването на тези клетки като ендотелни обаче ще изисква допълнителни изследвания.
Две различни хистологични характеристики на PCV2 инфекцията са вирусни включвания и образуване на многоядрени гигантски клетки (34), нито едно от които не е установено чрез рутинна хистология при кучета, заразени с DogCV. Чрез електронна микроскопия обаче макрофагите в лимфния възел съдържат изобилие от цитоплазмени вирусни включвания, съставени от плътен гранулиран или паракристален подреден вирус. Засегнатите клетки бяха открити както в синусовия, така и в медуларния шнур на изследвания мезентериален лимфен възел. Ултраструктурните включвания са подобни на подгрупа от цитоплазмени включвания, които са описани в заразени с PCV2 тъкани (35,36).
Многобройни експериментални и естествени проучвания на заболяванията показват, че PCV2 инфекцията най-често води до клинични заболявания при наличие на коинфекция с други патогени на свинете. PCV2 усилва вирусни (напр. Свински парвовирус, свински репродуктивен и респираторен синдром вирус), бактериални, протозойни, метазоални и гъбични инфекции при прасета (6). Сред кучетата с диария в нашето проучване, повечето (68%) от положителните за DogCV са имали коинфекция с> 1 ентерични патогени. Също така, за малкия набор от случаи, в които идентифицирахме вируса in situ, 1 куче беше коинфектирано с кучешки бокавирус и 1 с Babesia conradae. Ролята на коинфекцията в патогенезата на заболяването в тези случаи е неясна.
В обобщение, DogCV трябва да се има предвид в случаите на необясним васкулит при кучета, въпреки че ще са необходими допълнителни проучвания, за да се установи дали и кога DogCV причинява заболяване. DogCV също може да бъде усложняващ фактор при други кучешки инфекциозни заболявания, какъвто е случаят с PCV2, който е най-опасен при свине, заразени с други патогени. Бъдещите изследвания за приноса на DogCV за болестта трябва внимателно да разгледат тези потенциални вирусни и гостоприемни фактори.
Д-р Ли е учен от Института за изследвания на кръвните системи и катедрата по лабораторна медицина, Калифорнийски университет, Сан Франциско, САЩ. Нейните научни интереси са откриване на вируси и вирусни инфекциозни заболявания.
Благодарности
Благодарим на Скот Фиш и лабораторията за безопасност на храните в Калифорния за здравето на животните в Дейвис за обработката на електронна микроскопия и експертизата.
- Ограничения на храните - април 2013 г. - BabyCenter India
- Хранителен резервоар за ешерихия коли, причиняваща инфекции на пикочните пътища - том 16, номер 1 - януари
- ДИЕТИЧНИ ЕФЕКТИ НА АНЕМИЯ ПЛЮС ХИПОПРОТЕЙНЕМИЯ ПРИ КУЧЕТА Вестник по експериментална медицина Рокфелер
- FreeTrial) Диета за обем Отслабване Оптималната диета за отслабване е Acai Fiber добра за отслабване
- Непоносимост към хранителни протеини при кучета - симптоми, причини, диагноза, лечение, възстановяване, управление