Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Тези автори допринесоха еднакво за тази работа. Потърсете още статии от този автор
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Катедра по хранене и хранителни науки, Факултет по хуманитарни науки, Университет Тезукаяма Гакуин, Сакай, Япония
Тези автори допринесоха еднакво за тази работа. Потърсете още статии от този автор
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Катедра по интегративна физиология, Медицински факултет на Университета Нагоя, Нагоя, Япония
Катедра по хранене и хранителни науки, Факултет по хуманитарни науки, Университет Тезукаяма Гакуин, Сакай, Япония
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Кореспонденция: Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, 1200 Мацумото-чо, Касугай 487-8501, Япония. Имейл: [email protected]
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Тези автори допринесоха еднакво за тази работа. Потърсете още статии от този автор
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Катедра по хранене и хранителни науки, Факултет по хуманитарни науки, Университет Тезукаяма Гакуин, Сакай, Япония
Тези автори допринесоха еднакво за тази работа. Потърсете още статии от този автор
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Катедра по интегративна физиология, Медицински факултет на Университета Нагоя, Нагоя, Япония
Катедра по хранене и хранителни науки, Факултет по хуманитарни науки, Университет Тезукаяма Гакуин, Сакай, Япония
Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, Касугай, Япония
Кореспонденция: Департамент по биомедицински науки, Колеж за науките за живота и здравето, Университет Чубу, 1200 Мацумото-чо, Касугай 487-8501, Япония. Имейл: [email protected]
РЕЗЮМЕ
СЪКРАЩЕНИЯ
МАТЕРИАЛИ И МЕТОДИ
Животни
Тестове за толерантност към глюкоза и инсулин
Извършен е интраперитонеален тест за глюкозен толеранс (IPGTT) с използване на 1,5 mg глюкоза/g телесно тегло след задържане на храна в продължение на 17 часа, както е описано по-рано от Wang и др (24). Тестът за инсулинова толерантност (ITT) беше извършен с използване на 0,75 U инсулин/kg телесно тегло след 4 часа гладуване. Нивото на глюкозата в кръвта се определя с помощта на глюкомер (NovoAssist Plus; Novo Nordisk, Bagsværd, Дания) преди инжектиране на глюкоза (0 минути) и на 30,60,90 и 120 минути след инжектиране.
Измерване на липиди
Нивата на триглицеридите в серума и общия холестерол са измерени, като се използват триглицеридни Е-тест и общ комплект за Е-тест на холестерол (Wako Pure Chemicals, Осака, Япония), съответно. Общите чернодробни липиди бяха извлечени, както беше описано по-рано (25), и нивата на липидите в екстрактите бяха анализирани с помощта на търговските комплекти.
Непряка калориметрия
Vo2 при мишки от див тип (WT) и Creg1-Tg се оценява с помощта на индиректна калориметрия, както е описано по-рано (25). На 23-седмична възраст мишките бяха настанени поотделно в 4-камерна система за наблюдение на животните Oxymax Lab (Columbus Instruments, Columbus, OH, USA) и бяха аклиматизирани за 1 ден, преди да започнат какъвто и да е експеримент. Vo2 и скоростта на производство на CO2 на всяка мишка се измерват на всеки 5 минути в продължение на 24 часа при нормални условия на измерване, а след това специфичният за β3-адренергичен рецептор агонист динатрий 5 - [(2R) ‐2 - [[(2R) 2- (3-хлорофенил) -2-хидроксиемил] амино] пропил] -1, 3-бензодиоксол-2,2-дикарбоксилат хидрат (CL316,243) (MilliporeSigma, Burlington, MA, САЩ) се инжектира интраперитонеално на доза от 1 mg/kg телесно тегло. По време на този експеримент бяха осигурени мишки ad libitum достъп до храна (високочестотна диета) и вода.
Адено-свързан вирусен експеримент
ДНК последователностите, съответстващи на късите фиби на РНК (shRNA) последователности на CREG1 (5′ ‐ CACCGCCACTATCTC ‐ CACAATAAAGCGAACTTTATTGTGGAGATAGTGGC ‑ 3 ′ и 5 ′ ‑AAAAGCTACGCTGACTATGTCTTTTATTCGTACGAG-TGTAGCAGATCAGTAGATCAGTAGGTCAGTAGATCAGTAGGTAGGTAGTAGGTAGTAGGTAGTAGGTAGGTGTAGTAGTAGTAGTAGTAGTAGGTAGTAGGTAGTGTAGTAGTAGTAGTAGTAGTAGTAGTAGTAGTAGTAGTGTAG (Takara Bio, Киото, Япония). Рекомбинантен адено-асоцииран вирус (AAV) 6-експресираща shRNA на CREG1 е генериран съгласно инструкциите на производителя. Като отрицателна контрола се генерира и рекомбинантна AAV6-експресираща shRNA на LacZ. AAV частиците се пречистват с помощта на пречистващия комплект AAVpro (Takara Bio). Титрите на вируса (вирусни геноми на милилитър) се определят чрез количествена PCR. В експериментите за администриране на AAV вектори, мъжки мишки C57BL/6J (8 седмици) се анестезират с изофлуран. Кожата, покриваща междулопаточната област, беше разрязана и всяка междулопаточна подложка BAT (iBAT) получи 2 инжекции от 20 µl AAV6 векторни разтвори (4 × 10 12 вирусни генома на милилитър). Тези мишки се поддържат в продължение на 2 седмици и се вземат проби за анализ.
Диференциация на адипоцитите
Анализ на генната експресия
Общата РНК беше извлечена с помощта на реактив Trizol (Thermo Fisher Scientific) съгласно протокола на производителя. За количествено определяне на нивата на експресия на mRNA, РНК от тъкани или култивирани клетки бяха обратно транскрибирани с помощта на комплекти за обратна транскрипция cDNA с висок капацитет (Thermo Fisher Scientific), съгласно инструкциите на производителя, и RT-PCR анализ в реално време беше извършен с помощта на Light-Cycler и FastStart DNA Master плюс Sybr Green I (Roche, Базел, Швейцария). Всички данни за генната експресия са нормализирани спрямо нивата 36B4. Използваните комплекти олигонуклеотидни праймери са показани на Таблица 1.
| 36b4 | TCATCCAGCAGGTGTTTGACA | CCCATTGATGATGGAGTGTGG |
| Adipoq | TGTTGGAATGACAGGAGCTGAA | CACACTGAACGCTGAGCGATAC |
| Cd137 | GAGCTAACGAAGCAGGGTTG | GGGAGAGAAGCTCACCACAG |
| Cidea | ATCACAACTGGCCTGGTTACG | TACTACCCGGTGTCCATTTCT |
| Цитирано1 | ATGCCAACCAGGAGATGAAC | AGGATGCAGGTTGAAGGATG |
| Крег1 | GACCTGCAGGAAAATCCAGA | AACAAACAGCGAATCCCTTG |
| Elovl3 | TCCGCGTTCTCATGTAGGTCT | GGACCTGATGCAACCCTATGA |
| Fabp4 | CCGCAGACGACAGGA | CTCATGCCCTTTCATAAACT |
| Fgf21 | GTGTCAAAGCCTCTAGGTTTCTT | GGTACACATTGTAACCGTCCTC |
| Igf2r | GCACCAAGATGAAGCAGTCA | ACATCCGGTAGCTGTTGGTC |
| Ppargcla | TAGGCCCAGGTACGACAGC | GCTCTTTGCGGTATTCATCC |
| Prdm16 | GACATTCCAATCCCACCAGA | CACCTCTGTATCCGTCAGCA |
| Tbx1 | CGACAAGCTGAAACTGACCA | GTGACTGCAGTGAAGCGTGT |
| Ucp1 | GTGAAGGTCAGAATGCAAGC | AGGGCCCCCTTCATGAGGTC |
- 36b4, субединица P0 на страничен дръжка на рибозомния протеин; Ppargcla, PPARG коактиватор 1 алфа.
Хистологичен анализ
Фиксираните тъкани бяха вградени в парафинов восък, разделени на дебелина 6 µm и оцветени с хематоксилин и еозин (H&E). За оцветяване с липиди тъканите бяха фиксирани в 4% параформалдехид и PBS и вградени в Tissue-Tek Оптимално съединение за температура на рязане (Sakura Finetek, Токио, Япония), разделено на 8 µm, и оцветено с масло Red Red O. Процентът на площта заети от оцветени липидни капчици се изчислява чрез използване на произволно избрани изображения × 20 полета (4-5 изображения на мишка) и софтуера ImageJ (National Institutes of Health, Bethesda, MD, USA). За оцветяване с UCP1 се изрязват серийни участъци с дебелина 4 µm, депарафинизират се, рехидратират се през ксилен и етанол и се обработват с 3% H2O2 в абсолютен метанол за 20 минути, за да се блокира ендогенната пероксидазна активност. За извличане на антиген, предметните стъкла се потапят в 0,01 М натриев цитрат (рН 6,0) и се загряват до 96 ° С в продължение на 20 минути в лабораторна микровълнова фурна или в разтвор за свързване на освобождаващи антитела (Polysciences, Warrington, PA, USA) при стайна температура за 10 минути . Слайдовете бяха блокирани с 5–10% нормален магарешки серум в PBS за 60 минути и инкубирани през нощта при 4 ° C с заешко поликлонално анти-UCP1 първично антитяло (ab23841; Abcam), разредено 1: 200 в PBS, съдържащо 2,5–10% нормален магарешки серум . Първичното свързване на антитела се открива чрез инкубация с конюгиран с пероксидаза от хрян анти-заешки IgG (414341; Nichirei Corporation, Токио, Япония) за 1 h при стайна температура. Етикетирането се визуализира с помощта на 3,3′-диаминобензидинов субстратен комплект за пероксидаза (SK ‑ 4100; Vector Laboratories). Обратното оцветяване беше извършено с хематоксилин на Mayer (Wako Pure Chemicals). При анализи на имунофлуоресценция диапозитивите бяха блокирани с 10% нормален магарешки серум и пречистено антимиши CD16/32 антитяло (1:50; клон 93,101301; BioLegend, Сан Диего, Калифорния, САЩ) в PBS за 60 минути и след това инкубирани ( една нощ при 4 ° C) с козе анти-CREG1 първично антитяло (1:50; C-17, sc-11728; Santa Cruz Biotechnology, Dallas, TX, USA) и заешко поликлонално анти-UCP1 антитяло (1:50; ab23841; Abcam). Оцветяването се визуализира чрез инкубиране на срези с конюгирани с Alexa 488 анти-заешки IgG (1: 500; abl50061; Abeam) и Alexa 594 - конюгирани анти-кози IgG (1: 500; Thermo Fisher Scientific) за 60 минути при стайна температура. Секциите бяха оцветени с помощта на монтажна среда VectaShield, съдържаща DAPI.
Анализ на протеини
Статистически анализ
Данните са изразени като средни стойности ± sem. Разликите между 2 групи в проучвания с мишки, включително разлики в телесното тегло и в резултатите от IPGTT, ITT и индиректната калориметрия, бяха анализирани с помощта на двупосочни ANOVA при повторни измервания. PLSD на Fisher post hoc тест се прилага, когато се установят значителни разлики. Други статистически сравнения бяха извършени с помощта на двустранен студент т тест. Стойности на P
РЕЗУЛТАТИ
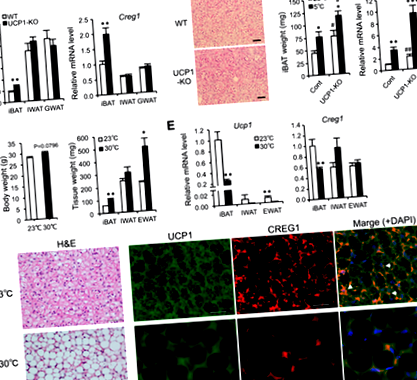
Крег1 изразът е положително свързан с формирането на НДНТ
Крег1 изразът положително корелира с Ucp1 експресия в първична адипоцитна култура
Образуване на кафяви адипоцити в Крег1IBAT се спасява чрез екзогенни доставки на CREG1
CREG1 се свързва с RXR-α, както и с IGF2R
Наскоро съобщихме, че като механизъм за CREG1 да стимулира кафявата адипогенеза, CREG1 стимулира Ucp1 транскрипция съвместно с T3 и RA, което предполага възможна функционална връзка между CREG1 и THR или RXR (22). Затова изследвахме дали CREG1 директно се свързва с THR или RXR. В нашата инвитро експерименти, в които свързването между CREG1 и IGF2R е потвърдено, както е съобщено (30), RXR-α, но не и THR-α се свързва с CREG1 (Фиг. 4А, Б). Също така не можахме да открием свързването на CREG1 с pRb, въпреки че предишно проучване на Veal и др. (17) съобщиха за тяхното взаимодействие инвитро. Свързването на RXR-α с CREG1 е потвърдено чрез имунопреципитационен анализ (Фиг. 4° С). Свързването между RXR-α и THR-α също е потвърдено в експеримент за имунопреципитация, както беше съобщено по-рано (31) (Фиг. 4° С). Тези резултати предполагат, че CREG1 действа с RXR-α, който може да си сътрудничи с THRs чрез образуване на хетеродимерен комплекс за транскрипция на целеви гени като Ucp1 участва в кафявата адипогенеза.
Повишената експресия на CREG1 в мастните тъкани стимулира потъмняване и подобрява DIO
Извършихме също имунологичен анализ на експресията на UCP1 и CREG1 в мастните тъкани. Хистологичното оцветяване разкрива поразителни промени при Tg мишки спрямо WT мишки при морфология на кафявите адипоцити в iBAT и покафеняване на IWAT и RWAT, съчетани със силна UCP1 имунореактивност (Фиг. 6А, Б). Размерите на адипоцитите са по-малки във всяка мастна тъкан на Tg мишки, отколкото при тези на WT мишки (Фиг. 6° С), което показва по-голям брой кафяви адипоцити на площ при Tg мишки, отколкото при WT мишки. Освен това, резултатите от Western blot показаха, че нивата на CREG1 в серума и мастната тъкан при мишки Tg са приблизително два пъти по-високи от тези при мишки WT (фиг. 6D, E). Експресията на UCP1 протеин в мастните тъкани също е значително по-висока при Tg мишки, отколкото при WT мишки (Фиг. 6D, F), което се съгласува с констатациите от имунохистологичния анализ (фиг. 6А, Б). Тези резултати показват, че увеличаването на CREG1 в мастните тъкани значително стимулира покафеняване и експресия на UCP1 при мишки.
Повишената експресия на CREG1 ускорява кафявата адипогенеза в първичната адипоцитна култура
ДИСКУСИЯ
ПРИЗНАВАНИЯ
Авторите благодарят на Y. Yamashita, Y. Ohmi, A. Nozaki и Y. Endo (всички от университета Chubu) за техническа подкрепа и на д-р Y. Kamei (University of Kyoto Prefectural University) за промотор на адипоцитен протеин 2. Тази работа е подкрепена с безвъзмездна помощ от Министерството на образованието, културата, спорта, науката и технологиите (MEXT), подкрепена програма за Фондация за стратегически изследвания в частни университети (S1201007), Безвъзмездна помощ за научни изследвания (Kakenhi) от Японското общество за насърчаване на науката (субсидии 24580499 и 15K07846 за HY, 15K07446 за TK и 16K21453 за MH) и Университет Chubu Grant A (за HY). Авторите не декларират конфликт на интереси.
ВНОСКИ НА АВТОРА
Х. Ямашита замисли експериментите; Т. Кусудо и Х. Ямашита са проектирали експериментите; всички автори извършиха експериментите и анализираха данните; и Х. Ямашита е написал ръкописа.
- Оценка на ефекта на отварата от трансфаст върху мишки със затлъстяване, индуцирани от хранителен вестник с високо съдържание на мазнини
- Индуцираното от диетата затлъстяване променя серумния профил на възпалението при мишки C57BL6N, измерено чрез
- Чесновото масло потиска затлъстяването, предизвикано от диета с високо съдържание на мазнини при плъхове чрез регулиране на UCP-1 и
- Чесновото масло потиска затлъстяването, предизвикано от диета с високо съдържание на мазнини при плъхове чрез регулиране на UCP ‑ 1 и
- Диета, предизвикана от затлъстяване - общ преглед на ScienceDirect теми