Свързани данни
Наборите от данни, генерирани за това изследване, са достъпни при поискване от съответния автор.
Резюме
Въведение
Метод
Животни
Мъжките хомозиготни WT и хомозиготни KI животни от мишката линия Tph2R439H, използвани за това проучване, са генерирани чрез хетерозиготно размножаване в университета Villanova. Тази линия е обратно кръстосана до линията C57BL/6 в продължение на 10 поколения, а съседите за отпадъци са използвани като контроли. Възрастни мишки бяха използвани за всички експерименти и излагането на HFD започна, когато мишките бяха на възраст 2–4 месеца. Няма разлика в средната възраст на мишките в никоя от лекуваните групи. Всички проучвания са извършени в съответствие с протоколи, одобрени от Институционалния комитет за грижа и употреба на животните (IACUC).
Диета и жилища
Всички мишки са били хранени с Envigo’s Teklad Global Diet (стандартна диета с естествени съставки: ID # 2019, 19% протеин, 9% мазнини и 3,3 kcal/g) от момента на отбиването до началото на експозицията на HFD. Групите с HFD са хранени с Tevid Custom Diet на Envigo (коригирана мастна диета: ID # 95217, 18,8% протеин, 39,7% мазнини и 4,3 kcal/g) за общо 22 седмици, докато групите със стандартна диета (SD) продължават да получават Envigo # 2019 диета през цялото проучване. Храната и водата са били налични по желание и животните са били настанени в стая с контролирана температура и влажност. Мишките бяха настанени на групи (три до пет на клетка), поддържани в продължение на 12-часов цикъл светлина-тъмнина и претегляни ежеседмично по време на експеримента. Поведенческите тестове започнаха, след като мишките бяха на HFD (или SD) в продължение на 20 седмици. Редът на тестване беше следният: тест на открито (OFT), 20-та седмица, петък; повишен плюс лабиринт (EPM), седмица 21, понеделник; и тест за принудително плуване (FST), седмица 21, петък. Поведенческите тестове бяха проведени по време на светлинната фаза на цикъла светлина-тъмнина, обикновено започваща
5 часа преди началото на тъмната фаза.
Отделни кохорти от WT и KI мишки бяха настанени поотделно, за да се позволи измерване на приема на храна. Двадесет и четири часа консумация на SD и HFD се измерва веднъж седмично.
Тест на открито
За OFT изследването и двигателната активност бяха оценени в 40 cm × 40 cm плексиглас ANY-box камери за активност (Stoelting, Wood Dale, IL, USA), с централно квадратно измерване 20 cm × 20 cm. Всяка мишка беше поставена в ъгъл на откритото поле и нейното движение и местоположение бяха записани в продължение на 20 минути с дигитални камери. Общото изминато разстояние, изминатото разстояние в центъра, броят на влизанията до центъра и времето, прекарано в центъра, са изчислени с помощта на ВСЯКАкъв лабиринт софтуер.
Повишен плюс лабиринт
За EPM, местоположението и активността на мишките в апарата се измерват с помощта на ВСЯКИ софтуер за проследяване на животни в лабиринт. Прекараното време и изминатото разстояние в отворените рамена, затворените рамена и целият апарат се определят за всяка мишка.
Тест за принудително плуване
FST се извършва по същество, както вече съобщавахме (Sachs et al., 2014a). Накратко, мишките бяха поставени в 4-L бехерова чаша, напълнена с приблизително 2500 ml 25 ° C вода, където те останаха в продължение на 6 минути. Поведението на всяка мишка беше записано отгоре с помощта на камера, окачена над бехеровата чаша. Използван е ВСЯКИ софтуер за лабиринт за измерване на времето, което всяка мишка прекарва неподвижно и броя на неподвижните епизоди.
Анализ на генната експресия
Една седмица след FST мишките бяха убити чрез изкълчване и обезглавяване на шийката на матката, след което мозъците бяха отстранени и разделени на участъци с дебелина 1 мм с помощта на мозъчна матрица. Двустранни тъканни удари (1,5 mm в диаметър и 1 mm в дебелина) са взети от хипокампуса [центриран приблизително ± 1,0 mm средно-страничен (ML), -2,0 mm предно-заден (AP), -1,7 mm дорзо-вентрален (DV ) спрямо Bregma] и веднага се замразява върху сух лед и се прехвърля във фризер -70 ° C до по-нататъшна обработка. РНК е изолирана от тъканните проби, събрани от хипокампуса на лявото полукълбо, използвайки Ambion PureLink RNA Mini Kit, съгласно инструкциите на производителя. РНК се замразява при -70 ° С до по-нататъшна обработка.
Обратните транскрипции бяха извършени с помощта на Thermo Scientific Maxima First Strand cDNA Synthesis Kit, съгласно инструкциите на производителя. Полимеразна верижна реакция в реално време (RT-PCR) беше извършена, както описахме по-рано (Sachs et al., 2018), като се използва rt-PCR комплектът PowerUp Sybr Green Master Mix (Applied Biosystems, Foster City, CA, USA) инструкциите на производителя. Последователностите на праймера бяха избрани от PrimerBank (Wang et al., 2012): GAPDH напред: 5′-CATGTTCCAGTATGACTCCACTC-3 ′; GAPDH реверс: 5′-GGCCTCACCCCATTTGATGT-3 ′; допълнение C4A напред: 5′-GATGACAAGAACGTGAGTGTCC-3 ′; допълнение C4A реверс: 5′-CCCTTTAGCCACCAATTTCAGG-3 ′; IL-1β напред: 5′-TTCAGGCAGGCAGTATCACTC-3 ′; IL-1β обратен: 5′-GAAGGTCCACGGGAAAGACAC-3 ′; IL-6 напред: 5′-TCTATACCACTTCACAAGTCGGA-3 ′; IL-6 реверс: 5′-GAATTGCCATTGCACAACTCTTT-3 ′; йонизирана молекула за свързване на калций 1 (IBA1) напред: 5′-ATCAACAAGCAATTCCTCGATGA-3 ′; IBA1 реверс: 5′-CAGCATTCGCTTCAAGGACATA-3 ′; GSK3β напред: 5′-ACAGGCCACAGGAGGTCAGT-3 ′; GSK3β обратно: 5′-GATGGCAACCAGTTCTCCAG-3 ′.
Западно петно
Хипокампалните тъканни удари от дясното полукълбо се обработват за Western blotting по същество, както описахме по-рано (Sachs et al., 2014b). Накратко, пробите бяха лизирани в ледено студен буфер за лизис (1% Triton, 1 mM EDTA, 150 mM NaCl и 20 mM Tris-HCl) с добавени протеазни и фосфатазни инхибитори. Малка аликвотна част беше използвана за определяне на протеини, използвайки комплекти за анализ на бицинхонинова киселина (BCA) (Boston Bio Products, Ashland, MA, USA). Равни количества протеин бяха заредени в TGX гелове за електрофореза. След това белтъците бяха прехвърлени в мембрани на поливинилиден дифлуорид (PVDF) и беше извършено Western blot с помощта на следните антитела: заешки антифосфорилиран GSK3β (клетъчно сигнализиране, # 9323, разреждане 1: 300), миши анти-общ GSK3β (клетъчно сигнализиране, # 9832, разреждане 1: 300) и заешки анти-GAPDH като контрола за зареждане (Cell Signaling, # 5174, разреждане 1: 300).
Статистически анализ
За увеличаване на теглото е използван софтуер SPSS за провеждане на трифакторен ANOVA с два фактора между субектите (т.е. генотип и диета) и един фактор за повтарящи се измервания (т.е. време). Всички останали данни бяха анализирани чрез двупосочна ANOVA с генотип и диета като фактори, използвайки JMP софтуер.
Резултати
Увеличаване на теглото с високо съдържание на мазнини
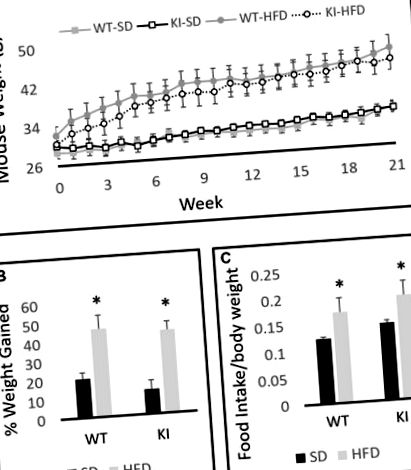
ANOVA между двама по двама с диета и генотип като фактори разкриха значителен ефект от диетата върху теглото (F (1,30) = 19,6, p Фигура 1A), но няма ефект от генотипа (F (1,30) = 0,001, p = 0,97, Фигура 1А). Анализът на повтарящи се измервания в рамките на субектите разкрива значителен ефект от времето върху телесното тегло (F (21,10) = 69,2, p Фигура 1A) и значително време чрез диетично взаимодействие (F (21,10) = 15,0, p Фигура 1А). Хроничното излагане на HFD доведе до значително по-голямо увеличение на телесното тегло както при WT, така и при KI животни, отколкото при продължително излагане на SD, но не са наблюдавани значителни разлики в генотипа в телесното тегло по всяко време (Фигура 1А). Както се очакваше, животните, третирани с HFD, увеличиха теглото си със значително по-висок процент от SD-хранените мишки по време на експеримента (F (1,30) = 34,98, p Фигура 1В). Сравненията на 24-часовия прием на храна при WT и KI мишки, консумиращи SD или HFD, не показват значителни разлики в генотипа в консумацията, но мишките ядат значително повече HFD на телесно тегло в сравнение със SD (основен ефект от диетата чрез двупосочен ANOVA, F 1,24) = 5,88, p = 0,023, фигура 1С).
Телесно тегло на мишки от див тип (WT) и нокаути (KI) на стандартна диета (SD) и диета с високо съдържание на мазнини (HFD). (А) Количествено определяне на средното телесно тегло за всяка група във времето. (Б) Изчисляване на средния процент на наддаване на телесно тегло за периода от 21 седмици за всяка група. (° С) Среден дневен прием на храна при мишки на SD или HFD. Резултатите са изразени като средна стойност, а лентите за грешки показват стандартна грешка. “*” Показва основния ефект на диетата чрез двупосочна ANOVA, p Фигура 2A) и намаляващ брой влизания, направени в центъра на полето (основен ефект от диетата; F (1,35) = 6,29, p = 0,019, Фигура 2Б). Въпреки това, няма съществен общ ефект на диетата върху двигателната активност (F (1,35) = 1,20, p = 0,28, фигура 2C), което предполага, че наблюдаваните ефекти върху разстоянието в центъра и броя на влизанията в центъра са не само резултат от намалена двигателна активност. Въпреки намаленията на влизанията в центъра и разстоянието в центъра, няма съществен ефект от диетата върху количеството време, прекарано в центъра на откритото поле (F (1,35) = 2,86, p = 0,099, фигура 2D ). Не са наблюдавани значителни ефекти на генотип и генотип при диетични взаимодействия.
Тест за принудително плуване
За FST не са наблюдавани значителни основни ефекти от диетата или генотипа. Имаше обаче значителен генотип по диетични взаимодействия за броя на неподвижните епизоди (F (1,35) = 6,91, p = 0,013, Фигура 2I) и за времето, прекарано в неподвижно състояние (F (1,35) = 6,31, p = 0,017, Фигура 2J). Последващите t-тестове разкриват, че HFD води до значително намаляване на неподвижните епизоди при WT мишки, но няма значителен ефект при KI животни (Фигура 2I). Няма значителни разлики в генотипа в поведението на FST при мишки на SD, но KI мишки, хранени с HFD, показват значително повече неподвижни епизоди и значително повече време, прекарано в неподвижно състояние, отколкото WT мишките, хранени с HFD (Фигури 2I, J).
Хипокампална генна експресия
HFD значително повишава хипокампалната експресия на IL-1β гена (основен ефект от диетата, F (1,32) = 5,3, p = 0,028, Фигура 3А), но няма значителни ефекти от генотипа и не се наблюдават взаимодействия. За разлика от това, не се наблюдават значими основни ефекти от диетата или генотипа и не се наблюдават значими взаимодействия за експресията на IL-6 (Фигура 3В) или IBA1 (Фигура 3С). Анализът на генната експресия разкрива, че HFD води до значително увеличаване на хипокампалната експресия на гена на комплемента 4А (C4A) (основен ефект от диетата, F (1,32) = 6,99, p = 0,013, фигура 3D). В допълнение се наблюдава, че KI мишки показват значително по-ниски нива на C4A, отколкото WT мишките (основен ефект на генотип, F (1,32) = 4,33, p = 0,046, фигура 3D), но не се наблюдават взаимодействия.
Ефекти на хроничната HFD върху WT и KI мишки върху експресията на гени, свързани с възпалението в хипокампуса. (А) Хипокампална експресия на интерлевкин-1β (IL-1β). (Б) Хипокампална експресия на интерлевкин-6 (IL-6). (° С) Хипокампална експресия на IBA1. (Д) Хипокампална експресия на C4a. Всички данни са нормализирани в GAPDH. Резултатите се изразяват като средна стойност, а лентите за грешки показват стандартна грешка на средната стойност. „Δ“ показва основен ефект от генотипа, „*“ Показва основен ефект от диетата чрез двупосочна ANOVA. N = 9–11 на група.
Сигнализация за хипокампал GSK3β
Не са наблюдавани значителни основни ефекти от генотипа или диетата върху фосфорилирането на GSK3β в хипокампуса. Въпреки това, се наблюдава значителен генотип чрез диетично взаимодействие на хипокампалното ниво на фосфорилиран GSK3β спрямо общия GSK3β (F (1,30) = 4.74, p = 0.0375, Фигура 4А). Post hoc анализите разкриват, че HFD води до значително увеличаване на GSK3β фосфорилирането при WT мишки, но не и при Tph2KI животни. Не са наблюдавани значителни промени в нивата на иРНК на GSK3β в хипокампуса (Фигура 4В).
- 1,3-Dmaa употреба, странични ефекти, взаимодействия, дозировка и предупреждение
- Ползи от гъби Agaricus, странични ефекти, дозировка, взаимодействия
- Основи на Avandia (розиглитазон), странични ефекти; Отзиви
- Употреба на синьо-зелени водорасли, странични ефекти, взаимодействия, дозировка и предупреждение
- 7 ползи за здравето от страничните ефекти на Goldenberries - SelfHacked