Субекти
Резюме
Диетата, богата на сол, е свързана с повишен риск от мозъчно-съдови заболявания и деменция, но остава неясно как диетичната сол вреди на мозъка. Ние съобщаваме, че при мишки излишъкът от хранителна сол потиска мозъчния кръвен поток в покой и ендотелната функция, което води до когнитивно увреждане. Ефектът зависи от разширяването на TH17 клетките в тънките черва, което води до значително увеличение на плазмения интерлевкин-17 (IL-17). Циркулиращият IL-17, от своя страна, насърчава ендотелната дисфункция и когнитивното увреждане от Rho киназа-зависимото инхибиторно фосфорилиране на ендотелната азотна оксидна синтаза и намалява производството на азотен оксид в мозъчните ендотелни клетки. Констатациите разкриват нова ос на червата и мозъка, свързваща диетичните навици с когнитивното увреждане чрез иницииран от червата адаптивен имунен отговор, нарушаващ мозъчната функция чрез циркулиращ IL-17. По този начин пътят TH17 клетка – IL-17 е предполагаема цел за противодействие на вредните мозъчни ефекти, индуцирани от диетична сол и други заболявания, свързани с поляризацията на TH17.
Опции за достъп
Абонирайте се за Journal
Получете пълен достъп до дневник за 1 година
само 4,60 € на брой
Всички цени са нетни цени.
ДДС ще бъде добавен по-късно при плащане.
Наем или покупка на статия
Получете ограничен или пълен достъп до статии в ReadCube.
Всички цени са нетни цени.
Препратки
Mozaffarian, D. et al. Глобална консумация на натрий и смърт от сърдечно-съдови причини. N. Engl. J. Med. 371, 624–634 (2014).
Zemel, M. B. & Sowers, J. R. Солева чувствителност и системна хипертония при възрастни хора. Am. J. Cardiol. 61, 7Н – 12Н (1988).
Farquhar, W. B., Edwards, D. G., Jurkovitz, C. T. & Weintraub, W. S. Диетичен натрий и здраве: нещо повече от кръвното налягане. J. Am. Coll. Кардиол. 65, 1042–1050 (2015).
Appel, L. J. et al. Значението на широкомащабното намаляване на натрия като средство за предотвратяване на сърдечно-съдови заболявания и инсулт: призив за действие от Американската сърдечна асоциация. Тираж 123, 1138–1143 (2011).
Комитет по стратегии за намаляване на приема на натрий от Института по медицина (САЩ). Стратегии за намаляване на приема на натрий в САЩ. (Henney, J.E., Taylor, C.L. & Boon, C.S. eds.) (National Academies Press, Washington DC, 2010).
Kotchen, T. A., Cowley, A. W. Jr. & Frohlich, E. D. Сол в здравето и болестите - деликатен баланс. N. Engl. J. Med. 368, 1229–1237 (2013).
Николс, М. Г. Диетично ограничение на натрий в популацията: предпазлив поглед. Curr. Хипертен. Представител. 13, 325–327 (2011).
О, Y. S. et al. Докладът на Националната работна група за сърцето, белите дробове и кръвта относно солта в човешкото здраве и болести: надграждане върху настоящите научни доказателства. Хипертония 68, 281–288 (2016).
Heye, A. K. et al. Кръвно налягане и натрий: връзка с ЯМР маркери при мозъчна болест на малките съдове. J. Cereb. Кръвотечение. Metab. 36, 264–274 (2016).
Strazzullo, P., D’Elia, L., Kandala, N.-B. & Cappuccio, F. P. Прием на сол, инсулт и сърдечно-съдови заболявания: мета-анализ на проспективни проучвания. Br. Med. J. 339, b4567 (2009).
Boegehold, M. A. Ефектът от високия прием на сол върху ендотелната функция: намален съдов азотен оксид при липса на хипертония. J. Vasc. Рез. 50, 458–467 (2013).
Cosic, A. et al. Атенюираната индуцирана от потока дилатация на средните мозъчни артерии е свързана с повишен съдов оксидативен стрес при плъхове при краткосрочна диета с високо съдържание на сол. J. Physiol. (Лонд.) 594, 4917–4931 (2016).
Iadecola, C. Невроваскуларната единица навършване на пълнолетие: пътуване през невроваскуларно свързване в здравето и болестите. Неврон 96, 17–42 (2017).
Iadecola, C. Патобиологията на съдовата деменция. Неврон 80, 844–866 (2013).
Kleinewietfeld, М. et al. Натриевият хлорид задвижва автоимунните заболявания чрез индуциране на патогенни TH17 клетки. Природата 496, 518–522 (2013).
Wu, C. et al. Индукция на патогенни TH17 клетки чрез индуцируема сол-чувствителна киназа SGK1. Природата 496, 513–517 (2013).
Kebir, H. et al. Човешките лимфоцити TH17 стимулират нарушаването на кръвно-мозъчната бариера и възпалението на централната нервна система. Нат. Med. 13, 1173–1175 (2007).
Nguyen, H. et al. Интерлевкин-17 причинява Rho-киназа-медиирана ендотелна дисфункция и хипертония. Кардиоваск. Рез. 97, 696–704 (2013).
Powles, J. et al. Глобални, регионални и национални приема на натрий през 1990 и 2010 г .: систематичен анализ на 24-часовата екскреция на натрий в урината и диетични изследвания в световен мащаб. BMJ Open. 3, e003733 (2013).
Cochet, H. et al. Изчерпателно фенотипизиране на индуцирана от солта хипертонична болест на сърцето при живи мишки с помощта на сърдечен магнитен резонанс. Евро. Радиол. 23., 332–338 (2013).
Schlote, J. et al. Сърдечно-съдови и бъбречни ефекти на диета с високо съдържание на сол при GDNF +/- мишки с ниско нефронно число. Бъбречна кръвна преса. Рез. 37, 379–391 (2013).
Jackman, K. A. et al. Дихотомични ефекти на хроничната интермитентна хипоксия върху фокална церебрална исхемична травма. Удар 45, 1460–1467 (2014).
Toda, N., Ayajiki, K. & Okamura, T. Регулиране на мозъчния кръвен поток чрез азотен оксид: скорошен напредък. Pharmacol. Преп. 61, 62–97 (2009).
Wang, G. et al. Бавнопресорната хипертония на ангиотензин II засилва NMDA токовете и NOX2-зависимото производство на супероксид в хипоталамусните паравентрикуларни неврони. Am. J. Physiol. Регул. Integr. Комп. Физиол. 304, R1096 – R1106 (2013).
Chen, B. R., Kozberg, M. G., Bouchard, M. B., Shaik, M. A. & Hillman, E. M. C. Критична роля за съдовия ендотел при функционално невроваскуларно свързване в мозъка. J. Am. Сърдечен доц. 3, e000787 (2014).
Poggesi, A., Pasi, M., Pescini, F., Pantoni, L. & Inzitari, D. Циркулиращи биологични маркери на ендотелната дисфункция при церебрална болест на малките съдове: преглед. J. Cereb. Кръвотечение. Metab. 36, 72–94 (2016).
Cohen, S. J. et al. Хипокампусът на гризачите е от съществено значение за паметта на непространствения обект. Curr. Biol. 23., 1685–1690 (2013).
Barnes, C. A. Дефицити на паметта, свързани със стареенето: неврофизиологично и поведенческо проучване при плъхове. J. Comp. Физиол. Психол. 93, 74–104 (1979).
Дийкън, Р. М. Оценка на изграждането на гнездо при мишки. Нат. Проток. 1, 1117–1119 (2006).
Rosenblum, W. I., Nelson, G. H. & Shimizu, T. L-аргинин суфузия възстановява отговора на ацетилхолин в мозъчните артериоли с увреден ендотел. Am. J. Physiol. 262, H961 – H964 (1992).
Харис, М. Б. и сътр. Взаимно фосфорилиране и регулиране на ендотелната азотно-оксидна синтаза в отговор на стимулация на брадикинин. J. Biol. Chem. 276, 16587–16591 (2001).
Smith, L., Payne, J. A., Sedeek, M. H., Granger, J. P. & Khalil, R. A. Индуцираните от ендотелин повишения на Ca2 + механизмите за навлизане на съдовата контракция се засилват по време на диета с високо съдържание на сол. Хипертония 41, 787–793 (2003).
Faraco, G. et al. Циркулиращият ендотелин-1 променя критичните механизми, регулиращи церебралната микроциркулация. Хипертония 62, 759–766 (2013).
Benakis, C. et al. Коменсалната микробиота влияе върху исхемичния инсулт, като регулира чревните γδ Т клетки. Нат. Med. 22., 516–523 (2016).
Hernandez, A. L. et al. Натриевият хлорид инхибира супресивната функция на FOXP3 + регулаторните Т клетки. J. Clin. Инвестирам. 125, 4212–4222 (2015).
Kipnis, J. Многостранни взаимодействия между адаптивния имунитет и централната нервна система. Наука 353, 766–771 (2016).
Faraco, G. et al. Периваскуларните макрофаги медиират невроваскуларната и когнитивната дисфункция, свързана с хипертонията. J. Clin. Инвестирам. 126, 4674–4689 (2016).
Binger, K. J. et al. Високата сол намалява активирането на IL-4- и IL-13-стимулирани макрофаги. J. Clin. Инвестирам. 125, 4223–4238 (2015).
Mandala, S. et al. Промяна на трафика на лимфоцити от агонисти на сфингозин-1-фосфатен рецептор. Наука 296, 346–349 (2002).
Сугимото, М. и сътр. Rho-киназа фосфорилира eNOS при треонин 495 в ендотелните клетки. Biochem. Biophys. Рез. Общ. 361, 462–467 (2007).
Guterbaum, T. J. et al. Ендотелно фосфорилиране на азотен оксид синтаза при Треонин 495 и образуване на реактивни кислородни митохондриални форми в отговор на висока концентрация на H2O2. J. Vasc. Рез. 50, 410–420 (2013).
Katusic, Z. S. & Austin, S. A. Ендотелен азотен оксид: защитник на здравия ум. Евро. Сърце J. 35, 888–894 (2014).
Love, S. & Miners, J. S. Церебрална хипоперфузия и енергийният дефицит при болестта на Алцхаймер. Мозъчен патол. 26, 607–617 (2016).
Garthwaite, J. Концепции за невронно предаване на азотен оксид. Евро. J. Neurosci. 27, 2783–2802 (2008).
Gu, C., Wu, L. & Li, X. Семейство IL-17: цитокини, рецептори и сигнализация. Цитокин 64, 477–485 (2013).
Tablazon, I. L. D., Al-Dabagh, A., Davis, S. A. & Feldman, S. R. Риск от сърдечно-съдови нарушения при пациенти с псориазис: настоящи и бъдещи. Am. J. Clin. Дерматол. 14., 1–7 (2013).
Liou, T.-H. и др. Риск от инсулт при пациенти с ревматизъм: общонационално надлъжно проучване, основано на населението. Sci. Представител. 4, 5110 (2014).
Ferro, J. M., Oliveira, S. N. & Correia, L. Неврологични прояви на възпалителни заболявания на червата. Дръжка. Clin. Неврол. 120, 595–605 (2014).
Marshall, O. et al. Нарушена мозъчно-съдова реактивност при множествена склероза. JAMA Neurol. 71, 1275–1281 (2014).
Парк, Л. и сътр. Scavenger рецептор CD36 е от съществено значение за мозъчно-съдовия оксидативен стрес и невро-съдова дисфункция, индуцирана от амилоид-бета. Proc. Natl. Акад. Sci. САЩ 108, 5063–5068 (2011).
Благодарности
Благодарим за подкрепата на фондация „Семейство Фейл“. Тази работа беше подкрепена от безвъзмездни средства от Националните здравни институти R37-NS089323 (CI) и 1R01-NS095441 (CI), от грант за развитие на учени от Американската асоциация за сърдечни заболявания (GF) и от безвъзмездна финансова помощ от Фондацията Leducq (Sphingonet) ( CI, JA, GF).
Информация за автора
Принадлежности
Институт за изследване на мозъка и ума на семейството Feil, Weill Cornell Medicine, Ню Йорк, Ню Йорк, САЩ
Джузепе Фарако, Дейвид Бреа, Лидия Гарсия-Бонила, Ганг Уанг, Джанфранко Ракуми, Хаеоо Чанг, Изаскун Буендия, Моника М. Сантистебан, Стивън Г. Сегара, Кенцо Койдзуми, Юкио Сугияма, Мишел Мърфи, Джоузеф Антератер и Костантино Иадекола
Катедра по радиология, Weill Cornell Medicine, Ню Йорк, Ню Йорк, САЩ
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Вноски
Дизайн на изследването: C.I., J.A. и Г.Ф. Провеждане на експерименти и получаване на данни: G.F., D.B., L.G.B., G.W., G.R., H.C., I.B., M.M.S., S.G.S., K.K., Y.S., M.M. и Х.В. Анализиране на данни: G.F., D.B., G.W., H.C., I.B., M.M.S. и К.К. Писане на ръкописа: Г.Ф. и C.I.
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
Авторите не декларират конкуриращи се финансови интереси.
Допълнителна информация
Бележка на издателя: Springer Nature остава неутрален по отношение на юрисдикционните претенции в публикувани карти и институционални принадлежности.
Интегрирана допълнителна информация
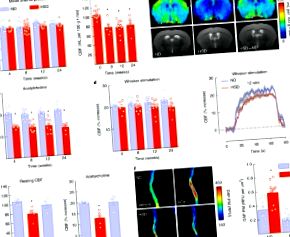
Допълнителна фигура 1 Ефект на HSD върху телесното тегло, енергийния прием, систоличното кръвно налягане, хипокампалната почивка CBF и CBF реакция на аденозин и мустакална стимулация.
A-C: HSD не променя MAP или CBF отговорите на стимулация на мустаци и аденозин при IL17 -/- и Rag1 -/- мишки, или при WT мишки, получаващи IL17 неутрализиращи антитела. IL17 -/-, MAP, Диета: p = 0.1864, Генотип: p = 0.2153; ND WT/IL17 -/- n = 5/4, HSD WT/IL17 -/- n = 8/6; Whisker, Диета: p = 0,5651, Генотип: p = 0,8474, WT/IL17 -/- n = 6/4, HSD WT/IL17 -/- n = 7/6; Аденозин, Диета: р = 0,8710, Генотип: р = 0,1652; WT/IL17 -/- n = 6/4, HSD WT/IL17 -/- n = 7/7 мишки/група. Rag1 -/-, MAP, диета: p = 0,0619, генотип: p = 0,4521; ND WT/Rag1 -/- n = 4/8, HSD WT/Rag1 -/- n = 8/10; Whisker, Диета: * p = 0,0094, Генотип: p = 0,5461, WT/Rag1 -/- n = 5/8, HSD WT/Rag1 -/- n = 8/8; Аденозин, Диета: р = 0,6543, Генотип: р = 0,7647; WT/Rag1 -/- n = 5/7, HSD WT/Rag1 -/- n = 8/9 мишки/група (двупосочен ANOVA и тест на Tukey). д: Прилагането на IL-17 при WT мишки не засяга MAP или увеличаването на CBF, произведено от аденозин; КАРТА: p = 0,7772 спрямо Veh; Veh/IL-17 п = 7-8/мишки; Аденозин: p = 0,7102 спрямо Veh; Veh/IL-17 n = 7-8/група мишки (несдвоен t-тест, двустранен). Данните са изразени като средна стойност ± SEM.
Допълнителна фигура 8 Ефект от изчерпването на мозъчните периваскуларни макрофаги и на FTY720 или Y27632 върху CBF отговорите при мишки, хранени с HSD.
A: Изчерпването на PVM от клодронат не подобрява ендотелната дисфункция при мишки, хранени с HSD диета; Диета: * p 0,05 срещу ND; Whisker, Диета: p = 0,5397, Лечение: p = 0,5804; ND Veh/Y27632 n = 6/6, HSD Veh/Y27632 n = 6/8; Аденозин, диета: р = 0,5712, лечение: р = 0,4964; ND Veh/Y27632 n = 6/6, HSD Veh/Y27632 n = 6/7 мишки/група (двупосочен ANOVA и тест на Tukey). Данните са изразени като средна стойност ± SEM.
Допълнителна фигура 9 Ефект на приложението на IL-17 върху фосфорилирането на eNOS в човешки мозъчни ендотелни клетки (HBEC.5i).
A: IL-17 (1-10 ng/mL) увеличава фосфорилирането на eNOS върху Thr495, ефект, отменен от прилагането на ROCK инхибитора Y27632 (5μM). * p = 0,0026; Превозно средство: IL-17 0 ng/ml n = 8; IL-17 1 ng/ml n = 7, IL-17 10 ng/ml n = 5; Y27632: IL-17 0-10 ng/ml n = 4 независими експеримента/група (еднопосочен ANOVA и тест на Tukey). B-D: HSD увеличава инхибиторното фосфорилиране на eNOS при Thr495 в изолирани пилални микросъдови препарати, изолирани от WT мишки и мишки, инжектирани с IgG контролно антитяло или носител. WT: * p = 0,0380 срещу ND; ND/HSD n = 3/6; IgG: * p = 0,0272 спрямо ND; ND/HSD n = 5/6; Veh: * p = 0,0177 срещу ND; ND/HSD n = 3/4 мишки/група (несдвоен t-тест, двустранен). Данните са изразени като средна стойност ± SEM. Имуноблотите в A, B, C и D се изрязват. Пълни гел снимки за имуноблоти са показани на допълнителна фигура 14.
Допълнителна фигура 10 Ефект на приложението на IL-17 и TNF-α върху нивата на иРНК на провъзпалителни медиатори в мозъчните ендотелни клетки (bEnd.3).
Клетките бяха дискриминирани чрез FSC-SSC затваряне и след това затворени за CD45 + CD4 + TCRγδ-IL17 + (Th17 клетки) или CD45 + CD4-TCRγδ + IL17 + (IL17 + γδ Т клетки).
Допълнителна информация
Допълнителен текст и фигури
Допълнителни фигури 1–15 и допълнителни таблици 1 и 2
- Диетичен прием на сол и смъртност при пациенти с диабет тип 2 грижи за диабет
- Диетична сол, тихият убиец Колко е твърде много
- Диетична сол, високо кръвно налягане и други вредни ефекти върху здравето - ScienceDirect
- Диетичната сол активира ендотелна богата на пролин тирозин киназа 2c-Src фосфатидилинозитол
- Влияние на хранителната добавка на сол върху растежа, оцеляването и използването на фуража на тилапия The Fish