От Отдела по нефрология (W.-Z.Y., K.A., P.W.S.), Медицински департамент и Катедра по физиология и биофизика (P.W.S.), Университет на Алабама в Бирмингам; и Медицинския център по въпросите на ветераните (P.W.S.), Бирмингам, Алабама.
От Отдела по нефрология (W.-Z.Y., K.A., P.W.S.), Медицински департамент и Катедра по физиология и биофизика (P.W.S.), Университет на Алабама в Бирмингам; и Медицинския център по въпросите на ветераните (P.W.S.), Бирмингам, Алабама.
От Отдела по нефрология (W.-Z.Y., K.A., P.W.S.), Медицински департамент и Катедра по физиология и биофизика (P.W.S.), Университет на Алабама в Бирмингам; и Медицинския център по въпросите на ветераните (P.W.S.), Бирмингам, Алабама.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
Въпреки че много лаборатории са показали, че приемът на NaCl (сол) с храната увеличава производството на NO при гризачи и хора, механизмът не е разкрит. В настоящото проучване са използвани фармакологични и доминиращо-отрицателни стратегии, за да се покаже, че храненето на формулирана диета, съдържаща повишени количества сол, на млади мъжки плъхове Sprague-Dawley индуцира образуването на ендотелен комплекс за сигнализация на клетки, който съдържа богата на пролин тирозин киназа, c-Src (известен също като pp60 c-src ) и фосфатидилинозитол 3-киназа. В условията на диета с високо съдържание на сол, богатата на пролин тирозин киназа 2 служи като скеле за активиране на фосфатидилинозитол 3-киназа, медиирана от c-Src. Фосфатидилинозитол 3-киназата е възходящият активатор на протеин киназа В (Akt), който е отговорен за фосфорилирането на ендотелната изоформа на плъхове на NO синтаза при S1176 и по този начин насърчава увеличаването на производството на NO. Комбинираните открития илюстрират решаващата роля на богатия на пролин тирозин киназа 2 - сигнализиращ комплекс в ендотелния отговор на приема на сол.
След първоначалното описание на ролята на NO 1 в реакциите на кръвното налягане на промените в приема на NaCl с храната (наричан „сол“ в тази статия), 1 следващи проучвания потвърждават, че увеличеният прием на сол увеличава производството на NO при гризачи 2–5 и здрави хора . 6 NO играе важна роля в хемодинамичния отговор на промените в приема на сол. Индуцираното от солта освобождаване на NO насърчава вазорелаксацията на аферентната артериола, 7 увеличава скоростта на гломерулна филтрация, 8 и подобрява кривата налягане-натриуреза, улеснявайки отделянето на сол. 9 Инхибирането на NO води до задържане на сол и чувствителна към сол хипертония 10 и, ако се проточи, води до бъбречно увреждане, особено ако животните са на диета с високо съдържание на сол. 11.
Доказано е прякото участие на ендотела в медиирането на производството на NO в отговор на диета с високо съдържание на сол. 12 Механизмът, чрез който приемът на сол увеличава производството на ендотелен NO, изглежда е иницииран чрез генериране на срязващи сили. 13–15 Ендотелната изоформа на NO синтаза, наречена в тази статия „NOS3“, е силно регулиран ензим, който се контролира от различни посттранслационни събития, които включват фосфорилиране на множество серинови и треонинови остатъци на NOS3. Въпреки че активността на NOS3 ензима зависи от свързването на калциев/калмодулинов комплекс с NOS3, измествайки автоинхибиторна верига и активираща функция, няколко лаборатории са показали, че напрежението при срязване също насърчава независимо от калция активиране на NOS3. 16,17 Настоящото мнение е, че активирането на калций/калмодулин на NOS3 е отговорно само за преходни увеличения на NO, докато други посттранслационни събития осигуряват по-продължително освобождаване на NO от NOS3. 18,19 По-специално, NOS3 може да служи като субстрат за протеин киназа В (Akt), който насърчава фосфорилирането на серин в остатък 1176 в карбоксилната крайна част на NOS3 и повишава чувствителността на NOS3 към калций/калмодулин и ензимна активност. 20.
Последните проучвания показват, че приемът на диетична сол активира богата на пролин тирозин киназа 2 (Pyk2). 21 Pyk2 (също обозначен като FAK2, CAK-ß, CADTK или RAFTK) е член на семейството на фокалната адхезия тирозин киназа. 22 Тази нерецепторна тирозин киназа обикновено се активира от извънклетъчни стресови сигнали, като срязващ стрес, 23 но също и от G-протеинови рецептори, като ангиотензин тип 1 рецептор. 22,24 Pyk2 има множество свързващи партньори, които включват c-Src, 60-kDa протеин на c-src (известен също като pp60 c-src ), фосфатидилинозитол 3-киназа (PI3-киназа) и Grb2. 22,25–27 Свързването с Pyk2 активира c-Src и PI3-киназата и този сигнален комплекс участва в различни вътреклетъчни процеси. 22,28 Тъй като PI3-киназата е активатор на Akt нагоре по веригата, настоящото проучване следователно е предназначено да определи дали увеличаването на състоянието на фосфорилиране на S1176 на NOS3 отчита увеличената ендотелна продукция на NO, което се случва в условията на повишена прием на сол и дали приемът на сол с диета индуцира комплекс Pyk2/c-Src/PI3-киназа, който от своя страна увеличава активността на NOS3 чрез активиране на Akt.
Методи
Подготовка на животни и тъкани
Проучвания за инкубация in vitro
След отстраняване на прилепналата мазнина и съединителната тъкан, тази аорта се нарязва на 3-милиметрови пръстеновидни сегменти и се поставя в плочки с 48 ямки. Изолираните гломерули (5 × 10 3 гломерула на милилитър), които се получават чрез пресяване на бъбречна кортикална тъкан, и препаратите на аортния пръстен се промиват със студен PBS. Пелетираните сегменти на гломерулите и аортния пръстен бяха ресуспендирани в среда без серум (DMEM; Invitrogen Corporation), която съдържаше само носител, 5 μmol/L тирфостин A9 (EMD Biosciences, Inc) или 10 μmol/L PP2 (EMD Biosciences, Inc ). Тирфостин А9 служи като инхибитор на Pyk2, 32 и РР2, 4-амино-5- (4-хлорофенил) -7- (т-бутил) пиразоло [3,4-д] пиримидин), е мощен, клетъчно пропусклив, селективен инхибитор на тирозин киназа от семейство Src. 33
Проучвания In Vivo
Анализи на коимунопреципитация
Проведени са проучвания на коимунопреципитация, за да се характеризира ефектът от приема на диетична сол върху взаимодействията между Pyk2 и PI3-киназа. Тъканните лизати, съдържащи 500 μg общ протеин, са получени от плъховете, използвани в проучванията in vivo и са инкубирани с 2 μg анти-Pyk2 поликлонално антитяло (Cell Signaling) при 4 ° C в продължение на 2 часа, последвано от добавяне на 30 μL протеин A-Sepharose и инкубация. Имунните гранули се промиват 3 пъти с ледено студен радиоимунопреципитационен буфер за анализ и след това се варят в пробен буфер на SDS, съдържащ дитиотреитол. Протеините се разделят на 7,5% SDS-полиакриламидни гелове и се прехвърлят в мембрани от поливинилиден флуорид. Мембраните бяха сондирани с антитела, насочени срещу 4 изоформи на каталитичната единица на PI3-киназа (p110α, p110β, p110γ и p110δ) и регулаторната субединица p85 (Upstate Chemicon). Имунореактивните ленти бяха визуализирани с използването на засилена хемилуминесценция.
Статистически анализ
Данните са изразени като средни стойности ± SE. Значителни разлики между наборите данни бяха определени от ANOVA с posthoc тестване (защитената най-малко значима разлика на Fisher; Statview 5.0, SAS Institute, Inc). P 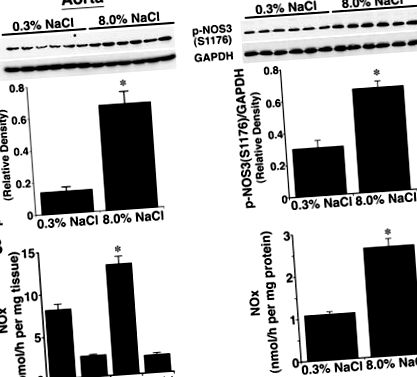
Фигура 1. Ефект от приема на диетична сол върху фосфорилирането на NOS3 при S1176, изразен като съотношение на плътността на фосфорилирания NOS3 към производството на GAPDH и NO. A, Western анализи с използване на лизати от аортни и изолирани гломерулни препарати. В съдовите тъкани, получени от плъхове на 8,0% NaCl диета, количеството на p-NOS3 (S1176) е по-голямо (P
Фигура 2. Ефект от интравенозното приложение на LY294002 върху p-NOS3 (S1176), изразен като съотношение на плътността на фосфорилирания NOS3: GAPDH. LY294002 намалява експресията на p-NOS3 (S1176) до нива, които не се различават от нивата на p-NOS3 (S1176) в съдовите тъкани, получени от плъхове на 0,3% NaCl диета. Всяка лента от геловете представлява лизат, получен от един плъх (п = 3 плъха във всяка група). *P
Активиране на NOS3 от хранителна сол, възникнала чрез механизъм, зависим от Pyk2/c-Src/PI3-киназа
Предишни проучвания показват, че хранителната сол индуцира фосфорилирането и активирането на ендотелен комплекс Pyk2/c-Src. 21 За да се провери дали тези ензими също участват в производството на NO по време на повишено поглъщане на сол, в първоначалните експерименти тъканни проби от плъхове и от двете диети се инкубират в среда, съдържаща тирфостин А9, инхибитор на Pyk2, 32 и PP2, инхибитор на c-Src, 33 и освобождаването на NOx в средата се определя количествено. И двата инхибитора намаляват производството на NOx от аортни сегменти и от изолирани гломерули (Фигура 3). След това беше използван доминиращо-отрицателен подход, за да се определи дали Pyk2 участва пряко в активирането на Akt. В деня преди проучването, 1,25 nmol Tat-AP, Tat-PBM и Tat-GBM протеини се прилагат IV на групи плъхове и при двете диети (Фигура 4). Въпреки че Tat-GBM не променя състоянието на фосфорилиране на Akt при T308 и S473 в аортни и гломерулни лизати от плъхове на 8,0% NaCl диета, както Tat-AP, така и Tat-PBM намаляват (P 21 комбинираните експерименти показват, че Tat-AP и Tat-PBM нарушават сигнален комплекс Pyk2/c-Src/PI3-киназа, който активира Akt. В други проучвания, както Tat-AP, така и Tat-PBM, но не и Tat-GBM, също намаляват относителните нива на p-NOS3 (S1176) в тъкани от плъхове на 8,0% NaCl диета (Фигура 6). Когато аортните пръстени и изолираните гломерули от плъхове на 8,0% NaCl диета бяха инкубирани in vitro, освобождаването на NOx в средата беше намалено от предварителното администриране на Tat-AP и Tat-PBM, но не и Tat-GBM, до нива, наблюдавани в съответните проби от плъхове на диета с 0,3% NaCl (Фигура 7). Съотношения на NOx в урината: креатинин, получени сутринта на експеримента, показват очакваното увеличение на NOx в урината в групите плъхове на 8,0% NaCl диета в сравнение с групата плъхове на 0,3% NaCl диета (Фигура 8). Парентералното приложение на Tat-AP и Tat-PBM намалява NOx: креатинин в урината до нива, които не се различават от наблюдаваните в групата плъхове, които са били на диета с 0,3% NaCl и са били лекувани самостоятелно с носител.
Фигура 3. Ефект от добавянето на тирфостин А (Tyr) и РР2 върху освобождаването на NOx в средата чрез аортни пръстени (отгоре) и изолирани гломерули (отдолу). Добавянето на Tyr и PP2 намалява (P
Фигура 4. Ефект от интравенозното приложение на Tat слетите протеини върху експресията на p-Akt (T308) и p-Akt (S473) спрямо Akt в аортни и гломерулни препарати. Общите нива на Akt не се различават сред тъканите, получени от 8-те групи плъхове (n = 4 плъха във всяка група) на 2-те NaCl диети. В сравнение с плъхове, които са получили превозно средство (Veh), администрирането на Tat-AP и Tat-PBM, но не и Tat-GBM, е намалено (P
Фигура 5. Ефект от интравенозното приложение на Tat слитите протеини върху асоциирането на Pyk2 с компоненти на PI3-киназа. След имунопреципитация на Pyk2 от лизати на аортната тъкан и изолирани гломерули на плъхове и при двете диети, гранулираните проби се разделят с помощта на SDS-PAGE и се изследват за p110α и p85. Интравенозното приложение на Tat-AP и Tat-PBM, но не и Tat-GBM, нарушава асоциирането на Pyk2 с p110α и p85 в проби, получени от плъхове на 8,0% NaCl диета, но не променя свързването с Pyk2 в лизати от плъхове на 0,3% NaCl диета. Всяка лента представлява данни от един плъх (n = 3 плъха във всяка група).
Фигура 6. Ефект от интравенозното приложение на Tat слитите протеини върху експресията на p-NOS3 (S1176) спрямо GAPDH в аортна тъкан и изолирани гломерули. Интравенозното приложение на Tat-AP и Tat-PBM, но не и на Tat-GBM, намалява експресията на p-NOS3 (S1176) до нива, които не се различават от групите плъхове на 0,3% NaCl диета. Всяко платно в гела представлява едно животно; Изследвани са 4 плъха във всяка група. *P
Фигура 7. Ефект от интравенозното приложение на слетите протеини Tat върху производството на NOx от аортни пръстени и изолирани гломерули (n = 4 плъхове във всяка група). Прилагането на Tat-AP и Tat-PBM, но не и на Tat-GBM, намалява производството на NOx от двете съдови тъкани до нива, които не се различават от скоростите на производство, наблюдавани при използване на съдови тъкани от плъхове на 0,3% NaCl диета. *P
Фигура 8. Ефект от интравенозното приложение на Tat фузионните протеини върху екскрецията на NOx с урината in vivo (n = 4 плъха във всяка група). Tat-AP и Tat-PBM намаляват нивата на NOx/креатинин до тези, наблюдавани при плъховете, които са получавали 0,3% NaCl диета. *P 0,05 спрямо групата, която е получила 0,3% NaCl диета и превозно средство (Veh).
Дискусия
Разгледано е разнообразието от посттранслационни събития, които променят активността на NOS3. 19,39 Сериновото фосфорилиране на аминокиселинен остатък 1176 в карбоксилната терминална част на NOS3 е особено важен регулатор на ензимната активност и чувствителността към калциево/калмодулиновото активиране. 20 Различни от Akt, AMP киназа, протеин киназа А, протеин киназа G и зависима от калций/калмодулин протеин киназа II са замесени в регулирането на състоянието на фосфорилиране на NOS3 на 1176. 19,39 Доказателствата за селективното участие на Akt в медиирано от сол фосфорилиране на NOS3 включва демонстрацията, че активирането на Akt и фосфорилирането на NOS3 са предотвратени чрез инхибиране на набирането и активиране на PI3-киназа от Pyk2 след увеличаване на приема на хранителна сол и LY294002 намалява p-NOS3 (S1176) нива при животни, получаващи 8,0% NaCl диета, до тези, наблюдавани при плъхове на 0,3% NaCl диета. Тъй като последното наблюдение предполага, че фосфорилирането през 1176 г. е достатъчно, за да обясни увеличаването на производството на NO, други посттрансляционни модификации на NOS3, като фосфорилиране на тирозин на NOS3 при T83, което също увеличава активността на NOS3 и се осъществява чрез c-Src, 40 не са изследвани.
Данните, демонстриращи повишено фосфорилиране на NOS3 при S1176 в гломерулите, противоречат на откритията на Mount et al, 5, които също показват, че производството на NOx се увеличава с увеличаване на хранителната сол, но не демонстрира увеличение на фосфорилирането на S1176 в бъбречните лизати. Техният нов метод за количествено определяне на NOS3 първоначално използва утаяване от цели бъбречни лизати, използвайки 2 ′, 5′-ADP Sepharose; освен техническите опасения, свързани с тази техника, техният подход за използване на бъбречни лизати потенциално прикрива промени в регионалната или локална експресия на p-NOS3.
Като позволи вътреклетъчното доставяне на нашите протеинови инхибитори без вирусни вектори, 41,42 използването на слети протеини Tat позволи допълнително тестване на хипотезата в условията in vivo. 21 Слитите протеини на Tat (Tat-AP, Tat-PBM и Tat-GBM) са проектирани да възпрепятстват специфично свързването на Pyk2 с c-Src, p85 и Grb2, съответно. Няколко лаборатории независимо демонстрират ефикасността на тези инхибитори. 21,43,44 Добавянето на Tat-AP и Tat-PBM инхибира свързването на p85 и p110α с Pyk2 и последващо активиране на Akt и фосфорилиране на NOS3. Една от интерпретациите на тези данни е, че свързването на c-Src с Pyk2, което се осъществява чрез SH3 домейна на c-Src, 45,46 е от съществено значение за свързването с Pyk2 и активирането на PI3-киназата. Данните бяха в съответствие с констатациите на Taniyama et al, 28, които демонстрираха, че активираният Pyk2 служи като скеле за насърчаване на c-Src-зависимата активация на PI3-киназа. Данните, генерирани с помощта на Tat-GBM, показват, че не е имало роля за Grb2 в производството на NO, предизвикано от храната, и допълнително разрешено използване на Tat-GBM като допълнителен контрол за експериментите на Tat фузия на протеини.
Перспективи
Източници на финансиране
Безвъзмездна помощ от Националните здравни институти (R01 DK46199) и Службата за научни изследвания и развитие, Служба за медицински изследвания, Департамент по въпросите на ветераните, подкрепиха това изследване.
- Диетична сол, високо кръвно налягане и други вредни ефекти върху здравето - ScienceDirect
- Диетична сол
- Диетичната сол насърчава невроваскуларната и когнитивната дисфункция чрез иницииран от червата отговор TH17
- Диетична сол, тихият убиец Колко е твърде много
- Влияние на хранителната добавка на сол върху растежа, оцеляването и използването на фуража на тилапия The Fish
