Джоузеф П. Закулар
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
Джесика Л. Мур
2 Катедра по химия, Университет Вандербилт, Нешвил, Тенеси, САЩ
3 Изследователски център за масова спектрометрия, Университет Вандербилт, Нешвил, Тенеси, САЩ
Ашли Т. Джордан
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
Lillian J. Juttukonda
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
Майкъл Дж. Ното
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
4 Катедра по медицина, Университет Вандербилт, Нашвил, Тенеси, САЩ
Марибет Р. Никълсън
5 Катедра по педиатрия, Университет Вандербилт, Нешвил, Тенеси, САЩ
Джонатан Д. Крюс
6 Катедра по педиатрия, Медицински колеж Baylor, Хюстън, Тексас, САЩ
Матю В. Семлер
4 Катедра по медицина, Университет Вандербилт, Нешвил, Тенеси, САЩ
Яофанг Джанг
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
Лотарингия Б. Изделия
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
4 Катедра по медицина, Университет Вандербилт, Нешвил, Тенеси, САЩ
М. Кей Вашингтон
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
Уолтър Дж. Чазин
2 Катедра по химия, Университет Вандербилт, Нешвил, Тенеси, САЩ
7 Катедра по биохимия, Университет Вандербилт, Нашвил, Тенеси, САЩ
8 Център за структурна биология, Университет Вандербилт, Нашвил, Тенеси, САЩ
Ричард М. Каприоли
2 Катедра по химия, Университет Вандербилт, Нешвил, Тенеси, САЩ
3 Изследователски център за масова спектрометрия, Университет Вандербилт, Нешвил, Тенеси, САЩ
7 Катедра по биохимия, Университет Вандербилт, Нашвил, Тенеси, САЩ
9 Катедра по фармакология, Университет Вандербилт, Нашвил, Тенеси, САЩ
Ерик П. Скаар
1 Катедра по патология, микробиология и имунология, Медицински факултет на Университета Вандербилт, Нешвил, Тенеси, САЩ
10 системи за здравеопазване в долината на Тенеси, Министерство на ветераните на САЩ, Нешвил, Тенеси, САЩ
Свързани данни
Резюме
C. difficile е спорообразуваща грам-положителна бактерия, която причинява редица стомашно-чревни разстройства с различна тежест от диария до колит 5. Трансмисивната спора на C. difficile е изобилна в здравните заведения и устойчива на дезинфектанти, което я прави основен вътреболничен патоген 5-7. Основният рисков фактор за CDI е употребата на антибиотици, която намалява устойчивостта на колонизация към C. difficile чрез промяна на чревната микробиота 3,8,9. Случаите на CDI, които не са свързани с антибиотици и са придобити в общността, се увеличават, което предполага, че други фактори на гостоприемника и околната среда влияят на чувствителността към C. difficile 4. Един от най-важните фактори на околната среда, влияещ върху чревната микробиота и потенциално податливост към CDI, е диетата 10. По-конкретно, диетичните метали са свързани с податливостта към многобройни инфекции 11. Наличността на метали е критичен фактор, влияещ върху резултата от взаимодействията между гостоприемника и патогена и нивата на металите варират значително в зависимост от диетата на гостоприемника и експозицията на околната среда 12. Тук се опитахме да проучим въздействието на диетата на Zn и Zn върху чувствителността и тежестта на CDI.
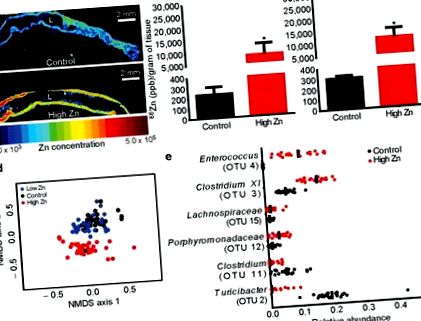
За да се определи въздействието на диетичния Zn върху CDI, диети, които не съдържат Zn (диета с ниско Zn; 0 mg/kg Zn), нормално Zn (контролна диета; 29 mg/kg Zn) или излишък Zn (диета с високо Zn; 1000 mg/kg Zn) са синтезирани. Диетата с високо съдържание на Zn е създадена, за да моделира излишните добавки на Zn при хора, с приблизително 12 пъти нивото на Zn при стандартна чау мишка (LabDiet 5K52/5K67; LabDiet 5100). Мишките бяха хранени с променени Zn диети в продължение на пет седмици, през които не бяха наблюдавани признаци на токсичност. Мишките, хранени с диета с високо съдържание на Zn, са имали повишени нива на Zn в цекалната и дебелочревната тъкан и изпражненията (Фигура 1а-в; Допълнителна Фигура 1а). За разлика от това, мишките, хранени с диета с ниско съдържание на Zn, имат значително намалени нива на Zn в тези отделения (допълнителна фигура 1а). Тези открития демонстрират, че промените в диетата на Zn влияят върху нивата на Zn в цекулите и дебелото черво.
CFU анализ за щам C. difficile> R20291 след лечение с ниско ниво на цефоперазон (0,01 mg/ml цефоперазон) и орален сонда с 10 5 спори (а) (n = 9/група). Плътните ленти представляват средна колонизация. Слепи хистологични резултати, количествено определени четири дни след лечение с ниско ниво на цефоперазон и инфекция с> R20291 (б) (n = 9/група). Обратно разнообразие на Симпсън за мишки, хранени с контрол или диети с високо Zn след високо ниво (0,5 mg/ml) (високо Abx; n = 5/група) или ниско ниво (0,01 mg/ml) (ниско Abx; n = 4/контрол диета; n = 5/високо Zn диета) лечение с цефоперазон (° С). Данните за хистологията и разнообразието са представени като средно ± стандартно отклонение. * P 23–26. Освен това нивата на фекален калпротектин предсказват тежестта на заболяването при възрастни с CDI 27,28. За допълнително изясняване на връзката на калпротектин с CDI, фекалният калпротектин е измерен при двадесет и пет педиатрични пациенти с CDI. Фекалните нива на калпротектин са значително по-високи при педиатрични пациенти, които показват признаци на тежка CDI (допълнителна таблица 1). Освен това, повишеният серумен калпротектин е свързан с повишена тежест на заболяването при четиридесет и осем възрастни с CDI (Фиг. 4а). Ролята на калпротектина по време на CDI обаче все още не е проучена.
Колективно тези данни разкриват, че диетичният Zn играе важна роля в модулирането на чревната микробиота и Zn-медиираните промени в структурата на микробната общност намаляват прага на антибиотиците, необходими за осигуряване на чувствителност към CDI. В допълнение, повишените нива на Zn усилват тежестта на заболяването, свързано с C. difficile, а калпротектинът е важен за борба с C. difficile чрез ограничаване на наличността на Zn. Това проучване подобрява нашето разбиране за факторите на околната среда и гостоприемника, свързани с CDI. Освен това тези открития предоставят основата за формиране на бъдещи стратегии за превенция и лечение на CDI. Промяната в диетата и ограничаването на излишния прием на Zn може да се окаже ефикасно за предотвратяване на CDI при високорискови пациенти и да помогне за ограничаване на заболеваемостта по време на CDI.
Онлайн материали и методи
Мишовъдство и модел на инфекция с C. difficile
Диетична модулация
Диети, съдържащи променени нива на метали, са синтезирани от Dyets Inc., като се използва стандартизираната диета AIN-93M 30. За да се сведе до минимум замърсяването с метали, тази дефинирана от L-аминокиселина AIN-93M диета е формулирана като диета без Zn и е допълнена следната концентрация на Zn: контролна диета: 29 mg/kg; диета с ниско Zn: 0 mg/kg; диета с високо съдържание на Zn: 1000 mg/kg. Zn се добавя като карбонатни соли, както е посочено в диетата AIN-93M 30. Мишките са хранени с променена Zn диета, започвайки от четири седмична възраст и диетите се поддържат в продължение на пет седмици преди инфекцията и през целия ход на инфекцията. За всяко отделно диетично лечение паралелно бяха пускани две клетки с мишки от отделни кучила. Количеството на консумираната диета се наблюдава и всяка група се претегля по време на хода на манипулацията с диетата, за да се следи за заболяване. Всяка група консумира еднакви количества диета и не показва признаци на заболяване, свързано с диетичната модулация.
Количествено определяне на бактериалната тежест
C. difficile колониеобразуващи единици (CFU) бяха определени по време на протичането на инфекцията с помощта на фекални проби и в крайната точка на инфекцията, използвайки цекално съдържание. Пробите бяха разредени в PBS и поставени върху таурохолат циклосерин цефокситин фруктозен агар (TCCFA) за количествено определяне на тежестта на C. difficile. Проби от изпражнения от мишки, лекувани с антибиотици, се поставят върху TCCFA преди инфекцията, за да се гарантира, че мишките са били с отрицателна култура на C. difficile преди инфекция със спори. Количествените тежести в черния дроб са количествено определени в крайната точка на инфекцията. Чернодробни животни се събират от мишки по време на аутопсия и се хомогенизират в 1 ml стерилен PBS. Чернодробните хомогенати се разреждат последователно в PBS и се поставят паралелно върху 5% овча кръв и плочи от агари Luria-Bertani при аеробни и анаеробни условия. След растеж през нощта CFUs бяха количествено определени и отделни колонии бяха изолирани. Геномна ДНК беше извлечена от всеки сорт и 16S rRNA гена беше секвениран за идентификация, използвайки 27F и 1492R универсални 16S rRNA генни праймери.
Хистологичен анализ
При аутопсия бяха събрани цека и дебелото черво, фиксирани в 10% разтвор на формалин и вградени в парафин. Секции бяха оцветени с хемотоксилин и еозин. Всяка секция получи оценка на болестта от патолог по заслепен начин въз основа на предварително описани критерии 18. Хистологичните резултати са докладвани като кумулативен резултат от три независими критерия за оценка: възпаление, оток и увреждане на епителните клетки.
Анализ за цитотоксичност на токсина C. difficile
Специфичната цитотоксичност на токсина на C. difficile се определя, като се използва анализ на цитотоксичност на закръгляване на клетки на бъбреци от зелена африканска маймуна (Vero) 18,31. Накратко, пресни фекални проби се нормализират до тегло, хомогенизират се в стерилен PBS и се гранулират при 13 000 х g. Десеткратни серийни разреждания на супернатантите се добавят към еднослойни клетки на Vero и се оценява закръгляването на клетките за всяко разреждане. Присъствието на токсин А и токсин Б дифицил се потвърждава чрез неутрализиране на закръгляването на клетките с комбиниран антитоксин (токсин А и токсин В) антисеруми (Techlab, cat # T5000). Данните за цитотоксичност се изразяват като log-ten реципрочна стойност на най-високото разреждане, което закръгля 100% от клетките Vero.
Количествено определяне на цитокините
Анализ на цитокини се извършва на мишки преди инфекция (п = 5/група) и 2 дни след инфекция (п = 5/група) с щам C. difficile> R20291. При аутопсия, цялата цеца от мишки, хранени с променени Zn диети, се замразява бързо в течен азот и се замразява при -80 ° C. Ceca се размразява, старателно се хомогенизира в 1 ml Pierce IP Lysis Buffer (Thermo Scientific) и се гранулира при 4 ° С. Супернатантите бяха събрани и нормализирани до общото съдържание на протеин с помощта на Pierce BCA Protein Assay Kit (Thermo Scientific). Нивата на цитокини бяха измерени с помощта на панел с магнитни топчета Milliplex MAP Mouse Cytokine/Chemokine (Millipore) и платформата Luminex Flexmap 3D (Luminex).
Подготовка на тъканни срезове за масова спектрометрия
За приготвяне на ICP-MS, всяка цекума или дебелото черво се отстранява асептично, промива се съдържанието и незабавно се замразява бързо в епруветки без метал. Пробите се усвояват в азотна киселина клас Optima и се нагряват, докато се постигне пълно усвояване. Пробите се разреждат в Milli-Q ултрачиста вода преди ICP-MS анализ. За LA-ICP-MS пробите от дебелото черво се промиват от цялото съдържание и се пълнят с 25% съединение с оптимална температура на рязане (OCT) (Tissue-Tek) и след това се замразяват в 100% OCT. Ceca бяха разделени на дебелина 30 μm, използвайки Leica CM 3050S Cryostat (Leica Microsystems, Bannockburn, IL) и монтирани върху охладени с алитратна киселина измити с полилизин покрития с винил. За MALDI IMS тъканите бяха събрани пресни и замразени в 25% ОСТ с цялото съдържание непокътнато. Ceca бяха разрязани с дебелина 10 μm и монтирани на размразяване върху охладени стъкла с покритие от индий-калаен оксид (Delta Technologies, Loveland, CO).
Масова спектрометрия
ДНК екстракция и 16S rRNA генно секвениране
Анализ на чревната микробиота
Последователностите бяха групирани в OTU въз основа на 3% прекъсване на разстоянието, изчислено с помощта на алгоритъма за среден съсед. Всички последователности бяха класифицирани с помощта на обучителния набор RDP (версия 9) и на OTU беше присвоена класификация въз основа на таксономията, която имаше консенсус на мнозинството от последователностите във всяка OTU, използвайки наивен байесов класификатор 37. Поредиците, които са били свързани към OTU, класифицирани като Clostridium XI, са били индивидуално класифицирани и са потвърдени, че не са C. difficile членове на рода Clostridium XI. Микробното разнообразие (алфа-разнообразие) беше изчислено с помощта на обратния индекс на Симпсън 38. Видовото богатство беше изчислено с помощта на Sobs (наблюдавани OTU) 34. β-разнообразието се изчислява, като се използва метриката за разстояние θYC с данни за честотата на OTU 39 .
16S рРНК ген qPCR анализ
Относителното бактериално натоварване в чревната микробиота на мишки, хранени с променени Zn диети, беше измерено, използвайки универсални 16S rRNA ген qPCR праймери (F, ACTCCTACGGGAGGCAGCAGT; R, ATTACCGCGGCTG CTGGC) 40. Пробите се нормализират, за да приемат ДНК, като се използват TNFa генни праймери (F; GGCTTTCCGAATTCACTGGAG; R, CCCCGGCCTTCCAAATAAA) 3. qPCR се извършва върху геномна ДНК, изолирана от изпражнения, като се използва IQ SYBR Green Supermix (Bio-Rad). Имайте предвид, че qPCR измерва относителната промяна на броя на копието на гена 16S rRNA в проба, а не общия брой на бактериите.
Растеж в присъствието на рекомбинантен калпротектин
Кривите на растеж на C. difficile се провеждат след разреждане 1:50 за една нощ> R20291 или 630 култури. Рекомбинантният калпротектин се добавя в среда при определени концентрации. Средата се състои от 50% калпротектинов буфер и 50% BHIS, допълнен с 3 тМ калциев хлорид 25. Използва се мутант на свързване на Zn и Mn с инактивиращи мутации в двете места за свързване на калпротектин с метал 41, както е посочено. Кривите на растежа се определят количествено, като се използва оптична плътност (OD600) при 37 ° С при аноксични условия. Растежната среда беше допълнена с Zn (10 ZnCl2), Mn (MnCl2) или Fe (II) (FeSO4), за да се оцени спасяването на растежа. Добавянето на метална среда към средата се извършва непосредствено преди добавяне на C. difficile и инкубация за растеж. Всяка крива на растеж беше извършена поне три независими пъти и бяха избрани представителни криви на растеж.
Измерване на калпротектин при хора
Серумен калпротектин
Фекален калпротектин
Нивата на фекален калпротектин са измерени при двадесет и пет педиатрични пациенти с диагноза CDI. Субектите бяха записани в две детски болници с висше образование (Детска болница Monroe Carrell Jr., Нешвил, Тенеси и Тексаска детска болница, Хюстън, Тексас). Институционалните съвети за преглед на участващите институции прегледаха и одобриха проучването (IRB 130315). Получено е съгласие от всички субекти в проучването. Използвани са болнични лабораторни записи за идентифициране на лица, които са имали положителни тестове за C. difficile по време на диагностицирането. И двете болници използват молекулярни тестове за изследване на изпражненията за наличие на токсигенна C. difficile. Деца на възраст от дванадесет месеца до осемнадесет години с CDI бяха допустими за записване. CDI се определя като положителен диагностичен тест за C. difficile и диария. Субектите бяха изключени от проучването, ако алтернативен ентеропатоген беше идентифициран чрез рутинно клинично тестване, поискано от първичния медицински екип. Фекалните проби се размразяват, нормализират се към теглото и се измерва фекален калпротектин с помощта на Calprotectin ELISA Assay Kit (Eagle Biosciences, Nashua, NH).
Статистика
Допълнителен материал
Благодарности
Благодарим на P. Schloss и J. Sorg за критичните отзиви за това проучване и D. Aronoff и S. Walk за предоставяне на щамове C. difficile. Това изследване беше подкрепено от награда за оценка на заслугите # 1I01BX002482 от Министерството на ветераните по въпросите на САЩ (САЩ), NIH R01 AI101171 и P41 GM103391-05, както и от гранта на Центъра за изследване на храносмилателната болест на Vanderbilt (VDDRC) # P30DK058404. J.P.Z. се поддържа от T32DK007673 и F32AI120553. J.L.M. се поддържа от T32GM065086. М.Р.Н. е подкрепена от наградата за ранна кариера на Thrasher Research Fund.
Бележки под линия
Кодове за присъединяване
NCBI SRA: SRP067079.
Принос на автора
J.P.Z. и Е.П.С. проектира експерименти и пише ръкопис с принос от съавтори. J.P.Z. извършва експерименти с животни и съответни анализи и анализи с помощта на A.T.J. J.P.Z. извършени анализи на общността на микробиоти. L.J.J. проектирани променени метални диети. J.L.M. и R.M.C. извършени MALDI-MS изображения и съответни анализи. Y.Z. и R.M.C. извършена ICP-MS. M.K.W. извършени хистологични анализи. W.J.C. подпомаган при анализи на калпротектин. М.Р.Н. и J.D.C. записва педиатрични пациенти и събира фекални проби. M.W.S., M.J.N. и L.B.W. събира серум за възрастни и подпомага анализи на експерименти с калпротектин.
Конкуриращи се финансови интереси
Авторите не декларират конкурентен финансов интерес.
- Диетична терапия за колонизация на клостридий дифицил Серия от случаи - PubMed
- Диетичните добавки с микрокапсулирана смес от органични киселини и растителни продукти променят
- Ефекти на хранителния инулин и артишок от Йерусалим (Helianthus tuberosus) върху чревната микробиота
- Пълна статия Диетична дестабилизация на баланса между микробиотата и слузта на дебелото черво
- Фракционната абсорбция на цинк за мъже, жени и юноши е надценена в настоящата диета