Субекти
Допаминът е важен невротрансмитер с основни роли в контрола на движението и забележимостта, както и последиците при пристрастяването, както и загуба на тегло, намален прием на храна и намален мотивационен стремеж към ядене. Folgueira et al. сега демонстрират, че допаминът причинява загуба на тегло и повишава температурата на кафявата мастна тъкан чрез активиране на допаминовия рецептор D2R в хипоталамусните GABA-експресиращи неврони при мишки, а лечението с допаминовия агонист каберголин причинява загуба на тегло при хората.
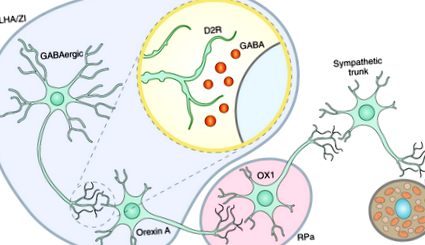
Folgueira et al. показват, че допаминът повишава температурата на кафявата мастна тъкан (НДНТ) чрез сигнализиране за орексин, път, участващ в регулирането на състоянията на сън и възбуда 1. Преди това е показано, че активирането на невроните на страничната хипоталамусна област (LHA) повишава температурата на НДНТ чрез разпространение на сигнали към raphe pallidus (RPa) в задния мозък 2,3. Дорзомедиалният хипоталамус също е демонстрирал силни проекции за контрол на НДНТ, които преминават през RPa. Folgueira et al. са установили, че активирането на D2R в LHA или zona incerta (ZI), но не и в дорзомедиалния хипоталамус, повишава температурата на НДНТ 3. По-рано беше демонстрирано, че орексин А повишава температурата на НДНТ чрез активиране на неврони в RPa и симпатиковата нервна система 3,4. D2R активирането в LHA и ZI действа директно чрез GABA (γ-аминомаслена киселина) -експресиращи неврони, но изисква непокътнат орексинов път, за да промени температурата на НДНТ 5 .
Тези открития подчертават потенциалните невронни пътища, през които D2 може да регулира температурата на НДНТ и следователно енергийните разходи и в крайна сметка телесното тегло. D2R активирането инхибира активността на GABAergic невроните и от своя страна активира невроните Orexin A в LHA и ZI. Сигналът Orexin A се разпространява чрез RPa до симпатиковия ствол и върху BAT клетките, като по този начин се насърчава термогенезата и потенциалното усвояване на глюкозата (фиг. 1). Увеличението на усвояването на глюкоза може също да обясни благоприятните ефекти на бромокриптин, D2R агонист, върху глюкозния толеранс при хора с диабет тип 2.
D2R на GABAергичните неврони в LHA се дезинхибират чрез активиране на D2R, като по този начин причиняват повишена активност на орексин А чрез RPa към симпатиковия ствол и BAT. OX1, орексин 1.
Авторите също потвърждават този път при хора, лекувани с допаминови агонисти, които са били използвани за лечение на болестта на Паркинсон, синдрома на неспокойните крака и пролактиномите. Бромокриптин, утвърден допаминов агонист, също е одобрен от Американската администрация по храните и лекарствата за лечение на диабет тип 2 при възрастни, но страничен ефект на допаминовите агонисти е намаляването на приема на храна. Съответно се препоръчва кокаин, амфетамин и метилфенидат, които повишават нивата на допамин в мозъка, да предизвикат анорексия и загуба на тегло 6 .
Въпреки че тези находки са обещаващи за лечение на затлъстяване, трябва да се имат предвид и потенциалните странични ефекти на тези агонисти. Бромокриптинът и каберголинът са преки агонисти на допаминовите рецептори и изглежда, че им липсва силен потенциал за злоупотреба. Индиректните допаминови агонисти обаче включват някои от най-пристрастяващите лекарства, а именно амфетамин и кокаин. По този начин оценката на потенциала за злоупотреба и отговорността за пристрастяване при дългосрочни изпитвания, тестващи допаминови агонисти като лечение за отслабване при пациенти с наднормено тегло и затлъстяване, ще бъде от основно значение. Интересното е, че клиничният опит с допаминови агонисти при болестта на Паркинсон е причина за известен оптимизъм относно относителната безопасност на този клас лекарства.
В обобщение, Folgueira et al. използва различни конвергентни методи и стигна до заключението, че активирането на D2R в LHA и ZI GABAergic невроните насърчава BAT термогенезата при мишки. Тези открития предоставят основа за разбиране на невронните пътища, през които се проявява този ефект, и демонстрират клинична значимост, като показват повишен енергиен разход и загуба на тегло при лечение с допамин-агонист при хора. Това проучване предоставя добре дошло допълнение към разбирането на невронния контрол на енергийната хомеостаза.
Препратки
Cerri, M. & Morrison, S. F. Неврология 135, 627–638 (2005).
Tupone, D., Madden, C. J., Cano, G. & Morrison, S. F. J. Neurosci. 31, 15944–15955 (2011).
Martins, L. et al. Представител на клетката. 16., 2231–2242 (2016).
Zhang, X. & van den Pol, A. N. Наука 356, 853–859 (2017).
Davis, C. et al. Международна J. Невропсихофармакол. 15, 181–187 (2012).
- Интелигентно отслабване Хитозан с глюкоманан Отзиви 🍹 Усилвател на метаболизма Потискащ апетита
- PEMF за отслабване, стимулиращи метаболизма; Отслабване с PEMF
- Девет храни, които увеличават метаболизма Фитнес Отслабване
- Артрозата възможност за насърчаване на загуба на тегло с пациенти - NPS MedicineWise
- Засилвайте метаболизма си за максимална загуба на тегло - Орехово езеро OBGYN