Резюме
Обективен: Да се разбере ефектът на затлъстяването и инсулина върху имунните функции при неинсулинозависим захарен диабет (NIDDM).
Предмет: Четиринадесет затлъстели NIDDM (индекс на телесна маса (BMI) = 30,6 ± 1,1), седем NIDDM с наднормено тегло (BMI = 24,2 ± 0,5) и пет затлъстели без NIDDM (BMI = 28,3 ± 0,67).
Интервенции: Първо изследвахме влиянието на инсулина върху пролиферацията на няколко човешки клетъчни линии. Второ, сравнихме няколко имунни функции между затлъстели и затлъстели NIDDM и пациенти със затлъстяване, които не бяха NIDDM, използващи мононуклеарни клетки от периферна кръв.
Резултат: Инсулинът намалява пролиферацията на Т-клетъчни линии, но не и тази на други видове клетъчни линии. Освен това, затлъстяването увеличи производството на IL-1β, който може да има цитотоксичност срещу островни β клетки в NIDDM.
Заключение: Нашите данни показват, че патофизиологията на NIDDM може да бъде повлияна от промяната на имунитета поради затлъстяване, а лечението на затлъстяването при NIDDM може да е важно от имунологичен аспект.
Въведение
Съобщава се, че няколко имунни функции не са регулирани при затлъстяване (Tanaka et al, 1993; Nieman et al, 1999). В проучванията на затлъстели индивиди и генетично затлъстели животни броят на лимфоцитите и пролиферативните отговори са по-ниски, отколкото в контролите (Tanaka et al, 1993, 1998; Nieman et al, 1999). Също така докладвахме, че цитокиновият баланс е променен при индуцирани от диета затлъстели мишки (Mito et al, 2000). Механизмът и факторите, влияещи върху нарушения имунитет при затлъстяване, обаче не са напълно изяснени.
Въпреки че пациентите с неинсулинозависим захарен диабет (NIDDM) често са със затлъстяване, имунната функция при NIDDM със затлъстяване не е изследвана. Много метаболитни и ендокринологични фактори могат да бъдат променени от затлъстяването, като инсулин, лептин или кортикостерон, които могат да повлияят на имунните функции (Hunt & Eardley, 1986; Brinkmann & Kristofic, 1995; Loffreda et al, 1998; Lord et al, 1998; Martin -Romero et al, 2000). Инсулинът е важен фактор както при NIDDM, така и при затлъстяването, но ролята на инсулина върху имунната система не е ясна при тези състояния.
Интер левкин (IL) -1β, секретиран от различни имунни клетки, е един от важните медиатори, регулиращи отговора на гостоприемника към възпаление и имунитет (Dinarello, 1984; Dinarello & Mier, 1987). Тъй като този цитокин е цитотоксичен за β-клетките, произвеждащи инсулин (Mandrup-Poulsen et al, 1986), ние изследвахме промяната в производството на IL-1β в NIDDM със затлъстяване.
Целта на това проучване е да изследва ефекта на инсулина върху имунните клетки инвитро, и промяната на пролиферативния отговор и производството на IL-1β на PBMC при пациенти със затлъстяване с NIDDM, за да се изясни ефектът на затлъстяването върху имунитета при NIDDM. Това е ново проучване за справяне с имунологичната разлика между пациентите със затлъстяване и затлъстяване с NIDDM.
Материали и методи
Изследване на човешки клетъчни линии
Пролиферативни реакции на клетъчни линии
В това проучване са използвани човешки левкемични клетъчни линии, HUT-102 и MOLT-4 (Т-клетки), RAJI (В-клетки) и U937 (моноцити). Клетките се поддържат в среда RPMI-1640 (NISSUI, Токио, Япония), съдържаща 10% топлинно инактивиран фетален телешки серум (JRH, Lenaxa, Австралия). Пролиферацията на тези клетки беше изследвана чрез метод на 3- (4,5-диметилтиазол-2-ил) -2,5-дифенил тетразолиев бромид (MTT) след инкубация в продължение на 72 часа (Mito et al, 2000) с инсулин (0, 0,01, 0,1, 1, 10, 100 или 1000 ng/ml). След добавяне на разтвор на МТТ (200 μg/ml), клетките се инкубират в продължение на 3 часа при 37 ° С в 5% атмосфера на CO2. Образуването на МТТ-формазон продукт се разтваря чрез добавяне на 10% SDS – 0,01 N НС1. Оптичната плътност на всяка ямка беше измерена с помощта на тестови и референтни дължини на вълните от 550 и 650 nm. Времето за култивиране на клетките за максимален отговор и броя на клетките се определят преди анализа и не се различава между клетъчните линии.
Проучване на пациенти с хора
Субекти
Четиринадесет пациенти със затлъстяване и седем пациенти със затлъстяване с NIDDM и пет пациенти със затлъстяване без NIDDM са включени в проучването. Всички пациенти са жени. Продължителността на заболяването не се различава при затлъстяване и затлъстяване NIDDM. Всички пациенти с един NIDDM са лекувани с перорални антидиабетни средства. Клиничните профили на пациентите са обобщени в таблица 1. Получено е информирано съгласие от всеки пациент.
Подготовка на клетките
Кръвните проби се обработват незабавно за анализ след събирането. Мононуклеарни клетки от периферна кръв (PBMC) бяха изолирани от хепаринизирана кръв чрез центрофугиране с градиент на плътността с HISTOPAQUE-1077 (Sigma, Сейнт Луис, МО, САЩ).
PBMC се регулират до плътност от 10 6 клетки/ml със среда RPMI-1640, съдържаща 5% инактивиран фетален телешки серум, L -глутамин (2 mM, GIBCO, Grand Island, NY, САЩ), пеницилин (100 U/ml, GIBCO), стрептомицин (100 μg/ml, GIBCO) и култивиран със или без фитохемаглутинин (PHA; 1 μg/ml, DIFCO, Детройт, Мичиган, САЩ), в продължение на 48 или 72 часа при 37 ° C при 5% CO2 атмосфера.
Пролиферативни реакции на PBMC
След 72 часа култивиране, пролиферативният отговор на РВМС се измерва чрез MTT анализ (Mito et al, 2000). Данните се изразяват като съотношение на абсорбцията на стимулирани от митоген култури към абсорбцията на нестимулирани култури (наричани индекс на стимулация). Времето за култивиране на PBMC за максимален отговор беше определено преди анализа и не се различаваше между три групи.
Производство и измерване на цитокини
Супернатантите на PBMC се събират след 48 h култивиране, центрофугират се и се съхраняват при -30 ° C до анализ. За измерване на продукцията на цитокини се провеждат ензимно-свързани имуносорбентни анализи (ELISA) върху супернатанти на култура. За измерване на IL-1β е използван комплект ELISA (Otsuka, Токио, Япония). Обхватът на ELISA анализа, използван в това проучване, е 15,6–500 pg/ml. Оптималното време за инкубация на PBMCs за производството на цитокини беше определено преди анализа.
Статистически анализ
Резултатите са дадени като средни стойности ± s. Направени са статистически сравнения между три групи пациенти по параметри на клиничните профили, пролиферативните отговори на лимфоцитите и производството на цитокини от PBMCs, използвайки ANOVA, и всяка група е сравнена с останалите чрез защитения най-малко значим тест на Fisher.
Резултати
Изследване на човешки клетъчни линии
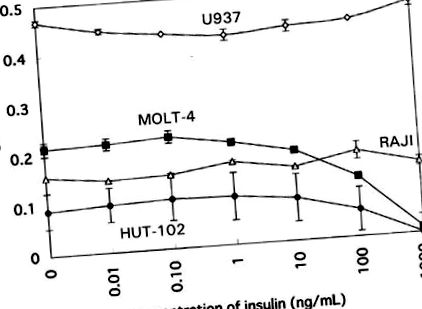
В човешките клетъчни линии високите концентрации на инсулин (> 10–100 ng/ml) потискат пролиферацията само на Т-клетъчни линии, като MOLT-4 и HUT-102. Потискането зависи от дозата при концентрацията от 10 ng/ml. Пролиферацията на В-клетъчната линия (Raji) или моноцитната клетъчна линия (U937) не се влияе от никаква концентрация на инсулин (Фигура 1). Тези открития могат да предполагат селективна чувствителност на Т-клетъчните линии към инсулин.
Ефект на инсулина върху пролиферативния отговор на човешките клетъчни линии, HUT-102, MOLT-4, U937 и RAJI.
Проучване на пациенти с хора
Клиничен профил
Клиничният профил на три групи (затлъстели NIDDM, затлъстели NIDDM и затлъстели не-NIDDM пациенти) е показан в таблица 1. В сравнение с затлъстелите NIDDM, затлъстелите NIDDM и затлъстелите не-NIDDM имат значително по-висок индекс на телесна маса (ИТМ) и по-голямо тегло. Установени са високи нива на HbA1c и в двете NIDDM групи. Нивото на инсулин на гладно в серума при NIDDM при затлъстяване е значително по-високо от това при NIDDM със затлъстяване.
Пролиферативни реакции на PBMC
Пролиферативните отговори на PBMCs с PHA стимулация не се различават при пациенти със затлъстяване и без затлъстяване с NIDDM. Пролиферативният отговор при затлъстели не-NIDDM е по-нисък от този при затлъстели и затлъстели NIDDM, въпреки че е наблюдавана значителна разлика (Таблица 2).
Производство на цитокини от РВМС
При производството на цитокини от PBMCs, IL-1β се увеличава значително при NIDDM със затлъстяване (216,4 ± 27,18 pg/ml) и затлъстяване без NIDDM (279,6 ± 71,56 pg/ml) в сравнение с NIDDM при затлъстяване (98,0 ± 19,09 pg/ml; P
Дискусия
Пациентите с NIDDM имат повишена честота на инфекции поради нарушен имунитет (Plouffe et al, 1978; Feng-Yee & Men-Fang, 1995; Reyzelman et al, 1999). Имунокомпетентните клетки могат да бъдат регулирани от множество ендокринни хормони, включително инсулин, чрез свързване на специфичните за повърхността рецептори (Kiess & Belohradsky, 1986). Следователно се предполага, че промяната на имунната система при NIDDM е свързана с промени в ендокринната хомеостаза. Междувременно затлъстяването се придружава от нарушен брой Т-клетки и пролиферация (Tanaka et al, 1993; Nieman et al, 1999). Вече съобщихме, че цитокиновият баланс е променен при индуцирани от диета затлъстели мишки (Mito et al, 2000). Тъй като NIDDM и затлъстяването имат характерни метаболитни промени, като промени в инсулина, лептина или кортикостерона, възможно е имунните функции при NIDDM със затлъстяване да се различават от тези при NIDDM с нормално телесно тегло.
При изследването на човешки клетъчни линии, екзогенният инсулин във високи концентрации намалява пролиферацията на Т-клетъчни линии, като MOLT-4 и HUT-102, но няма ефект върху В-клетъчни и моноцитни клетъчни линии. Ефект на инсулин върху пролиферацията на други клетъчни линии (HL-60 и K562) също не е наблюдаван (данните не са показани). Това предполага, че ефектът на инсулина може да е различен между клетъчните типове или различни етапи на диференциация на имунните клетки. Т-клетъчните линии могат да бъдат особено чувствителни към инсулин. В това отношение предишно проучване съобщава, че суперфизиологичната концентрация на инсулин инвитро намалява общия брой лимфоцити, особено CD45RO +, но не променя CD45RA +, CD4 + или CD8 + (Kappel et al, 1998).
Препратки
Brinkmann V, Kristofic C. 1995 Регулиране от кортикостероиди на производството на цитокини Th1 и Th2 в човешки CD4 + ефекторни Т клетки, генерирани от CD45RO- и CD45RO + подгрупи J. Имунол. 155: 3322–3328
Bunout D, Munoz C, Lopez M, MP de la Maza, Schlesinger L, Hirsch S, Pettermann M. 1996 Интерлевкин 1 и фактор на туморна некроза при затлъстели алкохолици в сравнение с пациенти с нормално тегло Am. J. Clin. Nutr. 63: 373–376
Ciampolillo A, Guastamacchia E, Caragiulo L, Lollino G, Robertis OD, Lattanzi V, Giorgino R. 1993 г. Инвитро секреция на интерлевкин-1β и интерферон-γ от лимфомононуклеарни клетки от периферна кръв при пациенти с диабет Диабет Res. Clin. Практика. 21.: 87–93
Clausell N, Kalil P, Biolo A, Molossi S, Azevedo M. 1999 Повишена експресия на тумор некрозис фактор-алфа при диабетна макроваскулопатия Кардиоваск. Патол. 8: 145–151
Considine RV, Sinbe MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, Ohannesian JP, Marco CC, Mckee LJ, Bauer TL, Garo JF. 1996 Серумни концентрации на имунореактивен лептин при хора с нормално тегло и затлъстяване Нов англ. J. Med. 334: 292–295
Davaraj S, Jialal I. 2000 Постсекреторна модификация на липопротеини с ниска плътност, моноцитна функция и циркулиращи адхезионни молекули при пациенти с диабет тип 2 със и без макро-съдови усложнения: ефектът от добавянето на алфа-токоферол Тираж 102: 191–196
Динарело С. 1984 Интерлевкин-1 и патогенезата на акт-фазовия отговор Нов англ. J. Med. 311: 1413–1418
Dinarello C, Mier J. 1987 Лимфокини Нов англ. J. Med. 317: 940–945
Feng-Yee C, Men-Fang S. 1995 Намален клетъчно-медииран имунитет при пациенти с неинсулинозависим захарен диабет Диабет Res. Clin. Практика. 28: 137–146
Frederichi RC, Hamann A, Anderson S, Lollmann B, Lowell BB, Flier JS. 1995 Нивата на лептин отразяват съдържанието на липиди в тялото при мишки: доказателства за индуцирана от диетата резистентност към действието на лептин Nature Med. 1: 1311–1314
Хелдърман JH. 1981 г. Роля на инсулина в междинния метаболизъм на активиран тимусен лимфоцит J. Clin. Инвестирам. 67: 1636–1642
Helderman JH, Raskin P. 1980 Т-лимфоцитният инсулинов рецептор при диабет и затлъстяване: присъщ свързващ дефект Диабет 29: 551–557
Holden RJ, Mooney PA. 1995 Интерлевкин-1β: честа причина за болестта на Алцхаймер и захарния диабет Med. Хипотези 45: 559–571
Hunt P, Eardley D. 1986 Потискащи ефекти на инсулина и инсулиноподобния растежен фактор-1 (IGF1) върху имунните отговори J. Имунол. 136: 3994–3999
Kappel M, Dela F, Barington T, Galbo H, Pedersen BK. 1998 Имунологични ефекти на хиперинсулинемична евгликемична инсулинова скоба при здрави мъже Сканд. J. Имунол. 47: 363–368
Kiess W, Belohradsky BH. 1986 Ендокринна регулация на имунната система Клин. Wochenschr. 64: 1–7
Loffreda S, Yang SQ, Lin HZ, Karp GL, Brengman ML, Klein AS, Bulkley GB, Bao C, Noble PW, Lane MD. 1998 Лептинът регулира проинфламаторните имунни отговори F.A.S.E.B. J. 12: 57–65
Лорд GM, Matares G, Howard JK, Baker RJ, Bloom SR, Lechler RI. 1998 Leptin модулира T-клетъчния имунен отговор и обръща предизвиканата от глад имуносупресия Природата 394: 897–901
Mandrup-Poulsen T, Bendtzen K, Nerup J, Dinarello C, Svenson M, Nielsen J. 1986 Пречистеният по афинитет човешки интерлевкин-1 е цитотоксичен за изолиран остров Лангеранс Диабетология 29: 63–67
Martin-Romero C, Santos-Alvarez J, Goberna R, Sanchez-Margalet V. 2000 Човешкият лептин засилва активирането и пролиферацията на циркулиращите от човека Т лимфоцити Клетъчен имунол. 199: 15–24
Mito N, Hosoda T, Chiaki K, Sato K. 2000 Промяна на цитокиновия баланс при индуцирани от диета затлъстели мишки Метаболизъм 49: 1295–1300
Mohamed-Ali V, Pinkney J, Coppack S. 1998 Мастна тъкан като ендокринен и паракринен орган Международна J. Obes. Relat. Metab. Разстройство. 22.: 1145–1158
Nieman DC, Henson DA, Nehlsen-Cannarella SL, Ekkens M, Utter AC. 1999 Влияние на затлъстяването върху имунната функция J. Am. Диета. Доц. 99: 294–299
Plouffe JF, Silva J Jr, Fekety R, Allen JL. 1978 Клетъчно-медииран имунитет при захарен диабет Инфектирайте. Имун. 21.: 425–429
Reyzelman A, Lipsky B, Hadi S, Harkless L, Armstrong D. 1999 Повишеното разпространение на тежки невротизиращи инфекции, причинени от стрептококи от група А J. Am. Подиат. Med. Доц. 89: 454–457
Santos-Alvarez J, Goberna R, Sanchez-Margalet V. 1999 Човешкият лептин стимулира пролиферацията и активирането на човешки циркулиращи моноцити Клетъчен имунол. 194: 6–11
Tanaka S, Inoue S, Isoda F, Waseda M, Ishihara M, Yamakawa T, Sugiyama A, Takamura Y, Okuda K. 1993 Нарушен имунитет при затлъстяване: потиснат, но обратим отговор на лимфоцитите Международна J. Obes. Relat. Metab. Разстройство. 17: 631–636
Tanaka S, Isoda F, Yamakawa T, Ishihara M, Sekihara H. 1998 Т-лимфопения при генетично затлъстели плъхове Clin. Имунол. Имунопатол. 86: 219–225
Varner AE. 2000 Имунологичен механизъм за връзката между затлъстяването и астмата Арх. Стажант. Med. 160: 2395
- Затлъстяването причинява ли захарен диабет тип 2 (T2DM) или е обратното на Malone - 2019 - Pediatric
- Кожни прояви при деца със захарен диабет и затлъстяване - ScienceDirect
- Изследване на циркулацията на епидемиологията на затлъстяването и диабета и техните сърдечно-съдови усложнения
- ESC; nbsp; 2020 Затлъстяването е по-силен рисков фактор за диабет, отколкото полигенното предразположение
- Декларация за консенсус Затлъстяване и диабет тип 2 Какво може да бъде унифицирано и какво трябва да бъде