Лупинг Жу
отдел по оториноларингология, Първа свързана болница, Медицински университет Нанкин, Нанкин, Дзянсу 210029, Китай;
Такаши Шимада
b Международен център за изследване на алергии, Медицински университет в Нанкин, Нанкин, Дзянсу 210029, Китай;
c Централни изследователски лаборатории, Nichinichi Pharmaceutical Corporation Ltd, Mie 518-1417, Япония;
Руокси Чен
отдел по оториноларингология, Първа свързана болница, Медицински университет Нанкин, Нанкин, Дзянсу 210029, Китай;
Мейпинг Лу
отдел по оториноларингология, Първа свързана болница, Медицински университет Нанкин, Нанкин, Дзянсу 210029, Китай;
Qingzhao Zhang
отдел по оториноларингология, Първа свързана болница, Медицински университет Нанкин, Нанкин, Дзянсу 210029, Китай;
Уенмин Лу
отдел по оториноларингология, Първа свързана болница, Медицински университет Нанкин, Нанкин, Дзянсу 210029, Китай;
Мин Ин
отдел по оториноларингология, Първа свързана болница, Медицински университет в Нанкин, Нанкин, Дзянсу 210029, Китай;
b Международен център за изследване на алергии, Медицински университет в Нанкин, Нанкин, Дзянсу 210029, Китай;
Тадао Еномото
d НПО Япония, поддържаща мрежа за насърчаване на здравето, Wakayama 640-8558, Япония.
Лей Ченг
отдел по оториноларингология, Първа свързана болница, Медицински университет Нанкин, Нанкин, Дзянсу 210029, Китай;
b Международен център за изследване на алергии, Медицински университет в Нанкин, Нанкин, Дзянсу 210029, Китай;
Резюме
ВЪВЕДЕНИЕ
Употребата на пробиотици за насърчаване на човешкото здраве се предлага от много години [1]. Няколко проучвания показват, че различни щамове пробиотици, особено млечнокисели бактерии, са полезни при лечението на чревни възпалителни състояния [2], [3]. В допълнение към ефектите върху червата, има все повече доказателства, че пробиотиците могат да бъдат полезни при регулирането на системните имунни отговори [4], [5] и при резистентността към развитие на алергии [6], [7]. Това доведе до повишен интерес към ролята на пробиотиците в защитата срещу проявите на алергично заболяване. Клиничните изпитвания показват, че някои щамове млечнокисели бактерии имат роля в лечението и профилактиката на ранния атопичен дерматит при деца [8] - [10] и че други щамове могат да намалят носните симптоми и да подобрят качеството на живот при пациенти с алергичен ринит [11], [12]. Експериментите с животни демонстрират, че някои щамове млечнокисели бактерии, например Lactobacillus reuteri (L. reuteri) и L. casei, могат да отслабят алергичните реакции на дихателните пътища [13], [14] и да предпазват от респираторни патогени [15].
МАТЕРИАЛИ И МЕТОДИ
Експериментални животни
Четириседмични женски мишки BALB/c са закупени от Лабораторния център за животни на Медицинския университет в Нанкин. Експерименталните мишки бяха настанени в климатизирана стая за животни при температура 22 ± 2 ° C и влажност 60% ± 5%, при специфични условия, свободни от патогени, и с 12-часов цикъл светлина-тъмнина. Мишките бяха хранени със стандартна диета и чешмяна вода, която беше филтрирана през филтър с чиста вода. Протоколът за изследване беше одобрен от местните институционални съвети за преглед във всички свързани с авторите институции. Експериментите бяха предприети в съответствие с разпоредбите за грижа и използване на опитни животни на Китайската асоциация за лабораторни науки за животните.
Пробиотични препарати
Препарат за прах LFK се предоставя от Nichinichi Pharmaceutical Co., Ltd. (Mie, Япония) и се приготвя, както е описано по-рано [18], [19]. Препаратът LFK се суспендира във физиологичен разтвор, преди да се прилага орално на мишки.
Модел на миши алергичен ринит
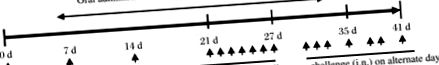
Мишките BALB/c бяха разделени на случаен принцип в три групи: 1) OVA-сенсибилизиран/предизвикан и перорално приложен физиологичен разтвор (OVA група); 2) OVA-сенсибилизиран/предизвикан и орално администриран LFK (група, хранена с LFK); 3) несенсибилизираният и орално приложен физиологичен разтвор (контролна група с физиологичен разтвор). Всяка група съдържа шест мишки. Процедурите за OVA сенсибилизация и предизвикателство са обобщени в Фиг. 1 . Накратко, 0,2 ml нормален физиологичен разтвор, съдържащ 0,1 mg OVA (Sigma, Сейнт Луис, МО, САЩ) и 2 mg алуминиев хидроксид (Sigma), се инжектира интраперитонеално в мишки на d 0, 7 и 14. Интраназалното предизвикване се извършва чрез назална вливане на 20 µL разтвор на OVA (50 mg/ml) дневно от d 21 до 27 и последващо интраназално предизвикване се извършва в алтернативни дни от d 29 до 41. Междувременно LFK (60 mg/0,5 ml/мишка) се прилага перорално на всеки ден на експерименталните мишки по време на периода на сенсибилизация от 6 седмици. За разлика от това, контролните групи OVA и физиологичен разтвор са били подложени на ежедневно перорално приложение на 0,5 ml физиологичен разтвор през този 6-седмичен период.
BALB/c мишките бяха разделени на три групи: сензибилизиран/предизвикан от овалбумин (OVA) и перорално приложен физиологичен разтвор (група OVA), чувствителен към OVA/предизвикан и орално администриран LFK (група, хранена с LFK), и несенсибилизирани и орално администрирани физиологичен разтвор (контролна група с физиологичен разтвор). Мишките в OVA групата и LFK групата бяха сенсибилизирани чрез интраперитонеална (ip) инжекция от 0,1 mg OVA и 2 mg Al (OH) 3 в обем от 0,2 ml на d 0, 7 и 14 и впоследствие бяха предизвикани интраназално ( in) дневно с 20 µL OVA разтвор (50 mg/mL) на d 21 до 27 и на алтернативни дни от d 29 до 41. Хранените с LFK мишки са били хранени с 60 mg LFK, а мишките от контролната група са били прилагани перорално 0,5 ml физиологичен разтвор през периода на сенсибилизация и предизвикателство.
Оценка на назалните симптоми
Назалните симптоми, включващи назално триене и кихане, се наблюдават на d 21, 27 и 35 след назална провокация с OVA. Мишките бяха незабавно поставени в клетка за наблюдение (по едно животно на клетка) след интраназално предизвикване и поведението на триене в носа и кихане беше отчетено за 10 минути.
Назален хистологичен анализ
Проби от назална лигавица от турбината на мишки (n = 4 за всяка група) бяха анатомично разделени на d 41, фиксирани с 10% формалин за 24 h, декалцифицирани в EDTA за 1 седмица, дехидратирани и вградени в парафин. Фиксираните и вградени тъкани се нарязват на коронарни секции с дебелина 5 µm за оцветяване с хематоксилин-еозин (H&E). Хистологичната оценка се извършва чрез светлинна микроскопия (увеличение, × 200). Еозинофилите в носната лигавица са преброени при × 200 увеличение.
Измерване на цитокини и OVA-специфични IgE
Кръвни проби бяха събрани от мишки на d 41 (n = 5 за всяка група). След центрофугиране серумът се отделя и се съхранява при -20 ° С за измерване на интерлевкин (IL) -4 и интерферон (IFN) -γ. Далаците бяха отстранени и едноклетъчните суспензии бяха приготвени чрез внимателно пресоване на далака през стерилен 70-микрон найлонов клетъчен скрининг при асептични условия на d 41. Спленоцитите бяха суспендирани в среда RPMI 1640 (Invitrogen, Carlsbad, CA, USA), допълнена с 10% топлинно инактивиран фетален телешки серум (PAA, Австралия), 100 U/ml пеницилин и 100 mg/ml стрептомицин (Invitrogen) и 1 × 106 клетки/ml бяха засяти в плочки с плоско дъно с 48 ямки за всяка група . Клетките се инкубират в RPMI 1640 пълна среда с OVA алерген (0,1 mg/ml) при 37 ° С в продължение на 48 часа в 5% CO2 инкубатор. Супернатантите се събират и съхраняват при -20 ° С за измерване на цитокини.
Нивата на супернатанта на серумната и спленоцитната култура на IL-4, IFN-γ (R&D Systems Inc., Минеаполис, MN, САЩ) и специфичните за OVA IgE са открити в два екземпляра от търговски ELISA комплекти (Shibayagi, Co., Ltd., Gunma, Япония) в съответствие с препоръките на производителя. Границата на откриване беше 4 pg/mL за IL-4, 7 pg/mL за IFN-y и 1,88 U/mL (2,44 ng/mL) за OVA-специфичен IgE анализ.
Поточен цитометричен анализ
За анализ на CD4 + CD25 + регулаторни Т клетки (Tregs), едноклетъчна суспензия, получена от далак, се ресуспендира при 1 х 106 клетки/ml и се инкубира със смес от анти-CD3, анти-CD4 и анти-CD25 антитела (eBioscience, Сан Диего, Калифорния, САЩ) за 30 минути на тъмно. След това клетките се промиват два пъти с PBS, фиксират се и се анализират с FACScan поточен цитометър (BD Immunocytometry, Franklin Lakes, NJ, USA). За събиране и анализ на данни е използван софтуер CellQuest.
Статистически анализ
За статистически анализ е използван софтуерът SPSS 17.0 (SPSS Inc, Чикаго, Илинойс, САЩ). Всички стойности са изразени като средна стойност ± SEM. За изчисляване на разликите между трите групи е използван еднопосочен дисперсионен анализ. Извършен е несдвоен t-тест на Student (двустранен) между две групи, когато се приема равна дисперсия. В ситуации, при които не се предполага равна дисперсия, се използва непараметричен тест (U-тест на Mann-Whitney или тест на Kruskal-Wallis). Стойностите на Р под 0,05 се считат за статистически значими.
РЕЗУЛТАТИ
LFK облекчава триенето и кихането в носа при хранени с LFK мишки с алергичен ринит
Назалното триене се увеличава постепенно след интраназално предизвикателство в групата с OVA и е значително облекчено при LFK-хранени мишки в сравнение с групата на OVA на d 27 (P = 0,015) и d 35 (P = 0,008), но не и на d 21 (P = 0,289) ( Фиг. 2 ). В сравнение с контролната група с физиологичен разтвор, назалното триене на мишки, хранени с LFK, се различава значително при d 21 (P = 0,005), d 27 (P = 0,014) и d 35 (P = 0,041).
Епизодите на назално триене се отчитат в продължение на 10 минути след предизвикване на назален овалбумин (OVA) на d 21 (A), d 27 (B) и d 35 (C). Всяка колона и вертикална лента показват средната стойност ± SEM (n = 5 за всяка група). * Р Фиг. 3 ). Въпреки това, приложението на LFK в продължение на 35 последователни дни (т.е. на d 35) наистина инхибира кихането (P = 0,045). В сравнение с кихането на контролната група с физиологичен разтвор, кихането на LFK-хранени мишки е значително различно на d 21 (P Фиг. 4 ), което потвърди, че назалното предизвикателство с OVA е ефективно. Въпреки че мишките, хранени с LFK, са имали значително намален брой еозинофили в носната лигавица в сравнение с групата OVA (P = 0,014), мишките, хранени с LFK, все още са имали значително повече еозинофили от контролната група с физиологичен разтвор (P = 0,044).
Проби от назална лигавица бяха анатомично разделени на d 41, фиксирани с 10% формалин за 24 часа, декалцифицирани в EDTA за 1 седмица, дехидратирани и вградени в парафин. Повишената еозинофилна инфилтрация в носната субмукоза и ламина проприя е очевидна в носната турбинна тъкан на контролните мишки OVA в сравнение с тази на контролните мишки с физиологичен разтвор, докато еозинофилният клетъчен инфилтрат е намален в групата, хранена с LFK, в сравнение с групата с OVA. D: Статистическият анализ на броя на еозинофилите в три групи (n = 4). Всяка колона и вертикална лента показват средно ± SEM. * Р маса 1 ). Серумният IFN-y титър в групата с OVA е под границата на откриване. Серумен IFN-y се открива при мишки, които са били допълнени с LFK в продължение на 6 седмици, но тези мишки все още са имали серумен IFN-y титър, който е значително намален в сравнение с контролните мишки с физиологичен разтвор (P = 0,013). IL-4 е намален, макар и не значително, при LFK-хранени мишки в сравнение с OVA групата (P = 0.207). По същия начин, хранени с LFK мишки са имали намаляване на серумните OVA-специфични IgE титри в сравнение с OVA групата, но тази разлика не е била значителна (P = 0,086). Няма значителни разлики между LFK-хранената група и OVA групите в нивата на супернатанта на културата на спленоцитите на IL-4 и IFN-γ (и двете P> 0,05). Специфичният за OVA IgE титър е под границата на откриване във всички групи ( маса 1 ).
маса 1
| Група | н | IL-4 (pg/ml) | IFN-y (pg/ml) | OVA-sIgE (ng/mL) |
| Серум | ||||
| OVA | 5 | 58,68 ± 6,59 ** | n.d. | 17,72 ± 1,86 |
| LFK-захранван | 5 | 45,69 ± 1,42 ** | 14,83 ± 0,99 * | 11,28 ± 2,05 # |
| Контрол на физиологичен разтвор | 5 | 20,22 ± 1,75 | 37,12 ± 1,65 | n.d. |
| Супернатант | ||||
| OVA | 4 | 24,26 ± 0,17 | 11,21 ± 1,00 * | n.d. |
| LFK-захранван | 4 | 18,34 ± 3,35 | 15,05 ± 1,76 * | n.d. |
| Контрол на физиологичен разтвор | 4 | n.d. | 67,63 ± 11,67 | n.d. |
* P # P = 0,086, в сравнение с OVA контрола, nd: не е открит.
Ефекти на LFK върху CD4 + CD25 + Tregs в далака
Пероралното приложение на LFK в продължение на 6 седмици доведе до значително увеличение на процента на CD4 + CD25 + Tregs в сравнение с групата на OVA (P = 0,046, Фиг. 5 ).
Мишките BALB/c се инжектират интраперитонеално на d 0, 7 и 14 с 0,1 mg овалбумин (OVA) и 2 mg Al (OH) 3 в общ обем от 0,2 ml. На мишките се прилага перорално LFK (60 mg/0,5 ml) дневно в продължение на 41 дни. Слезките се отстраняват в рамките на 24 часа след последното назално предизвикване на d 41, приготвят се едноклетъчни суспензии на спленоцити и процентите на слезката CD4 + CD25 + Tregs в OVA група (A), LFK-хранена група (B) и физиологичен разтвор контролната група (С) се измерва чрез поточна цитометрия. D: Показаните данни са представителни за три независими експеримента. Всяка колона и вертикална лента показват средната стойност ± SEM (n = 3). * P Guarner F, Schaafsma GJ. Пробиотици. Int J Food Microbiol. 1998; 39: 237–8. [PubMed] [Google Scholar]
- Enterococcus faecalis FK-23 засяга алвеоларно-капилярната пропускливост за отслабване на притока на левкоцити
- Характеризиране на съкратен модел на диетично редуване при женски плъхове ефекти на CB1
- Контрастни ефекти на различните майчини диети върху сексуално диморфната генна експресия в мишата
- Ефекти на модела върху хранителното поведение Индукцията на сдържан стил на хранене1 - Polivy - 1979
- Ефекти на „плоския модел“ като част от диетичната интервенция върху модификацията на избрания