Резюме
Заден план
Грипът е силно заразна остра респираторна болест, причинена от грипни вируси, които принадлежат към Orthomyxoviridae семейство. Според доклади, издадени от Световната здравна организация, приблизително 5–15% от населението на света е ежегодно заразено с грипен вирус А и 250 000–500 000 от тези заразени пациенти умират всяка година. Годишната имунизация е основното средство за предпазване от грипна вирусна инфекция, но тази ваксинационна стратегия може да бъде ограничена от времето за производство (Boltz et al. 2010). В допълнение към стратегията за ваксиниране, антивирусната терапия е полезна за контролиране на разпространението на грипа. Два класа антивирусни лекарства (инхибитори на М2-йонните канали и невраминидазни инхибитори) са одобрени за профилактика и лечение на грип (Boltz et al. 2010; van der Vries et al. 2011). Ефективността на тези антивирусни агенти обаче може да бъде ограничена от бързата поява на резистентни на лекарства вируси (van der Vries et al. 2011).
Тежката грипна вирусна инфекция може да доведе до дифузно алвеоларно увреждане, което се характеризира с белодробен оток и натрупване на възпалителни клетки в белия дроб, с хистопатологични характеристики на остро увреждане на белия дроб (ALI) и синдром на остър респираторен дистрес (ARDS), най-тежката форма на ALI. Тези увреждания на белите дробове пряко корелират с свързаната с грип заболеваемост и смъртност поради увреждане на газообмена и дихателните функции. ARDS се характеризира с увеличаване на пропускливостта на алвеоларно-капилярната бариера, която се образува от микроваскуларния ендотел и алвеоларния епител, което води до приток на течност и левкоцити в алвеоларното въздушно пространство както през ендотела, така и върху епитела (Nunes 2005 ). ALI и ARDS са водещи причини за смърт след инфекции с пандемичен 2009 H1N1 и високопатогенни птичи грипни вируси H5N1 (Perrone et al. 2008; Zhang et al. 2012b).
Няколко експериментални проучвания показват, че причинената от грип смърт се потиска от противовъзпалителни средства, които противодействат на възпалителния отговор на гостоприемниците, без да засягат самата репликация на вируса (Darwish et al. 2011; Garcia et al. 2010). Тези доклади показват, че потискането на повишения възпалителен отговор на вирусна инфекция е важно, за да се избегне смъртта, причинена от грип.
Перорално или интраназално приложение на млечнокисели бактерии са ефективни срещу грипна вирусна инфекция (Izumo et al. 2010; Maeda et al. 2009). Тези бактериални приложения спомагат за повишаване на имунния отговор на гостоприемника, който причинява намаляване на ефективността на вирусната репликация и/или повишаване на експресията на цитокини. Преди това съобщихме, че водоразтворимата фракция на третирана с лизозим млечнокисела бактерия Enterococcus faecalis FK-23 (LFK) намалява смъртността, свързана с грипни вирусни инфекции (Kondoh et al. 2012). Въпреки това, механизмът, в основата на който има противогрипният ефект на LFK, остава неясен. По-рано съобщавахме, че пероралното приложение на LFK отслабва притока на еозинофили в горните дихателни пътища при миши алергичен модел (Zhu et al. 2012) и притока на възпалителни клетки в бронхоалвеоларна промивна течност (BALF) при миши астматичен модел (Zhang et al . 2012а). Тези резултати предполагат възможността за противовъзпалителен ефект на LFK по време на грипна вирусна инфекция. В това проучване ние демонстрираме, че приложението на LFK намалява смъртността след вирусна инфекция с H1N1 и потиска прекомерния приток на левкоцити, които причиняват възпалителни реакции, в белите дробове чрез модулация на алвеоларно-капилярната пропускливост.
Резултати
Намаляване на смъртността от мишки, заразени с грипен вирус, чрез приложение на LFK
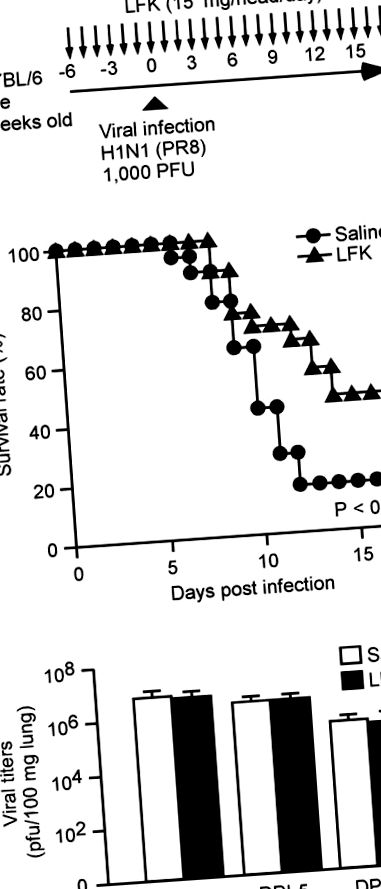
За да тестваме за превантивен ефект срещу грип, ние прилагахме перорално LFK на мишки в доза от 15 mg на мишка, веднъж дневно, в продължение на 6 дни преди и 17 дни след вирусната инфекция и проследяваме степента на преживяемост в продължение на 17 дни след инфекцията ( Фигура 1А). В този експеримент, дозата на LFK е фиксирана на 15 mg на мишка, както предишен доклад, в който водоразтворимата фракция на LFK суспензия (15 mg на мишка) се прилага на мишки (Kondoh et al. 2012). В този експеримент обаче се прилага LFK суспензия, а не водоразтворима фракция на LFK за цялостно разбиране на механизма за предотвратяване на грип от LFK. Както е показано на Фигура 1В, 16% от мишките от контролната група, на които е прилаган физиологичен разтвор през устата, оцеляват в продължение на 17 дни след инфекцията. За разлика от това, 45% от мишките, приемали LFK орално, са оцелели след инфекция. Този резултат показва, че пероралното приложение на LFK осигурява ефективна защита от летална инфекция от грипен вирус А.
След това изследвахме дали подобрената преживяемост се дължи на намаляване на ефективността на вирусната репликация в белия дроб, тъй като пероралното или интраназално приложение на млечнокисели бактерии потиска ефективността на вирусната репликация в белия дроб (Maeda et al. 2009; 2010 г.). За разлика от тези доклади, вирусният титър в белите дробове не показва значителна разлика между групите, прилагани с физиологичен разтвор и LFK на 3 дни, 5 дни и 7 дни след инфекцията (DPI) (Фигура 1С). Този резултат предполага, че механизмът, чрез който пероралното приложение на LFK предпазва от причинена от вируса смърт е различен от този, докладван за други млечнокисели бактерии.
Потискане на инфилтрацията на левкоцити в белия дроб след вирусна инфекция чрез лечение с LFK
Левкоцитите, включително възпалителни клетки, мононуклеарни клетки и лимфоцити, се инфилтрират в белодробната област след вирусна инфекция (Kohlmeier and Woodland 2009; Fukushi et al. 2011). За да разберем защитния механизъм, в основата на който действа LFK, оцветихме белодробните секции, използвайки хематоксилин-еозин (HE). Това оцветяване разкрива, че инфилтрацията на левкоцити в белодробния паренхим е била потисната при DPI-7 в групата, прилагана от LFK, докато инфилтрация на левкоцити в белодробния паренхим и алвеоларен колапс са били наблюдавани в групата на физиологичен разтвор (Фигура 2А и Допълнителен файл 1: Фигура S1). За да потвърдим, че LFK потиска инфилтрацията на левкоцити, ние хомогенизирахме отстранените бели дробове и преброихме броя на цели белодробни клетки с помощта на микроскоп. В групата, прилагана с физиологичен разтвор, броят на белодробните клетки се е увеличил след вирусна инфекция и е достигнал максимум при DPI-7 (Фигура 2В). За разлика от контролната група, броят на тези клетки в LFK-администрираната група е значително потиснат при DPI-5, DPI-7 и DPI-10 (Фигура 2В). Подобни резултати бяха получени за BALF клетки. Общият брой на клетките в BALF е потиснат в групата, прилагана от LFK при DPI-5, в сравнение с тази в групата, прилагана с физиологичен разтвор (Фигура 2D).
Повишаване на броя на пневмоцитите от тип II чрез приложение на LFK
Изненадващо, броят на цели белодробни клетки при DPI-0 е значително по-висок при мишки, които са били прилагани с LFK в продължение на 6 дни преди вирусна инфекция, отколкото в групата, прилагана с физиологичен разтвор (Фигура 2В). Алвеоларните прегради се състоят от 2 вида пневмоцити (тип I и II), съединителни тъкани и кръвоносни съдове (Rogers 2010). Направихме имунохистохимичен анализ, тъй като въз основа на нашето наблюдение на оцветените с НЕ белодробни участъци при DPI-0 (Допълнителен файл 2: Фигура S2A), очаквахме увеличение на броя на пневмоцитите от тип II. Оцветяването с тип II пневмоцитен маркер (proSP-C, просурфактант протеин-C) показва, че броят на пневмоцитите от тип II е увеличен в групата, прилагана от LFK, в сравнение с тази в групата, прилагана с физиологичен разтвор (Допълнителен файл 2: Фигури S2B и S2C ).
Потискане на клетъчната инфилтрация, независимо от клетъчния тип
След това оценихме кои видове клетки инфилтрират в белодробната област след вирусна инфекция. Клетъчните популации на всеки левкоцит в белия дроб бяха анализирани при DPI-0, DPI-3, DPI-5, DPI-7 и DPI-10 с помощта на проточен цитометър. В ранната фаза на инфекция с грипен вирус, вродени имунни клетки, като моноцити, макрофаги и неутрофили, бяха наети в белия дроб при DPI-5 и DPI-7 (Фигура 2C). След това се наблюдава миграция на Т-клетки (Фигура 2С). Въпреки това, няма значителна разлика между групите, прилагани с физиологичен разтвор и LFK в популацията на инфилтриращите клетки. Подобен резултат беше получен за клетъчната популация в BALF при DPI-5. Групите, прилагани с физиологичен разтвор и LFK, не показват значителна разлика в популацията от левкоцити, които са проникнали в алвеоларното пространство (Фигура 2Е). Тези резултати показват, че потискането на клетъчната инфилтрация в белия дроб е настъпило във всички видове левкоцити, които анализирахме.
Експресия на гени на хемокини и цитокини след вирусна инфекция
Хемокините регулират трафика на различни видове левкоцити, а цитокините могат да индуцират производството на хемокини (Kohlmeier and Woodland 2009). Следователно, ние след това оценихме нивото на експресия на иРНК на цитокини и хемокини в белия дроб по време на вирусна инфекция. Нивото на експресия на различни Th1 цитокини, провъзпалителни цитокини, CCL-хемокинови лиганди и CXCL-хемокинови лиганди бяха повишени след вирусна инфекция (Фигура 3А, 3В и Допълнителен файл 3: Фигура S3A и S3B). Не се наблюдава обаче значителна разлика в нивото на експресия на цитокини и хемокини, с изключение на CXCL4 (тромбоцитен фактор 4), който сам по себе си не показва никаква хемотаксична активност към левкоцитите (Kasper and Petersen 2011).
Потискане на индуцирана от вируса алвеоларно-капилярна пропускливост чрез лечение с LFK
След това изследвахме дали потискането на миграцията на левкоцитите се дължи на промените в белодробната алвеоларно-капилярна пропускливост, тъй като белодробното възпаление по време на вирусна инфекция е тясно свързано с разрушаването на целостта на белодробната бариера (Steinberg et al. 2011; Fukushi et al. 2011 ). Промяната в алвеоларно-капилярната пропускливост се оценява чрез проследяване на екстравазацията на синьото багрило Evans в BALF. Както е показано на Фигура 4А, увеличаването на индуцираното от вируса натрупване на синьо Evans се потиска при DPI-7 при LFK-администрирани мишки. Това показва, че приложението на LFK потиска индуцираната от вирусна инфекция белодробна пропускливост и че потискането на възпалителния клетъчен приток от LFK се дължи на стабилизиране на целостта на алвеоларно-капилярната бариера.
Модулация на генната експресия, контролираща съдовата пропускливост чрез приложение на LFK
Съобщени са механизми, които контролират съдовата пропускливост по време на възпаление. Матричните металопротеинази (ММР) са важни регулаторни ензими в провъзпалителните пътища и тяхната експресия и активност обикновено се увеличават по време на възпалителния процес. MMPs разграждат основните компоненти на съдовата базална мембрана и извънклетъчната матрица, като желатин и колаген, в алвеоларно-капилярната бариера (Manicone and McGuire 2008). Следователно, ние изследвахме нивото на експресия на иРНК на MMPs в белия дроб по време на вирусна инфекция. Експресията на MMP-7 след вирусна инфекция беше потисната в групата, прилагана от LFK при DPI-7 (Фигура 4В). За останалите MMPs се наблюдава тенденция на намаляване в групата, лекувана с LFK при DPI-7 (Фигура 4В). Тези резултати предполагат, че понижаването на експресията на MMP чрез приложение на LFK може да отслаби съдовата пропускливост, причинена от вирусна инфекция.
Дискусии
Компонентите на LFK за упражняване на противогрипния ефект остават неидентифицирани. Тъй като неотдавнашно проучване демонстрира, че разтворимият пептидогликан на коменсални бактерии се премества от червата в системното кръвообращение (Clarke et al. 2010), една от възможностите е, че разградените с лизозим компоненти на пептидогликан могат да се транслоцират в белите дробове, като по този начин модулират алвеоларния -капилярна бариера. Идентифицирането на активните компоненти в LFK ще бъде от съществено значение за по-нататъшното разбиране на точния противогрипен механизъм.
В това проучване демонстрирахме, че прилагането на LFK подобрява процента на преживяемост и потиска инфилтрацията на левкоцити в белия дроб след вирусна инфекция. Няколко фактора могат да допринесат за ефекта на LFK срещу грипна вирусна инфекция. Те включват потискане на левкоцитната инфилтрация в белите дробове както чрез понижаване на експресията на CXCL4, така и чрез модулация на белодробната ендотелна-епителна пропускливост чрез увеличаване на пневмоцитите от тип II и потискане на експресията на MMPs. Нашите открития подкрепят схващането, че потискането на разграждането на алвеоларно-капилярната бариера и последващият приток на левкоцити в белия дроб биха подобрили степента на оцеляване след вирусна инфекция. Стабилизирането на целостта на белодробната алвеоларно-капилярна бариера с помощта на бактериални компоненти може да бъде полезна стратегия за управление на сезонния и пандемичния грип.
Методи
Подготовка на LFK
E. faecalis щам FK-23 се култивира в бульонна среда, съдържаща 2,5% глюкоза, 1,4% екстракт от дрожди, 0,8% пептон и 4,4% K2HPO4 в продължение на 18 часа при 37 ° С и културите се събират чрез центрофугиране. След измиване с дестилирана вода, бактериите се третират с лизозим и след това реакционната смес се нагрява до 110 ° С в продължение на 10 минути преди лиофилизация, както е описано по-горе (Kondoh et al. 2012). LFK (15 mg/глава, разтворена в 200 μl физиологичен разтвор) или физиологичен разтвор (200 μl) се прилага перорално с помощта на игла за хранене веднъж дневно.
Подготовка на вируса
В това проучване е използван щам на грипния вирус, A/Пуерто Рико/8/34 (H1N1; PR8). Инфекциозните материали се обработват в съоръжение за биобезопасност ниво 2 по одобрени протоколи в съответствие с насоките на университета Хокайдо. Вирусът е приготвен, както е описано по-рано (Kondoh et al. 2012). Накратко, вирусът се размножава в алантоисните кухини на 10-дневни ембрионирани пилешки яйца при 35 ° С в продължение на 48 часа и след това се концентрира и пречиства чрез центрофугиране с градиент на плътността. Пречистеният вирус се суспендира във фосфатно буфериран физиологичен разтвор (PBS) и се съхранява при -80 ° С до употреба.
Мишки и вирусна инфекция
Мъжки мишки C57BL/6N (на 6 седмици) са закупени от CLEA Japan. Мишките бяха настанени в изолаторни клетки в стая за ниво на биобезопасност 2 (12 часа цикъл светлина/тъмнина) със свободен достъп до стандартна диета (CE-2; CLEA Япония) и чешмяна вода. Извършихме грижи за животни и експерименти в съответствие с насоките и одобрението на Комитета за грижи и употреба на животните от университета в Хокайдо (08–0231). Всички операции бяха извършени под анестезия на изофлуран. Мишките бяха леко анестезирани с изофлуран (Dainippon Pharmaceutical, Осака, Япония) и инокулирани интраназално с 10 3 PFU при 50 μl в двете ноздри на ден 0. Степента на преживяемост и телесното тегло бяха проследявани ежедневно до 17 дни след вирусна инфекция. За да се сведе до минимум страданието след вирусно предизвикателство, мишките бяха внимателно наблюдавани всеки ден и мишките, достигащи одобрени критерии за крайна точка, бяха евтаназирани чрез предозиране на изофлуран. Мишките бяха евтаназирани чрез предозиране на изофлуран на 17-ия ден след инфекцията.
Титруване на вируса
Анализът за образуване на плаки се извършва, както е описано по-рано (Fukushi et al. 2011) с някои модификации на протокола. Мишките се умъртвяват чрез вдишване на изофлуран и белите дробове се отстраняват от мишките. Белите дробове бяха напълно хомогенизирани в 1Х MEM среда, използвайки Micro smash (Tomy Seiko, Токио, Япония), и хомогенатите бяха серийно разредени със студен PBS. За анализ на плака, клетките на кучешки бъбреци на Madin-darby (MDCK) се поставят в плоско дъно с 12 ямки 24 часа преди инфекцията. Супернатантите от серийно разредени белодробни хомогенати бяха използвани за заразяване на сливащите се MDCK клетки при 37 ° С за 1 h. Клетките се измиват и впоследствие се покриват с MEM, смесен с 0,8% Bacto-агар (Difco, Sparks, САЩ) в присъствието на трипсин (5 μg/ml). Плаките се инкубират при 35 ° С в продължение на 2 дни и плаките се преброяват.
Хистологичен анализ
Мишките се умъртвяват чрез вдишване на изофлуран и белите дробове се отстраняват от мишките. Отстранените бели дробове веднага се фиксират в 10% буфериран с PBS формалин. Вградените в парафин тъкани се разделят на дебелина 4 μm и се оцветяват с хематоксилин и еозин (Merck, САЩ), използвайки стандартни хистологични техники. За имунохистохимично проучване парафиновите вградени тъканни секции бяха инкубирани с антипросурфактантно протеиново С антитяло, което е маркер от тип II пневмоцити (Millipore, Billerica, САЩ), инкубирано с полимерна анти заешка система, маркирана с хрян пероксидаза (DAKO, Glostrup, Дания), разработена със система envision + HRP с етикет полимерен анти заек (DAKO Glostrup, Дания) и оцветена с хематоксилин (Merck, САЩ) в съответствие с инструкциите на производителя. Пропорцията на просурфактантните протеинови С положителни клетки се изчислява чрез преброяване на броя на оцветените с хематоксилин клетки и неговите положителни клетки в 6 произволни микроскопични полета при увеличение 40.
Проточен цитометричен анализ на белодробни и BALF клетки
PCR в реално време
PCR реакцията в реално време се извършва, както е описано по-рано (Kondoh et al. 2012). Накратко, общата РНК се екстрахира от цели белодробни хомогенати, като се използва реагент TRIzol (Invitrogen, Carlsbad, USA) и Micro smash (Tomy Seiko, Tokyo, Japan) и след това се третира с DNase I (Takara bio, Otsu, Japan). CDNA се синтезира, като се използват олиго dT20 праймери (Toyobo, Osaka, Japan), произволни праймери (Toyobo, Osaka, Japan) и ReverTra Ace (Toyobo, Osaka, Japan). Всяка процедура се извършва в съответствие с инструкциите на производителя. PCR в реално време се извършва с помощта на SYBR Premix Ex Taq II (Takara bio, Otsu, Япония) със системата за PCR MX3000P в реално време (Stratagene, La Jolla, USA). Условията за колоездене бяха използвани като: 95 ° С за 10 секунди за активиране на ДНК полимераза, последвано от 40 цикъла от 95 ° С за 5 секунди и 60 ° С за 30 секунди. Експресионните нива на всяка тРНК са представени като относителни експресионни количества, които са нормализирани с глицералдехид-3-фосфат дехидрогеназа (GAPDH).
Измерване на алвеоларно-капилярна пропускливост
Алвеоларно-капилярното изтичане след вирусна инфекция се определя с помощта на синьото багрило Evans, както е описано по-рано (Rhein et al. 2008). Два часа преди убиването мишките се инжектират интравенозно чрез ретро орбитален синус под анестезия на изофлуран с 0,2 ml от 5 mg/ml Evans blue в PBS. BALF и серум се събират след убиване на мишки с изофлуран и оптичната плътност се определя при 600 nm. Промените в пропускливостта се оценяват чрез съотношението BALF/серумна концентрация.
Статистически анализ
Данните са изразени като средни стойности ± стандартни отклонения (SD). Студентски т тестът е използван за статистически анализ. За анализ на смъртността е използван методът на Каплан-Майер с log-rank тест. P стойност на
- Ефекти на лизиран Enterococcus faecalis FK-23 върху експериментален алергичен ринит в миши модел
- Ранното ограничено във времето хранене подобрява 24-часовите нива на глюкоза и влияе на маркерите на циркадиана
- Диета; Памет - Как храната влияе върху паметта Neurocore
- Диетичната вода влияе върху хидратацията и биомеханиката на човешката кожа
- Затлъстяването на черния дроб засяга 80 милиона американци