Резюме
Заден план
Затлъстяването е достигнало тревожни темпове в световен мащаб. Насърчаването на термогенезата чрез повишаване на функцията на кафявата мастна тъкан (BAT) или бялата мастна тъкан (WAT) се предлага като нов защитен подход срещу затлъстяването. Целта на това проучване е да се оценят ефектите от пчелното млечице (RJ) и богатата на токотриенол фракция (TRF) върху активирането на НДНТ и покачването на WAT по време на диета за ограничаване на калориите (CRD) при модел на затлъстяване.
Методи
В това експериментално проучване 50 затлъстели плъхове Wistar бяха разделени на случаен принцип в 5 групи и след това получиха едно от следните лечения за период от 8 седмици: Диета с високо съдържание на мазнини (HFD), CRD, RJ + CRD, TRF + CRD и RJ + TRF + CRD. Ефектите на RJ и TRF, индивидуално и в комбинация върху телесното тегло и експресията на ключови терморегулаторни гени в WAT и BAT бяха изследвани чрез количествено реално време (qRT-PCR). Също така, морфологичните промени бяха оценени чрез оцветяване с хематоксилин и еозин.
Резултати
RJ (- 67,21 g ± 4,84 g) и RJ + TRF (- 73,29 g ± 4,51 g) значително намаляват наддаването на тегло спрямо групата на CRD (- 40,70 g ± 6,50 g, P
Въведение
Нарастващата степен на затлъстяване в световен мащаб се дължи на сложните взаимодействия между факторите на околната среда, генетичния контекст и индивидуалното поведение. Независимо от това, несъразмерността в енергийния прием и енергийните разходи се смята за най-определящият аспект на затлъстяването [1]. Въпреки че ограничаването на калориите е основната намеса в управлението на затлъстяването, изглежда, че това е неефективен подход в дългосрочен план, тъй като метаболитните адаптации се натрупват в отговор на ограничението на енергията, което може да е резултат от намаляване на термогенезата, енергийния разход в покой или други съставни части на енергийния разход [ 2,3,4].
За разлика от бялата мастна тъкан (WAT), която е основното място на излишната енергия; кафявата мастна тъкан е основно място за адаптивна термогенеза. Термогенният капацитет на кафявите адипоцити разчита най-вече на високата експресия на разединяващ протеин1 (UCP1) и високо митохондриално съдържание. Когато се активира, медиира разсейването на химическата енергия чрез дисоциация на окислението на митохондриалния субстрат от производството на аденозин трифосфат (АТФ), което води до генериране на топлина [5, 6]. Следователно, функцията и активирането на кафявата мастна тъкан (НДНТ) имат значително потенциално внимание от терапевтична гледна точка, нейната жизненоважна функция при контрола на затлъстяването също е забележителна.
Метод
Животни и лечение
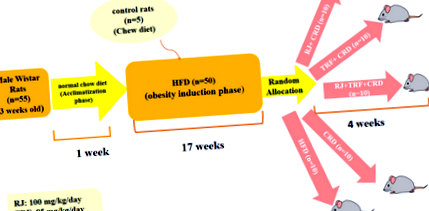
В това експериментално изследване 55 мъжки плъхове Wistar (на възраст 3 седмици) с тегло 50–70 g са закупени от Института Пастьор (Техеран, Иран). Всички плъхове са държани поотделно в клетки от неръждаема стомана при стандартна температура 22-25 ° C и относителна влажност 55 ± 5%, с 12-часов цикъл светлина/тъмнина (7: 00–19: 00 ч), позволено безплатно достъп до вода и нормална чау диета за 1 седмица. Всички експериментални процедури, извършени върху животни, са в съответствие с ръководството на Националния институт по здравеопазване за грижи и използване на лабораторни животни [23] и одобрено от Комитета по етика на Иранския университет по медицинска наука (етичен кодекс: IR.IUMS.FMD.REC 1396.9321324003) . Всички усилия бяха положени за намаляване на размера на пробата от изследваните плъхове и минимизиране на страданията на животните.
Протоколът на изследването се състои от двуфазен 1) период на индукция на затлъстяването 2) период на лечение. (Фиг. 1) След 1 седмица на аклиматизация, на 50 плъхове се прилага HFD за индуциране на модела на затлъстяване и пет плъха получават нормална чау-диета като контролна група за плъхове, получаващи HFD. Всички плъхове имаха свободен достъп до храна и вода през тази фаза на изследването. Полупречистеният HFD се състои от стандартен прах от чау, смесен с млечно масло (40% w/w). Съставите на диетите, използвани в изследването, са показани в Таблица 1. HFD се приготвя на всеки 2 дни прясно под формата на пелети и се поддържа при 4 ° C за поддържане на хранителни вещества. Претегляхме животните всяка седмица. В края на 17-та седмица средното тегло на плъхове, прилагани с HFD, нараства значително в сравнение с плъхове, консумиращи нормална чау-диета (443,28 g ± 46,62 g срещу 396,24 g ± 28,79 g P Фиг. 1
Схема на учебния дизайн
CRD има същия състав на макроелементи като HFD (Таблица 1), но съдържанието на калории е 30% по-ниско от приемането на HFD ad libitum. RJ и TRF се добавят към CRD и храната се претегля, след което се дава на плъхове всеки ден в определени часови графици (между 9: 00–9: 30 ч.). HFD се захранва ad libitum и се дава на плъхове всеки ден.
Лиофилизиран прах от пчелно млечице е закупен от Bulk Supplements Co, Ltd., (Хендерсън, САЩ), съдържащ 6% от 10-HAD. TRF е любезно предоставен от ExcelVite Co, Ltd. (Перак, Малайзия). Висококачествената течна хроматография определя, че TRF съдържа а-токотриенол (12%), β-токотриенол (2%), γ-токотриенол (19.3%) и δ -токотриенол (5,5%) заедно с а-токоферол (11,9%). Дозите и продължителността на лечението са избрани въз основа на съобщените по-рано перорални не наблюдавани неблагоприятни ефекти и размерът на пробата е определен въз основа на подобна работа, извършена преди [19, 24].
Вземане на проби
В края на проучването всички плъхове бяха анестезирани с интраперитонеална инжекция на ксилазин (ксилазин 2%, 20 mg ml - 1, Alfasan, Woerden, Холандия) и кетамин (кетамин 10%, 100 mg ml - 1, Alfasan, Woerden, Холандия) след нощно гладуване и интерскапуларна НДНТ, ингвиналната WAT и хипоталамусът бяха бързо отстранени, изплакнати внимателно с фосфатно буфериран физиологичен разтвор (PBS) и държани в РНК по-късно Стабилизиращ разтвор (Qiagen, Inc. изолация.
Количествена PCR в реално време
Всички тъкани се хомогенизират внимателно. Общата РНК беше извлечена от всяка тъкан с помощта на Trizol (Thermo Fisher, Waltham, Massachusetts, USA) съгласно протокола на производителя. Качеството и количеството на извлечената РНК се определят спектрофотометрично, като се измерва относителното съотношение на абсорбция при A260/280 и A260/230 (NanoDrop One/Once, Thermo Fisher Scientific Inc., Wilmington, Delaware, USA).
Екстрахираната РНК се превръща в комплементарна ДНК (cDNA), използвайки RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific, Waltham, Massachusetts, USA) с 1 μg mRNA съгласно протокола на производителя. Верижната реакция на обратна транскрипция-полимераза в реално време (RT-PCR) е направена с помощта на флуоресцентен термичен циклер (система Light Cycler; Roche Diagnostics, Манхайм, Германия), използвайки SYBR Premix Ex Taq (Takara Bio Inc., Shiga, Япония) и генно-специфични праймери за сАМР отговор-свързващ елемент протеин1(CREB1)Р38 митоген-активирани протеинкинази (P38MAPK) Костен морфогенетичен протеин7 (BMP7), Костен морфогенетичен протеин 8B(BMP8B), C/EBP β, PRDM16, UCP1, и β-актин. Праймерните последователности са проектирани чрез докладваните последователности на Primer Bank NCBI, обобщени в Таблица 2 и получени от Metabion international AG (Steinkirchen, Германия). Делта-делта методът беше използван за изчисляване на относителната експресия на иРНК на целевия ген и нормализиран до β-актин като референтен ген [25]. PCR се извършва при следните условия: 95 ° С за 10 минути, 95 ° С за 10 s и 60 ° С за 10 s за 45 цикъла със 100% скорост на нарастване при стандартни условия. Трикратните стойности на Ct бяха изчислени за всяка проба.
Хистологично изследване
Интерскапуларната BAT и ингвиналната WAT на произволно избрани два плъха от всяка изследвана група бяха отстранени, изплакнати внимателно с разтвор на PBS, след това фиксирани в 10% буфериран формалин с промяна на формалин на всеки 2 дни в продължение на 7 дни. След това пробите бяха дехидратирани чрез различни разтвори на алкохол и след това вградени в парафин. Тъканите бяха нарязани с въртящ се микротом на тънки участъци. За хистологични изследвания участъци с дебелина 5 μm, оцветени с метода H&E и изследвани със светлинен микроскоп Nikon. За хистоморфометрични изследвания се извършва оценка на мастната тъкан съгласно предишни проучвания [26] за кратко от всеки мастен образец, в 10 произволно избрани микроскопични полета, са анализирани общо 100 кръстосани секционни мастни тъкани и процентът на всеки параметър, който съдържа; три вида мастна тъкан и съединителна тъкан са осреднени за всяка група, използвайки обектив 40Х. Един опитен хистолог, който беше заслепен за лечебни групи, направи оценка на хистологичното изследване. Всеки експеримент се извършва в три екземпляра.
Статистически анализ
Нормалността на данните е оценена чрез теста на Колмогоров-Смирнов с една проба. Всички данни бяха представени като средната стойност ± SEM. Направен е еднопосочен дисперсионен анализ (ANOVA) за тестване на разликите между групите. Post hoc на Tukey беше извършен, за да анализира многобройните сравнения.
IBM SPSS Statistics 23 (IBM SPSS Statistics, Armonk, USA) беше приложен за анализ на всички данни.
Фигурите бяха визуализирани с помощта на софтуера Prism, версия 8.0 (GraphPad, Калифорния, САЩ). Значително ниво се счита за P-стойност
Резултати
Ефекти на CRD, RJ, TRF и смесени лечения върху промените в теглото
Всички 55 плъхове завършиха интервенцията за 8 седмици и включиха в анализа. След 8 седмици от експеримента, както се очаква, крайното средно телесно тегло на плъхове със затлъстяване, хранени с CRD, е значително по-ниско от това на плъхове със затлъстяване, хранени с HFD. (CRD, 404,24 g ± 8,65 g срещу HFD, 493,28 g ± 8,23 g, P Фиг. 2
Ефекти на RJ, TRF и смесените добавки върху експресирането на ключови терморегулаторни гени
За да изследваме ефектите на CRD върху термогенезата, първо измерихме нивата на експресия на ключов регулаторен ген, UCP1 от RT_PCR в WAT и междулопаточен BAT. Както се очакваше, заедно със загубата на тегло, CRD регулира надолу UCP1 нива с 36 и 14% съответно в WAT и BAT в сравнение с плъхове, хранени с HDF, въпреки че няма статистически значими (P ≥ 0,05) (Фиг. 3а). След това тествахме дали добавките RJ и TRF с CRD ще могат да подобрят гореспоменатите ефекти на CRD върху UCP1 нива. Нашите данни показват, че RJ, добавен при CRD плъхове, води до значително повишаване на UCP1 в сравнение с CRD-съвпадащата група в WAT и BAT, както е показано на фиг. 3b (P Фиг. 3
UCP1 активирането може да се регулира от различни протеинкинази. Затова изследвахме генната експресия на P38MAPK в гореспоменатите мастни тъкани. Израз на P38MAPK се е увеличил значително в групата RJ до 5 и 3,30 пъти съответно по WAT и BAT спрямо групата CRD (P Фиг. 4
BMP7 играе важна роля в цялостната енергийна хомеостаза, адипогенезата и енергийните разходи. Установихме обаче, че RJ, TRF и тяхната комбинация не променят израза на BMP7 нива на иРНК в това проучване (P ≥ 0,05, фиг. 4б).
Хистологични резултати
Както е илюстрирано на фиг. 5а при плъхове, хранени с CRD, белите адипоцити изглеждат по-малки от плъховете, хранени с HFD, с едноочни адипоцити (фиг. 5Ь). Няма данни за наличие на WAT при плъхове, хранени с CRD и HFD. По-специално в групата, лекувана с RJ, открихме малки, многолокулярни бежови адипоцити в WAT, (фиг. 5в) Whiles в групата на TRF измененията на WAT не бяха значителни (фиг. 5г). В групата RJ + TRF се забелязва проява на някои мултиокуларни адипоцити сред белите адипоцити (Фиг. 5д).
Оцветяване с хематоксилин и еозин (H&E) на ингвинална WAT секция на CRD (а), HFD (б), RJ (° С), TRF (д) и RJ + TRF (д) получи плъхове
Интерскапуларната НДНТ в групата на CRD се наблюдава с някои бели адипоцити наблизо (Фиг. 6а). Въпреки това, в групата с HFD, наблюдаваме повече едномокулярни бели адипоцити заедно с типичните кафяви адипоцити. (Фиг. 6б). В групата RJ и RJ + TRF НДНТ се отличава с по-червеникавокафяв вид, по-големи уплътнени кафяви адипоцити с многолокуларни липидни капчици в сравнение с групата CRD (фиг. 6в и д), докато НДНТ в групата TRF е по-малко компактен с бял морфология и повече съединителни тъкани (фиг. 6г).
Оцветяване с хематоксилин и еозин (H&E) на интерскапуларната НДНТ част на CRD (а), HFD (б), RJ (° С), TRF (д) и RJ + TRF (д) получи плъхове
Дискусия
През последните десетилетия бързите промени в начина на живот и диетите в съвременния живот водят до тревожната пандемия на затлъстяването. Въпреки че ограничаването на калориите (CR) чрез ограничаване на енергийния прием е най-често срещаната диетична интервенция за защита срещу увеличаване на теглото, тя е неефективна в дългосрочен план, тъй като термогенните осиновявания като защитни механизми намаляват енергийните разходи, за да спрат изчерпването на енергията [2, 3,4, 27]. Следователно, стимулирането на развитието на НДНТ в WAT (така нареченото покафеняване) или увеличаването на функцията на НДНТ за увеличаване на енергийните разходи ще се разглежда като обещаващи подходи за управление на затлъстяването. Доколкото ни е известно, това е първото изследване, изследващо свойствата на покафеняване и термогенеза на пчелно млечице и γ-токотриенол в модела на затлъстяване на плъхове по време на CRD. В това проучване демонстрирахме, че RJ намалява затлъстяването, предизвиква фенотип на Brite в WAT и активира термогенната програма BAT по време на CRD чрез значително повишаване на регулирането на UCP1 като индикаторен протеин на кафяв адипоцит, съпътстващ повишената експресия на PRDM16; основен модулатор на разработването на НДНТ; и P38MAPK, BMP8B и CEREB1 като други термогенни компоненти.
Нашите резултати показват, че добавеният RJ към плъхове със затлъстяване, хранени с CRD, води до значително намаляване на телесното тегло в по-голяма степен, свързано само с CRD (- 67,21 g ± 4,84 g срещу - 40,70 g ± 6,50 g). Съответно, това е в съгласие с проучването на Yoneshiro et al., Което съобщава, че 5% от RJ ограничава индуцираното от HFD затлъстяване и намалява колекцията на бяла мастна тъкан при млади мишки без умерено приемане на храна [28]. Настоящото проучване не може да демонстрира забележителния ефект на TRF върху загубата на тегло на затлъстели плъхове, хранени с CRD. Освен това, Wong et al. съобщава, че приложението на 120 mg/kg/ден TRF в продължение на 8 седмици не променя наддаването на телесно тегло при плъхове Wistar, хранени с HFD [20]. За разлика от това, при млади мишки C57BL/6 J, добавянето на HFD с 0,05% γT3 в продължение на 4 седмици подобрява затлъстяването, медиирано от HF с диета [31]. Различният генетичен произход на изследваните животни и добавянето на чист γT3 спрямо TRF се считат за възможни основни фактори, допринасящи за постигане на противоречиви резултати.
Предложени пътища за покафеняване на бяла мастна тъкан и активиране на кафява мазнина от RJ. RJ с агонистична активност, активира чувствителни към температурата TRP канали в GI, задействайки термогенеза чрез активиране на TRP-SNS-UCP1 ос. Β3-AR (β3-адренорецептор), BMP8B (костен морфогенетичен протеин 8B), cAMP (цикличен аденозин монофосфат), CREB1 (сАМР отговор-свързващ елемент протеин1), NE (норепинефрин), PRDM16 (PR домейн, съдържащ 16), PPARγ (активиран от пероксизомен пролифератор рецептор-гама), PGC-1α (активиран от пероксизомен пролифератор рецептор гама коактиватор 1-алфа), PPARα (активиран от пероксизомен пролифератор рецептор алфа), P38 КАРТА (Р38 митоген-активирана протеин киназа), РКА (сАМР-зависима протеин киназа А), TRP (преходен рецепторен потенциал) и UCP1 (отделяне на протеин 1)
Заключение
Тук нашите резултати показват, че RJ индуцира термогенна генна експресия и активиране на НДНТ и поява на кафяв фенотип в WAT, което се нарича потъмняване или бежово. Следователно, RJ регулира адаптивната термогенеза чрез увеличаване на експресията на термогенни гени. Нещо повече, нашите данни показват, че лечението с RJ може да намали телесното тегло в сравнение само с CRD и да предотврати спада или дори спирането на термогенезата, обикновено настъпващи при CR.
Тези открития предполагат важна роля на RJ при лечението на затлъстяването и освен това тези резултати разширяват нашето виждане към диетичните съединения и факторите за покафеняване на мазнините, а също така предлагат нов подход при лечението на затлъстяването чрез процеса на потъмняване на мастната тъкан. Това беше първото проучване, оценяващо ефектите на RJ и TRF върху затлъстели плъхове, хранени с CRD; обаче има малко ограничения за него. Не използвахме генетично модифицирани плъхове, за да потвърдим участието на RJ здраво в TRP-SNS-UCP1 ос. Следователно, по-нататъшни проучвания, използващи TRP или UCP-1 нокаут модели или извършване на лечения с β-адренергични блокери изглеждат много желателни в подкрепа на предложената пътека. Също така не открихме поразителен ефект на TRF върху термогенезата на НДНТ и/или покафеняване на WAT, тъй като всички изоформи на токотриеноли, а също и α-токоферол са налични в TRF. Следователно интерпретирането на резултатите би било трудно поради възможните взаимодействия на токоферол и токотриеноли. Също така са необходими допълнителни изследвания с единичен γ-токотриенол, за да се запълнят тези пропуски в знанията.
Наличност на данни и материали
Наборите от данни, използвани и/или анализирани по време на настоящото проучване, са достъпни от съответния автор при разумна заявка.
- Има ли затлъстяването вредно въздействие върху резултатите от IVF лечението BMC Women; s Здраве Пълен текст
- Последователност, ранно лечение ключ за интервенции при затлъстяване
- Програма за оценка и лечение на екзогенно затлъстяване - CubaHeal
- Запек Странични ефекти от лечението на рак Служби за хранене на рак Университет в Мичиган
- Разширяване на ролята на първичната помощ в превенцията и лечението на детското затлъстяване Преглед на