Резюме
Заден план
Съобщава се, че електроакупунктурата (ЕА) е ефективно лечение за затлъстяване, но механизмът му е неясен. Това проучване има за цел да изследва връзката между хипоталамусната LKB1-AMPK-ACC сигнализация и EA.
Методи
Петдесет мъжки плъхове Sprague – Dawley бяха разделени на две групи, хранени или с чау (група, хранена с чау), или с диета с високо съдържание на мазнини (HF група). След 4 седмици хранене, затлъстелите плъхове в групата на HF (дефинирана като тежаща 20% или повече от плъховете в групата, хранени с чау) са разпределени на случаен принцип в група на EA или индуцирано от диета затлъстяване (DIO). EA групата получи EA на двустранен ST25 – ST36 в продължение на 4 седмици, докато DIO групата не получи допълнителна намеса. Телесното тегло на групите, хранени с чау, DIO и EA се измерва ежеседмично. нивата на иРНК и протеините на хипоталамусния LKB1-AMPK-ACC сигнален път бяха открити, като се използва съответно в реално време (RT) -PCR и Western blot.
Резултати
След 4 седмици лечение с EA, тенденцията за нарастване на теглото на плъховете в групата на EA беше инхибирана в сравнение с тези в групата с DIO. RT-PCR и Western blot показват, че EA регулира транскрипцията на аденозин 5'-монофосфат-активирана протеин киназа α2 (AMPKα2), насърчава експресията на протеин на чернодробна киназа B1 (LKB1) и AMPKα1 и инхибира ацетил-CoA карбоксилазата (ACC) протеин експресия в хипоталамуса.
Заключения
Това проучване предполага, че сигнализирането за хипоталамус LKB1-AMPK-ACC играе важна роля в лечението на EA за затлъстяване.
Заден план
Затлъстяването е световен проблем за общественото здраве и може да доведе до заболявания като коронарна болест на сърцето, диабет и някои видове рак [1]. Проведени са няколко проучвания за ограничаване на нарастващата популация на затлъстяване, но има малко ефективни фармакологични лечения. Само три лекарства са одобрени от Американската администрация по храните и лекарствата за дългосрочно лечение на затлъстяването, а именно лоркасерин (Belviq), фентермин плюс топирамат (Qsymia) и орлистат (Xenical, Alli) [2].
Акупунктурата е една от най-популярните алтернативни терапии и се използва за лечение на затлъстяване от хиляди години. Електроакупунктурата (EA) е често срещана форма на акупунктура, при която електрически ток се предава през иглите за акупунктура. Параметрите на EA могат да бъдат точно охарактеризирани, така че е възпроизводим и данните предполагат, че EA може да бъде по-ефективен от ръчната акупунктура [3]. Последните систематични прегледи показват, че EA е ефективно лечение за затлъстяване [4]. Механизмът на EA за затлъстяването обаче се нуждае от допълнително проучване. Има доказателства, сочещи, че EA може да потисне апетита за контрол на теглото. Възможните механизми, лежащи в основата на ефекта на ЕА, се фокусират върху хипоталамуса [5, 6].
Хипоталамусът регулира приема на храна и енергийния баланс. Хипоталамусната аденозин 5 ′ монофосфат-активирана протеин киназа (AMPK) е призната като хранителен и глюкозен сензор в централната нервна система и регулатор на апетита [7, 8]. Чернодробната киназа B1 (LKB1) е основната киназа нагоре по веригата в AMPK каскадата. LKB1 е конститутивно активен и фосфорилира AMPK в Thr172 на α субединицата [9-11]. Активирането на AMPK се премахва в клетки без липса на експресия на LKB1 или в гризачи след делеция на LKB1 [12, 13]. Един механизъм, чрез който AMPK регулира липидния метаболизъм е чрез фосфорилиране и инактивиране на ацетил-КоА карбоксилаза (АСС), важен ензим, ограничаващ скоростта за синтеза на малонил-КоА [14]. АСС е едновременно предшественик на биосинтеза на мастни киселини и инхибитор на дълговерижния мастен транспорт на ацил-КоА до митохондриите за β-окисление [15]. Съобщава се, че нокдаун/нокаут на ACC1 и ACC2 причинява непрекъснато окисление на мастните киселини, увеличава енергийните разходи и намалява мастната маса [16, 17].
Няколко проучвания са изследвали връзката между EA и AMPK. Tominaga и сътр. [18] предполага, че многократната терапия с ЕА е в състояние да подобри индуцираната от диета инсулинова резистентност, вероятно чрез AMPK сигнализиране на активиране в скелетните мускули. Веднага след EA стимулация фосфо-AMPKα (Thr172) е значително по-висок при животни, получаващи EA, отколкото контролните животни. Kim et al. [19] показа, че нивата на експресия на AMPK ген в хипоталамуса на плъхове определят индивидуалните разлики в чувствителността към индуцирана от ЕА аналгезия. Няма обаче задълбочено разследване на EA и AMPK в хипоталамуса.
Въз основа на модел на диета, предизвикано от затлъстяване (DIO), ние наблюдавахме дали EA може да инхибира наддаването на тегло при плъхове, получили високочестотна диета. Също така изследвахме ролята на сигнализирането за хипоталамуса LKB1-AMPK-ACC в патологията на затлъстяването и механизма за лечение на ЕА.
Методи
Животни и експериментален протокол
54-седмични мъжки плъхове Sprague – Dawley (80–100 g) са получени от Dossy Experimental Animals Company (Ченгду, Китай). Животните бяха настанени в съоръжение с околна температура (22 ± 2 ° C) и се поддържаха в 12/12 h цикли светлина-тъмнина (светлина от 07:00 до 19:00). За да се аклиматизират в новата среда, всички плъхове бяха хранени със стандартна лабораторна чау и налична вода ad libitum през първата седмица на експеримента. Животните бяха разделени на случаен принцип в две групи: група, хранена с чау и група с високо съдържание на мазнини (HF). Групата, хранена с чау (n = 13), получи стандартна лабораторна чау (Dossy Experimental Animals Company, 3,80 kcal/g), съставена от 5% мазнини, 55% въглехидрати, 22% протеин, 7% пепел и 5% фибри. На HF групата (n = 35) е дадена HF диета (4.72 kcal/g), съставена от 22% мазнини, 39% въглехидрати, 23.7% протеин, 4% пепел и 3% фибри. HF храна е направена в лабораторията на авторите. Всеки 100 g HF храна се състои от основен фураж (57,5 g), яйчен жълтък на прах (11,79 g), свинска мас (10 g), сол от свинска жлъчка (0,2 g), казеин (7 g), млечна мощност (13 g), сол (0,085 g) и мая на прах (0,425 g). Теглото на тялото се проследява веднъж седмично в 09:00.
След хранене в продължение на 4 седмици, 24 плъхове, хранени с HF диета, са наддали с 20% или повече над средното тегло на плъховете в групата, хранени с чау, и са определени като затлъстели. След това тези плъхове бяха разпределени на случаен принцип в група EA, която получава EA стимулация в продължение на четири седмици, и група DIO, която не получава допълнително лечение, с 12 плъха във всяка група. Групите, хранени с EA, DIO и чау, бяха настанени индивидуално и хранени със съответните им диети. Приемът на храна и телесното тегло се измерват ежедневно в продължение на 4 седмици. Хипоталами са събрани в края на изследването. Изследването е одобрено от Институционалния комитет по грижа и употреба на животните към Университета по традиционна китайска медицина в Ченгду и всички процедури са проведени в съответствие с Насоките за експерименти с животни и Грижата за животните на Китайската академия на науките.
EA лечение
Плъховете от трите групи бяха съзнателно задържани в пластмасов държач. EA групата е лекувана с EA двустранни акупунктури Tianshu (ST25) и Zusanli (ST36) за 20 минути от 8:00 до 12:00 ч. Сутринта, веднъж на ден, 6 дни в седмицата, общо за четири седмици. Използваните игли бяха стерилни игли от неръждаема стомана за еднократна употреба с диаметър 0,30 mm и дължина 25 mm (Suzhou Hua Tuo Medical Instruments Co. Ltd, Суджоу, Китай). Точките бяха избрани въз основа на стандартите за плъхове, както е записано в Експериментална акупунктура и моксибуция [20]. Тианшу (ST25) е разположен на 5 мм странично от пъпа (5 мм странично от пресечната точка между горната 2/3 и долната 1/3 в линията между мечовидния отросток и горната граница на срамната симфиза). Zusanli (ST36) е разположен между пищяла и фибулата на приблизително 5 mm странично и 5 mm по-ниско до предната туберкула на пищяла. Точките бяха стимулирани с непрекъснат вълнов електрически стимул с интензитет 2 mA и честота 3 Hz за 20 минути, за да се получат леки потрепвания в крайниците. Използван е инструментът EA G6805-II (No. 20,101,014, Qingdao Xinsheng Ltd., Qingdao, China). Плъховете в групите, хранени с чау и DIO, бяха задържани за 20 минути без EA стимулация. Плъховете не показват болка или дискомфорт по време на лечението.
Всички експериментални плъхове бяха гладувани в продължение на 10 часа след последната интервенция и беше записано телесното им тегло (g). Под 20% уретанова (0,8 g/kg) анестезия плъховете бяха евтаназирани. След това хипоталамусните тъкани се дисектират за допълнителни тестове.
Western blot анализ
Хипоталами са дисектирани с помощта на оптичния хиазъм като рострална забележителност, а телата на бозайниците каудално до дълбочина 2 mm. Дисектираните хипоталами незабавно се замразяват в течен азот. Тъканите се хомогенизират в ледено-студен лизисен буфер, съдържащ 0,1% SDS, 10 mM Tris – HCl (рН 7,4), 1% Triton X-100, 1 mM MgCl2 и 1% NP-40. Хомогенатите се центрофугират при 10 000 ж за 10 минути при 4 ° С, супернатантите се отстраняват и аликвотни части се замразяват бързо в течен азот. Хипоталамусният лизат (40 μl) е подложен на електрофореза на натриев додецил сулфат - полиакриламиден гел (SDS-PAGE) върху 6% полиакриламидни гелове и електротрансфериран върху нитроцелулозна мембрана (Millipore, Massachusetts, USA).
Мембраните бяха блокирани за 1.5 h в разтвор за оптимизиране на оптимизатор на техника за трансфер на говежди лакто (50 mM Tris [pH 8.0], 2 mM CaCl2, 0.01% Antifoam A, 0.02% NaN3 и 0.05% Tween 20), съдържащ 5% обезмаслено мляко. След това мембраните се изследват при 4 ° C в буфериран с Tris физиологичен разтвор и Tween 20 (TBST) за една нощ с подходящо разреждане на посочените антитела срещу LKB1 (Abcam, Cambridge, UK), ACC (Abcam, Cambridge, UK), p-AMPKα1 (Abcam, Cambridge, UK), AMPKα1 (Saierbio, Tianjin, China), p-AMPKα2 (Abcam, Cambridge, UK), AMPKα2 (Saierbio, Tianjin, China) и GAPDH (Saierbio, Tianjin, China).
Откриването на протеини се извършва с помощта на конюгирани вторични антитела от хрян (кози анти-заешки антитела, Saierbio, Tianjin, Китай) и подобрен реактив за хемилуминесценция (Western Lightning-ECL; Perkin Elmer, Waltham, MA, USA), след това изложени на филм . Интензивността на протеиновите ленти е изчислена с помощта на софтуера Lab Works 4.0 (UVP Inc., Upland, Калифорния, САЩ).
Екстракция на РНК и PCR в реално време
Статистически анализ
Всички експериментални данни са изразени като средни стойности ± стандартни отклонения. Статистическият анализ беше извършен от SPSS Statistics за Windows, версия 20.0 (IBM, Armonk, NY, USA) и еднопосочна ANOVA за сравнения между групите. За всички анализи, P
Резултати
ЕА инхибира наддаването на тегло от високочестотна диета
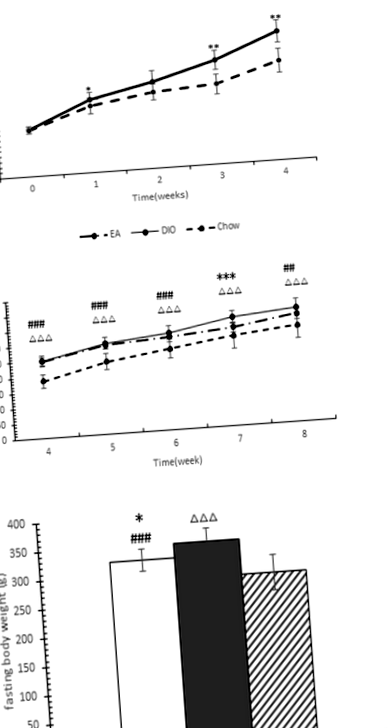
Фигура 1а показва, че плъховете в групата, хранена с HF, са натрупали повече телесно тегло, отколкото тези в чау-фуражите за 4 седмици. Разликите в телесното тегло бяха забележими от 1 седмица, но бяха значителни след 4 седмици. 24 плъхове, хранени с високочестотна диета, затлъстяват (наддават с 20% или повече тегло над средното тегло на плъховете в групата, хранени с чау) и са разделени на две групи в края на 4 седмици. Имаше 12 плъхове в групата DIO и 12 в групата EA.
Фигура 1b показва, че лечението с ЕА инхибира увеличаването на телесното тегло при плъхове, хранени с високочестотна диета. Най-значимите разлики между EA и DIO групите се наблюдават през седмата седмица (P = 0,001), въпреки че телесното тегло между двете групи не се различава значително (с 5,49% по-ниско в EA групата, P = 0,129) в края от експеримента. Фигура 1в показва, че плъховете от групата на ЕА са имали значително по-ниско телесно тегло в сравнение с тези от групата DIO след гладуване в продължение на 10 часа (P = 0,027).
Ефекти на EA върху хипоталамусната AMPK сигнализация
Фигура 2а показва, че плъховете, хранени с HF диета, имат по-ниска експресия на LKB1 (P = 0,000), AMPKα1 (P = 0,020) и AMPKα2 (P = 0,000) и значително по-висока транскрипция на ACC (P = 0,024) от плъховете в група, хранена с чау. EA групата имаше приблизително 48,03% повече AMPKα2 (P = 0,000) и 13,59% по-малко AMPKα1 mRNA (P = 0,000) транскрипти от тази в групата DIO.
Фигура 2b показва, че HF диетата може да потисне съдържанието на протеини в LKB1 (P = 0,000), AMPKα1 (P = 0,019), pAMPKα1 (P = 0,000) и pAMPKα2 (P = 0,000) и да увеличи съдържанието на ACC (P = 0,005). EA групата е имала 182,89% по-високи LKB1 (P = 0,000), 135,42% по-високи pAMPKα1 (P = 0,002) и 84,27% по-ниски ACC (P = 0,003), 19,72% по-ниски нива на AMPKα2 (P = 0,007) от тези в DIO група.
Дискусия
Наблюдавахме, че след 4 седмици високочестотна диета, близо 50% от плъховете са били със затлъстяване. По време на 4-седмичното лечение с ЕА, плъховете от групата с ЕА наддават по-бавно от тези в групата с ДИО, започвайки през третата седмица. RT-PCR и уестърн блотинг показват, че сигнализирането на LKB1-AMPK в хипоталамуса се инхибира от високочестотна диета и ACC е значително регулирано. EA може да регулира транскрипцията на AMPKα2, да насърчава експресията на протеин на LKB1 и AMPKα1 и да инхибира експресията на протеин на ACC, за да контролира наддаването на тегло.
AMPK е широко експресиран в невроните и астроцитите на хипоталамуса и задния мозък, които са двете области, участващи в приема на храна [21]. При нормални физиологични условия хипоталамусният AMPK може да се активира чрез вливане на 5-аминоимидазол-4-карбоксамид 1-β-D-рибофуранозид (AICAR) в третата камера, което значително увеличава приема на храна [22]. Експресирането на доминиращ отрицателен AMPK в хипоталамуса може да намали приема на храна и телесното тегло [23].
Храненето на мишки с високочестотна диета ще доведе до нарушаване на регулацията на AMPK сигналния път, което е свързано с нарушено фосфорилиране на AMPK и понижена експресия на протеини в скелетните мускули, черния дроб и хипоталамуса [24–27].
При патологични състояния е установена силна корелация между ниско ниво на активиране на AMPK и метаболитни нарушения като затлъстяване, инсулинова резистентност и заседнала активност при различни модели гризачи [28, 29]. Следователно, мишките, които нямат AMPK, може да са по-чувствителни към вредните ефекти на прекомерното хранене [30]. В съответствие с тази хипотеза, аблация на цялото тяло на активността на AMPKα2 изостря индуцираното от HF затлъстяване, докато степента на изхвърляне на глюкозата е подобна на тази при мишки от див тип [31].
Като един от най-важните регулатори на енергийния баланс, AMPK има тясна връзка с много хормони, свързани с метаболизма, особено с адипоцитокини, като лептин, адипонектин и апелин. Във физиологични обстоятелства лептинът [32] оказва инхибиторен ефект върху AMPK в хипоталамуса, като стимулира АСС и впоследствие потиска приема на храна, като същевременно конститутивното активиране на хипоталамусния AMPK нарушава анорексигенния ефект на лептина. В допълнение, инхибирането на хипоталамусния АСС отслабва медиираното от лептина инхибиране на приема на храна и увеличаването на телесното тегло [33]. В последно време беше показано, че mTOR/S6K регулира храненето чрез медиирано от лептин инхибиране на AMPK в хипоталамуса [34]. AMPK [35] сигнализирането също регулира производството на адипонектин чрез модулиране на експресията на неговите рецептори и самия него. Apelin [36] е адипоцитокин, известен със своите анти-затлъстяване и антидиабетни свойства, Apelin насърчава експресията на антиоксидантни ензими и потиска експресията на прооксидантния ензим чрез AMPK пътя.
Поради това AMPK се очертава като обещаваща нова цел за лечение на метаболитни нарушения, включително затлъстяване, диабет тип 2 и сърдечно-съдови заболявания. Активирането на AMPK с помощта на AICAR може да увеличи усвояването на глюкоза и окисляването на мастните киселини при затлъстели гризачи с диабет [37, 38] и хора [39–43], което потвърждава терапевтичния потенциал на AMPK активатор.
pAMPK е активираното състояние на AMPK, което се фосфорилира върху треонинов остатък 172 (Thr-172) в α субединицата от горните кинази като LKB1 [44]. Комбинацията от алостерични и фосфорилиращи ефекти причинява повече от 1000 пъти увеличение на киназната активност (в сравнение с по-малко от 5 пъти само за алостерично активиране). Този отговор позволява висока чувствителност при отговори на малки промени в клетъчния енергиен статус [45]. Активираният AMPK катализира дефосфорилирането на ACC, след което повишава нивото на хипоталамус малонил-CoA, което води до потискане на приема на храна и евентуално увеличаване на енергийните разходи [46].
Нашите резултати показват, че EA плъховете имат значително по-високи нива на протеин на LKB1 и pAMPKα1 в сравнение с DIO плъховете. Следователно, EA може да стимулира активността на хипоталамусния AMPK чрез повишаване на нивото му на фосфорилиране и този ефект може да бъде индуциран от увеличаване на неговата киназа нагоре по веригата, LKB1. Междувременно намаляването на нивото на ACC протеин може да е резултат от активиране на AMPK. Промените в сигналния път на хипоталамусния LKB1-AMPK-ACC могат да допринесат за ефекта на EA върху забавянето на наддаването на тегло при плъхове при HF диета. Тази хипотеза обаче трябва да бъде проучена допълнително, вероятно с модели на хипоталамусни LKB1 и AMPK нокдаун плъхове.
Избрахме ST36 и ST25 като акупунктури в това проучване по няколко причини. Първо, предишно проучване показа, че лечението с ЕА на тези акупунктури значително намалява приема на храна и телесното тегло [60, 61]. На второ място, тези две акупунктури са най-често използвани от други за лечение на затлъстяване или в проучвания върху животни, или в клинични проучвания [62]. Трето, съобщава се, че стимулирането на тези акупункти увеличава експресията на AMPK в някои тъкани [18, 19]. Няколко доклада обаче показват, че EA ST36 може да повиши апетита до известна степен [63], но повече проучвания показват, че EA ST36 значително инхибира храненето и наддаването на телесно тегло [64–69]. Възможните механизми са регулираните надолу орексигенни пептиди, като невропептид Y (NPY) [64], повишаващи регулацията на анорексигенните хормони, включително проопиомеланокортин (POMC) [65], α-меланоцит-стимулиращ хормон (α-MSH) [66] и холецистокинин (CCK) [67–69]. Независимо от това, има и други акупунктури, използвани за лечение на затлъстяване, по-нататъшни проучвания трябва да проверят дали стимулацията на други акупунктури действа чрез подобен механизъм като стимулация на ST36 и ST25.
Заключения
Дисрегулация на хипоталамусната LKB1-AMPK-ACC сигнализация беше открита при DIO плъхове. ЕА лечението може да инхибира наддаването на тегло при плъхове DIO, хранени с високочестотна диета. RT-PCR и Western blot показаха, че EA може да действа чрез регулиране на транскрипцията на AMPKα2, насърчаване на експресията на LKB1 и AMPKα1 протеин и инхибиране на експресията на протеин ACC за контрол на енергийния баланс. Това проучване предполага, че сигнализирането за хипоталамус LKB1-AMPK-ACC играе важна роля в лечението на EA за затлъстяване.
- Депо-медроксипрогестерон ацетат, наддаване на тегло и аменорея при затлъстели юноши и възрастни жени
- Промени в експресията на човешки мастни тъкани по време на диета, индуцирана загуба на тегло - FullText -
- Характеристики на режимите на хранене при възрастни с метаболитно затлъстяване и нормално тегло (Корейски национал
- Диета, хранене и предотвратяване на наднормено тегло и затлъстяване - PubMed
- От анорексичка до затлъстяване до здрави Невероятни снимки отчитат екстремните колебания в теглото на жената