Резюме
Електрофорезата може да бъде дефинирана като разделяне на заредени частици в еднородно електрическо поле. За конкретна система от електрофореза напрежението се поддържа постоянно, както и рН и йонната сила на суспендиращата среда.
Tiselius, използвайки система с подвижна граница, разделя серумните протеини чрез електрофореза на четири компонента през 1937 г. 1 Хартиената електрофореза, популярна през 50-те години на миналия век, осигурява първата подкрепа за твърда електрофореза. Крехкостта на хартията като поддържаща среда видя въвеждането на по-здравия целулозен ацетат десетилетие по-късно. Впоследствие се подобрява разделителната способност чрез използване на агарозен гел, който в серумни проби дава 5 ленти на разделяне. 2, 3 В края на 80-те години бяха въведени агарозни гелове с висока разделителна способност, които произвеждаха поне 6 ленти и в зависимост от системата до 17 ленти в серум. 4, 5
Напълно автоматизирана серумна електрофореза започва през 90-те години с въвеждането на капилярна електрофореза (СЕ), повторно въвеждане на течна среда, но с изключителна разделителна способност в сравнение с процедурата на Тизелий. С помощта на CE инструментариума е възможно да се програмира последователност от проби и да се оставят една нощ за обработка.
Обединяването на лаборатории с нарастващ брой проби от пациенти вероятно е било причината за полуавтоматизацията на гел електрофорезата. Въвеждането на гелените системи Helena SPIFE и Sebia Hydrasys осигури начини за електрофорезиране на над сто серумни проби на ден. Днес със сигурност има роля за такива апаратури в лабораториите за електрофореза.
Защо извършваме електрофореза
Основната причина за извършване на електрофореза на серумен протеин е откриването на парапротеинова или В-клетъчна дискразия. Неправилността в гама областта може да се дължи на малка моноклонална лента, свободни леки вериги или олигоклонални IgG. Други находки от клинично значение включват повишени алфа-1 и алфа-2 глобулини, указващи на остра фазова реакция, намаляване на алфа-1 глобулини, предполагащи дефицит на алфа-1 антитрипсин (A1AT) (което може да бъде последвано от фенотипиране, за да се провери за клинично значим вариант A1AT), увеличаване на бета-1 региона, предполагащо повишен дефицит на трансферин и желязо, поликлонално увеличение на гама глобулини, което е показателно за амация или инфекция или чернодробно заболяване.
Основната причина за извършване на електрофореза на уринен протеин е да се намери миелом на лека верига, произвеждащ излишък от свободни леки вериги (протеин Bence Jones), важна част от екрана на миелома. Лента в електроферограмата на протеина в урината може също да е резултат от непокътнат моноклонален имуноглобулин, особено ако пациентът има лоша бъбречна функция. Имунофиксацията е важна при определянето на естеството на лентата и при разграничаването между протеин Bence Jones и непокътнат моноклонален протеин, произхождащ от серума. От електроферограмата на урината също така можем да разберем дали протеинурията е от гломерулен произход с преобладаване на албумин или има тубуларни компоненти с екскреция на по-малки протеини с молекулно тегло като свързващ протеин на ретинол и алфа-1 микроглобулин. Понякога се наблюдава фрагментиран албумин в урината, но е с неизвестно значение. 6
В исторически план урината е била концентрирана или чрез отстраняване на вода от образеца, оставяйки протеините в по-висока концентрация, или чрез центрофугиране, при което протеините се отделят от по-голямата част от водата. Демонстрацията на протеиновите компоненти на урината от концентрирани проби първоначално се извършва върху целулозен ацетат, а по-късно върху агароза и агарозен гел с висока разделителна способност. Използването на CE за анализ на урина досега не е постигнато от производители на инструменти като Beckman или Sebia, въпреки че Sebia популяризира метод, който включва диализа, последвана от стъпка на центрофугиране. Публикуван е алтернативен метод за протеин в урината, използващ CE. 7
Електрофоретични техники в по-големи детайли
Електрофорезата с агарозен гел с висока разделителна способност, независимо дали е търговска или вътрешна, се използва рутинно повече от 20 години и със серум осигурява разделяне между 6 и 17 ленти. Доказано е, че техниката дава възпроизводимо количествено определяне на моноклонални ленти, при условие че буферното рН, напрежението и вида на петно се възпроизвеждат щателно. Имунофиксацията на гелове с висока разделителна способност се използва успешно за демонстриране на моноклонални IgA и IgM парапротеини с ниско ниво. Електрофорезата с агарозен гел с висока разделителна способност, заедно с имуноблотинг, може също да се използва за отделяне на различните изоформи на трансферин като азиалотрансферин или бета-2-трансферин. Това е важно при откриването на такива протеини в CSF и в други проби от течове.
Разделянето на серумните протеини чрез СЕ е демонстрирано за първи път в началото на 90-те години. CE е техника, която дава отлично разделяне на серумните протеини, като същевременно намалява времето за работа, необходимо чрез автоматизация.
При CE, рН на използвания буфер трябва да бъде постоянно за дадена система, независимо дали се използва търговски или изследователски инструмент до ключ. Приложеното напрежение на CE между 8 и 17 kV е много по-високо от 250–400 V, използвано с агарозни гелове (Таблица 1). Използването на дължини на вълните в далечния UV за откриване на поглъщане на светлина от пептидни връзки избягва променливо оцветяване на протеини с конвенционални техники за откриване (Таблица 1). В тази връзка е показано, че чувствителността на детектиране при 200 nm е три пъти по-голяма от тази при 215 nm.
маса 1
Сравнение на условията на метода на електрофореза.
| Волтаж | 250 V | 240 V | 8 - 18 kV |
| Буфер | Барбитал | Трис Барбитал | Борна киселина |
| pH буфер | 8.6 | 8.5 | 9,9–10,3 |
| Откриване | Видимо петно | Видимо петно | UV абсорбция |
Електроосмотичният поток е изключително важен феномен в CE. Ако буферът е над pH 2, вътрешната повърхност на слетия силициев капиляр се зарежда отрицателно поради изложени силанолови йони. В електрическо поле хидратираните катиони в дифузния двуслоен слой в непосредствена близост до силициевата стена мигрират към катода, влачейки разтворител със себе си. Това се нарича електро-осмотичен поток. Редът на миграция на протеини покрай детектора ще отразява баланса между електрофоретичните и електроосмотичните сили в капиляра. Чрез регулиране на рН на буфера, електроосмотичният поток може по принцип или да засили, или да се противопостави на електрофоретичната миграция. При анализ на серумните протеини използваното рН е значително алкално (Таблица 1) и анодната електрофоретична миграция е доминирана от катодна електро-ендосмоза.
Имуносубстракция, концепция, предложена първоначално от Aguzzi и Poggi, 8, се използва в СЕ по аналогичен начин на имунофиксация върху агарозни гелове - позволява да се идентифицират парапротеините, открити в серума, като се използват специфични имуноглобулинови антитела. Чрез прикрепване на антителата към твърди носители като мъниста, всеки компонент, свързващ се с антитялото, ще се прикрепи към носителя и ще се отстрани от разтвора. Ако парапротеинът, наблюдаван в CE, е IgG (капа) например, свързването (и отстраняването) на парапротеина с IgG и капа антитела ще доведе до намаляване на лентата, докато антителата към IgA, IgM и ламбда компонентите няма да имат такъв ефект.
Други техники, използвани с електрофореза
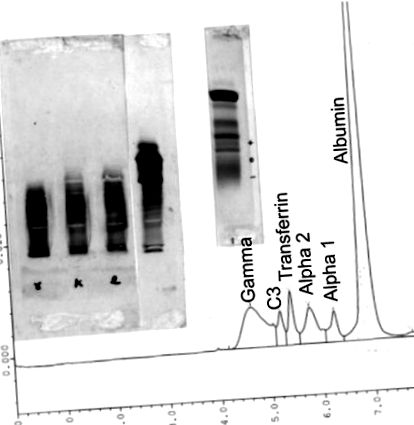
Съществуват няколко техники, които могат да бъдат използвани заедно със серумна и уринна електрофореза при определяне на размера и идентичността на дискразията на плазмените клетки, която пациентът може да има. Тези техники включват изоелектрично фокусиране на серума и урината на пациента, 9 имунофиксация, или електрофореза на серумен протеин за идентифициране на особено ниски нива на IgA и IgM, или изоелектрично фокусиране, за да се направи разлика между моноклонален протеин, виден IgG (капа) или IgG (ламбда) клон, олигоклонален IgG или свободни леки вериги. Разделителната способност на имунофиксацията на изоелектричното фокусиране е приблизително пет пъти по-добра от резолюцията на имунофиксацията на електрофорезата. В този брой има и статия от FN Cornell за тези допълнителни техники. Сравнение на техниките на капилярна електрофореза, електрофореза с висока разделителна способност и изоелектрично фокусиране са показани на фигури 1 - 4 .
Техники на (отдясно наляво) капилярна електрофореза, електрофореза с агарозен гел с висока разделителна способност, оцветена с амидо черно и изоелектрично фокусиране на нормален серум, оцветена с комаси синьо след имунофиксация с анти-човешки IgG, анти-човешка капа верига и анти-човешка ламбда леки верижни антисеруми и киселинно фиксиране.
Техники на капилярна електрофореза, електрофореза с агарозен гел с висока разделителна способност, оцветена с амидо черно, и изоелектрично фокусиране на серума със свободни каппа леки вериги, оцветени с комаси синьо след имунофиксация с анти-човешки IgG, анти-човешка каппа лека верига и анти-човешка ламбда светлина верижни антисеруми и киселинно фиксиране.
Количественото определяне на парапротеина в серума на пациента трябва да бъде от електроферограмата, ако се използва CE метод, или чрез денситометричен анализ, ако се използва гел електрофореза. Донякъде произволно, миеломът се диагностицира чрез откриване на моноклонален IgG над 20 g/L или моноклонален IgA над 10 g/L. Пациентите с моноклонални ленти с по-ниска концентрация могат да бъдат класифицирани като MGUS (моноклонална гамопатия с неопределено значение). Моноклонален IgM обикновено е показателен за макроглобулинемията на Waldenström и само в редки случаи показва миелом.
Количественото определяне на имуноглобулини IgG, IgA или IgM, чрез имунонефелометрични или имунотурбидометрични методи, ще покаже дали остатъчните гама глобулини на пациента са намалени или в референтния интервал. 10 Когато има пролиферация на моноклонален протеин, намаляването на остатъчните гама глобулини е значително.
През последните три години количественото определяне на свободните каппа и безплатни ламбда леки вериги с помощта на комплекта Free Lite ™ от The Binding Site (Бирмингам, Великобритания) взе откриването на леки вериги в серума до диапазона mg/L. В резултат на това съотношението на свободна капа и свободна ламбда има определен референтен интервал. Резултатите извън този интервал предполагат повишено количество свободни леки вериги в кръвообращението на пациента и че може да са необходими допълнителни хематологични изследвания. Количественото определяне на леките вериги е част от работата с протеини върху пациент, заподозрян в миелом и в идеалния случай се съобщава заедно с резултатите от електрофорезата на серум и урина на пациента.
Повишена сложност на лентите при пациенти с миелом
След като работих в лаборатория в продължение на няколко години, наблюдавах нарастваща сложност на моноклоналните ленти в серумите на пациентите. Преди десет години обикновено откривахме само една моноклонална лента, докато напоследък откриваме все по-голям брой пациенти с две моноклонални ленти с различни тежки вериги или три или четири моноклонални ленти, често с различни видове тежки и леки вериги. Дали това откритие произхожда от фактори на околната среда, генетични фактори или по-добро откриване тепърва ще се определя. От лабораторна гледна точка това трябва да се има предвид при изследване на серума на пациент за миелом.
Заключение
Техниките, използвани за електрофореза на серумен и уринен протеин, са се подобрили значително както в откриването, така и в разделителната способност през последните 70 години. По-сложните техники на изоелектрично фокусиране, имунофиксация и количествено определяне на имуноглобулините са важни при работата на пациент, заподозрян в миелом. Анализът на леки вериги без серум осигурява допълнителен инструмент, който може да помогне на лабораторията в този процес.
Техники на капилярна електрофореза, електрофореза с агарозен гел с висока разделителна способност, оцветена с амидо черно и изоелектрично фокусиране на серума с IgG (ламбда) парапротеин, оцветена с комасиево синьо след имунофиксация с анти-човешки IgG, анти-човешка каппа лека верига и анти-човешка ламбда леки верижни антисеруми и киселинно фиксиране.
Техники на капилярна електрофореза, електрофореза с агарозен гел с висока разделителна способност, оцветена с амидо черно, и изоелектрично фокусиране на серума с олигоклонален IgG, оцветен с комаси синьо след имунофиксация с анти-човешки IgG, анти-човешка капа верига и анти-човешки ламбда леки вериги антисеруми и киселинно фиксиране.
Бележки под линия
Конкуриращи се интереси: Никой не е деклариран.
- Връзка на концентрациите на серумен адипонектин и лептин с разпределението на телесните мазнини при хората -
- Прегледайте Vichy LiftActiv Peptide-C ампулен серум BTY ALY
- Приятелката ми иска да си отделя урина
- Храна след тренировка за отслабване Най-добрите протеини, въглехидрати за ядене след тренировка за оптимално тегло
- SLIM EXTREME 4D DIAMOND ОТСЛАБВАЩ СЕРУМ АНТИЦЕЛУЛИТ