Кристина А. Метилди
1 Калифорнийски университет в Сан Диего, Сан Диего, Калифорния
Шармеела Каушал
1 Калифорнийски университет в Сан Диего, Сан Диего, Калифорния
Синтия С. Снайдер
1 Калифорнийски университет в Сан Диего, Сан Диего, Калифорния
Робърт М. Хофман
1 Калифорнийски университет в Сан Диего, Сан Диего, Калифорния
2 AntiCancer, Inc, Сан Диего, Калифорния
Майкъл Буве
1 Калифорнийски университет в Сан Диего, Сан Диего, Калифорния
Резюме
Заден план
Ние попитахме дали флуоресцентно-ориентираната хирургия (FGS) може да подобри хирургичните резултати при флуоресцентни ортотопични модели на голи мишки на рак на дебелото черво.
Методи
Установихме флуоресцентни ортотопични миши модели на човешки рак на дебелото черво, експресиращи флуоресцентен протеин. Туморите бяха резецирани при операция с ярка светлина (BLS) или FGS. Бяха получени пре- и следоперативни изображения със системата за образна диагностика на малки животни OV-100, за да се оцени степента на хирургична резекция.
Резултати
Всички мишки с първичен тумор, които са претърпели FGS, са имали пълна резекция в сравнение с 58% от мишките в BLS групата (p = 0,001). FGS води до намаляване на рецидивите в сравнение с BLS (33% срещу 62%, p = 0,049) и удължава средната преживяемост без заболяване от 9 седмици до> 36 седмици. Средната обща преживяемост се е увеличила от 16 седмици в BLS групата до 31 седмици в групата FGS. FGS доведе до излекуване при 67% от мишките (живи без данни за тумор на> 6 месеца след операцията) в сравнение с само 37% от мишките, подложени на BLS (p = 0,049).
Заключения
Хирургичните резултати при ортотопични модели с голи мишки на рак на дебелото черво при човека са значително подобрени с FGS. Настоящото проучване може да бъде преведено в клиниката чрез различни ефективни методи за флуоресцентно маркиране на тумори.
Въведение
Единственият най-важен прогностичен фактор за цялостната преживяемост при пациенти с колоректален рак (CRC) е не само микроскопският статус на резецирания ръб, но и пълната резекция на тумора на всички места (R0) (1, 2). Постигането на R0 резекция може значително да подобри 5-годишните нива на преживяемост при пациенти с колоректален рак (3). Дългосрочната преживяемост след резекция на CRC зависи от радикалността на хирургичната процедура (4). Следователно пълното откриване на първични и метастатични лезии по време на операцията е жизненоважно за оптимизиране на хирургичната резекция. Има явно предимство за оцеляване при пълна резекция на първична и метастатична CRC, когато е клинично подходящо (5).
По-рано демонстрирахме подобрената визуализация и откриване на първични и метастатични лезии с използването на флуоресцентни сонди (6-9). В това проучване ние съобщаваме за ефективността на използването на флуоресцентна хирургична резекция за подобряване на резултатите чрез оптимизиране на хирургична резекция при миши модели на рак на дебелото черво на човека. Подобрените резултати включват намаляване на честотата на рецидиви и по този начин подобряване на общата преживяемост.
Материали и методи
Клетъчна култура
Клетъчни линии на човешки рак на дебелото черво HCT-116-GFP, експресиращи зелен флуоресцентен протеин (GFP) и HT-29-Ds Red, експресиращи червен флуоресцентен протеин (RFP), се поддържат в DMEM (Gibco-BRL, Grand Island, NY), допълнени с 10% фетален говежди серум (Hyclone, Logan, UT). Средата за клетъчни култури беше допълнена с пеницилин/стрептомицин (Gibco-BRL), натриев пируват (Gibco-BRL), натриев бикарбонат (Cellgro, Manassas, VA), L-глутамин (Gibco-BRL) и минимални основни несъществени аминокиселини (Gibco-BRL). Клетките се инкубират при 37 ° С с 5% въглероден диоксид.
Грижа за животните
Женски атимични ню/ню голи мишки бяха поддържани в бариерно съоръжение върху високоефективни стелажи с филтрирани частици с въздух. Животните бяха хранени с автоклавирана лабораторна диета за гризачи (Teckland LM-485; Western Research Products, Orange, CA). Всички хирургични процедури се извършват под анестезия с интрамускулно инжектиране на 100 μL смес от 100 mg/kg кетамин и 10 mg/kg ксилазин. За всяка процедура се прилагат 20 μL от 1 mg/kg бупренорфин за контрол на болката. Евтаназията е постигната чрез 100% вдишване на въглероден диоксид, последвано от цервикална дислокация. Всички проучвания върху животни са одобрени от Институционалния комитет по грижа и употреба на животните на UCSD (IACUC) и са проведени в съответствие с принципите и процедурите, описани в Ръководството на Националните институти по здравеопазване (NTH) за грижа и употреба на животните.
Имплантиране на подкожна туморна клетка
Човешки HCT-116-GFP ракови клетки на дебелото черво се събират чрез трипсинизация и се промиват два пъти със среда без серум. Клетки (2 × 10 в 6 μl безсерумна среда) се инжектират подкожно в рамките на 30 минути след събирането през десния и левия фланг при женски мишки nu/nu между 4 и 6 седмична възраст. Подкожните тумори се оставят да растат в продължение на 2-4 седмици, докато станат достатъчно големи, за да осигурят достатъчен тумор за ортотопична имплантация.
Ортотопична имплантация на тумор
За клетъчна ортотопична имплантация (COI) човешкият рак на дебелото черво HT-29-Ds-Червените клетки се събират чрез трипсинизация и се промиват два пъти със среда без серум. Проверява се, че жизнеспособността е по-голяма от 95%, използвайки автоматизирания анализатор на жизнеспособността на клетките Vi-Cell XR (Beckman Coulter, Brea, CA). HT-29-Ds-Червените клетки бяха ресуспендирани при концентрации от 2 милиона клетки на 10 μl среда без серум. Направен е среден коремен разрез и цекумът е доставен през разреза. Ортотопични модели на човешки рак на дебелото черво са установени при голи мишки чрез директно инжектиране на флуоресцентни HT-29-Ds червени туморни клетки в стената на сляпото черво с помощта на спринцовка Hamilton (Hamilton Co, Reno NV). За хирургична ортотопична имплантация (SOI), единичен 1 mm 3 туморен фрагмент от подкожните тумори HCT-116-GFP е зашит до мезентериалната граница на цекалната стена с помощта на 8-0 найлонови хирургични конци. След завършване цекумът е върнат в корема и разрезът е затворен на два слоя, като се използват 6,0 не абсорбиращи се шева Ethibond (Ethicon Inc., Somerville, NJ).
Резекция на тумор
Образи на животни
За да се оцени рецидивът и да се следи прогресията на тумора следоперативно, се правеха ежеседмични изображения на цялото тяло на мишките със системата за изображения на малки животни Olympus OV-100 (Olympus Corp, Токио, Япония), съдържаща източник на светлина MT-20 (Olympus Biosystems, Planegg Германия) и DP70 CCD камера (Olympus Corp.). Всички изображения бяха анализирани с Image J v1.440 (Национален институт по здравеопазване, Bethesda, MD).
Хистология на тъканите
За корелация на хирургичните находки с хистологията, туморните проби бяха отстранени с околните нормални тъкани по време на резекцията. Проби от прясна тъкан бяха фиксирани в разтвор на Bouins и областите от интерес, вградени в парафин, преди разрязването и оцветяването с H&E за стандартна светлинна микроскопия. Постоянните секции, оцветени с H & E, бяха изследвани с помощта на микроскоп Olympus BX41, оборудван с Micropublisher 3.3 RTV камера (QImaging, Surrey, BC, Канада). Всички изображения са получени с помощта на софтуера QCapture (QImaging) без обработка след придобиване.
Обработка на данни и статистически анализ
За всички статистически анализи беше използвана PASWStatistics 18.0 (SPSS, Inc.). Тежестта на тумора се изразява или като медиана (диапазон), или като средна стойност ± SEM. Използва се t-тест на Student за сравняване на непрекъснати променливи между две групи; Използвани са ANOVA модели за сравняване на множество групи. Сравненията между категориалните променливи бяха анализирани с помощта на точните тестове на Fisher. Резултатите от оцеляването бяха сравнени с помощта на тестове за ранг на лога и съотношенията на риска с техните 95% доверителни интервали бяха изчислени, използвайки модели на пропорционални опасности на Кокс. Стойността на р <0,05 се счита за статистически значима за всички сравнения.
Резултати
Флуоресцентна хирургия на CRC в режим на ортотопична мишка
Първата ни цел беше да подобрим хирургичните резултати с FGS при ортотопични миши модели на човешки рак на дебелото черво. За да се постигне това, бяха създадени ортотопични модели на мишки чрез имплантиране на ярко флуоресцентни HT-29-ds червени туморни клетки или HCT-116-GFP туморни фрагменти в цекалните стени на nu/nu женски мишки. Няма значителна разлика в предоперативната туморна тежест сред рандомизираните групи (p = 0,728). Микроскопът за разсейване на флуоресценция Olympus MVX-10 на дълги разстояния се използва за извършване на операции при всички мишки. Резекциите в групата BLS бяха извършени при ярка светлина. Флуоресцентното осветление беше постигнато чрез GFP или RFP филтър, който беше използван за извършване на FGS.
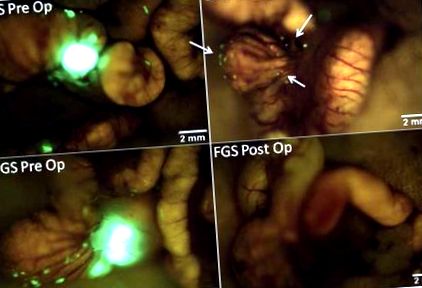
Преживяхме значително подобрение при визуализацията на първичен рак на дебелото черво, както и отделни субмилиметрови метастатични отлагания на тумора върху сляпото черво, позволявайки подобрено разграничаване на тумора от околните нормални черва и мезентериална тъкан в групата на FGS (Фигура 1). Тази подобрена способност за идентифициране на туморни граници позволява по-пълна резекция на рака, което води до значителна разлика в честотата на R0 резекции сред хирургичните групи (Таблица 1). Постигната е резекция на R0 при всички мишки, подложени на FGS въз основа на следоперативно изобразяване. BLS обаче осигурява скорост на резекция на R0 от само 58%, като по този начин оставя значително повече мишки с остатъчно заболяване следоперативно в сравнение с FGS (p = 0,001).
Пред- и следоперативни изображения под FGS и BLS в ортотопичен модел на мишка. Това са представителни пре- и следоперативни изображения на мишка от BLS групата (горния панел) и FGS групата (долния панел). Подобрената способност за визуализиране и идентифициране на туморни граници под флуоресцентно ръководство позволи по-пълна резекция. Всички мишки от групата на FGS са подложени на R0 резекция, докато само 58% от мишките от групата BLS нямат данни за остатъчен флуоресцентен тумор на следоперативни изображения (стрелки в горния десен панел) (p = 0,001).
- Хирургия за резекция на дебелото черво за полипи или рак на дебелото черво Хирургични специалисти от Орегон
- Химиотерапия Страничен ефект Лекува Грижи за рак на градински чай Естествен център за лечение на детоксикация на рак
- Диетични препоръки за полипи на дебелото черво и рак на дебелото черво - Ървайн, Калифорния; Нюпорт Бийч, Калифорния
- Дивертикуларна болест - дебело черво; Сътрудници по ректална хирургия
- Развенчаването на мита, че соята увеличава риска от рак на маточната шийка - Раково здраве