Резюме
Въведение
Дисфункцията на регулирането на фосфатите има сериозни клинични последици. Всъщност проучванията при хора показват, че дори малките повишения на серумните нива на фосфатите (в рамките на нормалните или почти нормалните граници) корелират с повишената заболеваемост и смъртност (9). Това показва, че откриването и лечението на повишен серумен фосфат може да бъде важно при здрави индивиди, както и такива със състояния като ХБН, при които хиперфосфатемията е свързана с повишен риск от сърдечно-съдови събития и смърт (10,11).
Фосфат и ХБН
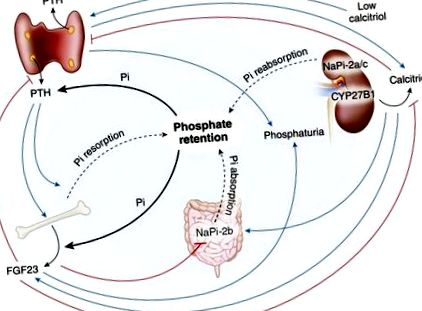
Значението на задържането на фосфати при ХБН беше оценено още в началото на бъбречните изследвания. Ежедневната поддръжка на фосфат изисква количеството фосфат, което постъпва в извънклетъчната течност, да се равнява на количеството, което се екскретира в урината (13). През 1968 г. нашата лаборатория установи, че тубулната реабсорбция на фосфат намалява пропорционално на тежестта на ХБН (15). При нормален GFR от 120 ml/min се отделят приблизително 10% от филтрирания фосфат, докато при много нисък GFR от Фигура 2). В допълнение, калцимиметичният синакалцет намалява PTH, свързания с ядрен рецептор протеин 1 и експресията на FGF23 при уремични плъхове. Тези проучвания подкрепят други констатации при пациенти на диализа, че синакалцет намалява серумния PTH и води до намалени серумни нива на FGF23 (37). Нещо повече, проучвания в нашата лаборатория показват, че синакалцет намалява PTH и FGF23 и предизвиква хиперфосфатемия при плъхове с бъбречна недостатъчност (38).
Паратироиден хормон (PTH) -фибробластен растежен фактор 23 (FGF23) обратна връзка. PTH се свързва с рецептора на паратиреоидния хормон (PTH1R) върху остеоцитите и остеобластите и активира протеин киназа А (PKA), което увеличава експресията, свързана с ядрен рецептор протеин 1 (Nurr1). След това Nurr1 се свързва с дефинираните от нервния растежен фактор елементи на отговор на клонинг В в промотора на FGF23 и индуцира транскрипция на FGF23. FGF23 от своя страна инхибира производството на PTH. При CKD обаче хиперпаратиреоидизмът увеличава експресията на Nurr1 и FGF23, но понижаването на регулаторния комплекс на FGF23 (Klotho-фибробластичен растежен рецептор 1 [FGFR1]) прави паращитовидната жлеза (PTG) и бъбреците устойчиви на действията на FGF23. Калцимиметиците намаляват PTH, Nurr1 и FGF23. Променено от справка 36, с разрешение.
Трябва да се отбележи, че в допълнение към добре познатите стимулатори на FGF23 (т.е. калцитриол, PTH и фосфат), други фактори, като възпаление, калций, метаболитна ацидоза, лептин и дефицит на желязо, както и някои интравенозни железни препарати също са известни индуктори на FGF23 (47–51). Увеличението на FGF23 може да бъде резултат от увеличена транскрипция или намаляване на разцепването на FGF23, за което е известно, че е нарушено при ХБН (52).
α-Klotho (Klotho) е еднопроходен трансмембранен 130-kD протеин, който първоначално е идентифициран като фактор против стареене, но сега е признат за ключов играч в калциевата и фосфатната хомеостаза. Разтворима форма на Klotho, която има ендокринни и физиологични ефекти и действа независимо от FGF23, се намира в кръвта, урината и цереброспиналната течност (53). Разтворимият Klotho възниква чрез алтернативно сплайсиране на неговия транскрипт или от протеолитично разцепване на извънклетъчния домен на трансмембранната форма (проливане на ектодомен) (54). Счита се, че бъбрекът е основният източник за производството на разтворим Klotho (55).
Klotho може да е един от най-ранните биомаркери на AKI. Hu et al. (66) показа, че намаляването на бъбречния протеин Klotho предхожда увеличаването на креатинин в модел на AKI плъх. При хората разтворимите нива на Klotho са намалени при пациенти с AKI (67). В друго проучване експресията на бъбречна Klotho намалява при пациенти с AKI в зависимост от тежестта на заболяването, независимо от етиологията, и ниска експресия на Klotho, свързана с лош краткосрочен резултат (68). Следователно намаляването на Klotho може да бъде ключова патологична характеристика в развитието на AKI и прогресията до ХБН.
ХБН обикновено се счита за състояние на тежък дефицит на Klotho и намаляването на бъбречната експресия на Klotho е една от най-ранните промени, наблюдавани при ХБН (69,70). При напреднала ХБН резистентността към FGF23 се дължи на намалената експресия на паратироидния Klotho-FGFR1 рецепторен комплекс в бъбреците, PTG и аортата (59,66,71). Намалени концентрации на бъбречна и разтворима Klotho се откриват при мишки с експериментално индуцирана ХБН (72), а нашата лаборатория наскоро съобщи, че експресията на бъбречната Klotho е драстично намалена при уремични плъхове (57). Освен това се установяват намалени бъбречни и разтворими нива на Klotho при пациенти с ХБН (73,74). По-ниските нива на серумен Klotho значително корелират с по-ниските нива на eGFR при пациенти с ХБН (75). Важното е, че Kim et al. (76) установяват, че ниските нива на серумен Klotho са свързани с прогресията на CKD независимо от FGF23, протеинурия или PTH, което предполага, че α-Klotho може да служи като полезен клиничен биомаркер за прогресията на ХБН. В допълнение, Barker et al. (77), използвайки ново синтетично антитяло, наскоро установи, че разтворимият Klotho е бил намален рано при ХБН, предшестващ хиперфосфатемия и увеличаване на FGF23 и PTH. Това допълнително подчертава ролята на Klotho като биомаркер на бъбречно увреждане.
Фосфатни и сърдечно-съдови заболявания
Сърдечно-съдовите заболявания са водещата причина за смърт при пациенти с ХБН по начин, независим от рискови фактори, като анамнеза за сърдечно-съдови заболявания или наличие на документирана протеинурия (78,79). Повишената заболеваемост и смъртност в резултат на сърдечно-съдови заболявания са свързани със съдова калцификация при тези пациенти. Хиперфосфатемията е сериозно усложнение при късен стадий на ХБН и съществува добре известна връзка между хиперфосфатемия и сърдечно-съдови заболявания при пациенти на диализа.
Калцификацията на съдовете е активен, регулиран от клетките процес, при който извънматочното отлагане на калциево-фосфатни соли се случва в кръвоносните съдове, главно в артериите или сърдечните клапи. Интимното калциране (калциране на най-вътрешния слой на васкулатурата) е свързано с атеросклеротична плака, а медиалното калциране (т.е. склероза на Mönckeberg) е свързано с втвърдяване на кръвоносните съдове. Съдовата гладка мускулна клетка (VSMC), която съставлява по-голямата част от клетките в средата, е от основно значение за калцификацията, предизвикана от фосфати. Високите нива на фосфат в културата индуцират трансформация на VSMCs в остеобластоподобни клетки чрез посредничеството на активността на Pit-1, тип 3 натриев зависим фосфатен котранспортер (80). Shroff et al. (81) показа, че високите нива на фосфат в култури на артериални пръстени от пациенти с ХБН насърчават калцификацията на съдовете, в резултат на което се наблюдават апоптоза и смърт на VSMC. Културата на съдови пръстени от нормални субекти не показва калцификация, което предполага, че нормалните VSMC имат присъщи пътища за предотвратяване на калциране, докато CKD грундира VSMC и ги прави податливи на калцификация.
Известно е, че ХБН активира ендотелните клетки и генерира получени от мембраната микрочастици (MPs), които са везикули, отделени от плазмените мембрани на клетките, като тромбоцити, ендотелни клетки и левкоцити (82). Ендотелните MP са маркери за съдова дисфункция при ХБН и възможни причини за тромбоза и сърдечно-съдови заболявания (83,84). Високите нива на извънклетъчен фосфат индуцират производството на MP в култивирани ендотелни клетки (85). В човешките съдови ендотелни клетки Abbasian et al. (85) установяват, че високите нива на извънклетъчен фосфат водят до увеличаване на вътреклетъчната концентрация на фосфат, медиирано чрез транспортери Pit-1/slc20a1. Увеличаването на вътреклетъчния фосфат води до промени в протеиновото фосфорилиране, което от своя страна води до освобождаване на силно прокоагулантни MP. Следователно депутатите могат да бъдат част от патологичен сигнален път, който свързва хиперфосфатемия при пациенти с ХБН и сърдечно-съдови събития.
При хората дори леко повишаване на серумния фосфат може да увеличи риска от сърдечно-съдова калцификация. По-високите нива на фосфати в нормалните граници са свързани със съдова и клапна калцификация при пациенти с умерена ХБН, независимо от нивата на ПТХ и калцитриол (86). Всъщност по-високите серумни концентрации на фосфати, попадащи в нормалните граници, са свързани със сърдечно-съдови събития и смъртност при пациенти с нормална и абнормна бъбречна функция (9,87). Скорошно проучване на Shang et al. (88) показа, че хиперфосфатемията е независим рисков фактор за прогресията на калцификацията на коронарните артерии. Нивата на фосфатите са положително свързани с приема на протеини и адекватността на перитонеалната диализа, което предполага, че ограничаването на приема на фосфати може да бъде полезно за забавяне на прогресията на съдовата калцификация. Нашата лаборатория наскоро отчете значително намаляване на аортната калцификация и намалена смъртност, както и запазена бъбречна функция, използвайки фосфатни свързващи вещества и диетично ограничаване на фосфатите при уремични плъхове; анализът на Каплан-Майер на смъртността и преживяемостта в това проучване е показан на Фигура 3 (89).
Активатор на витамин D рецептор парикалцитол предотвратява понижаването на бъбречната Klotho при уремични плъхове. (А) Представителни изображения на Klotho имунооцветяване на нормална, уремична и уремична третирана с парикалцитол бъбречна тъкан. Klotho е открит в проксималните тубули, дисталните тубули и събирателните канали на бъбречната тъкан. Оригинално увеличение, × 200. Мащабна лента, 50 μm. (Б) Количественото определяне на Klotho имунооцветяване показва, че Klotho протеинът е значително намален с 65,5% при уремичните плъхове; това намаление се блокира от лечение с парикалцитол. IOD, интегрирана оптична плътност. α P≤0,01 спрямо нормално (n = 6 всеки; средно ± SEM). (C) Количественото определяне на бъбречната Klotho иРНК показва значително намаление от 78,3% в експресията на Klotho при уремични плъхове, което е блокирано от лечение с парикалцитол. β P≤0,05 спрямо уремичен (n = 6 всеки; средно ± SEM). Ct, PCR номер на цикъла при прагова стойност. Променено от справка 57, с разрешение.
Заключение
Нашето разбиране за дисрегулирания минерален метаболизъм, открит при ХБН, се разшири значително през последните 50 години бъбречни изследвания. По-специално, неотдавнашното откритие на FGF23 и Klotho спомогна за изясняване на аспектите на ендокринната регулация на минералния метаболизъм както в здравето, така и в болестта и наложи актуализиране на добре установени хипотези. Това, което остана непроменено през всичките тези години, обаче е признанието, че задържането на фосфати е иницииращият фактор за развитието на много от усложненията, наблюдавани при ХБН, а именно 2 ° HPT и костни и сърдечно-съдови заболявания. Свързването на задържането на фосфати с заболеваемостта и смъртността на пациентите прави регулирането на серумния фосфат приоритет при пациента с ХБН. Въпреки това, ключът към всяко ефективно лечение на хиперфосфатемия е спазването и настоящите лечения не са лишени от странични ефекти или неудобства. Следователно, комбинирането на терапии, насочени към диетичен фосфат, фосфатни свързващи вещества, манипулатори на фосфатните транспортери, супресори на PTH и методи за повишаване на регулацията на Klotho и/или намаляване на нивата на FGF23, може да бъде оптимално при лечението на задържане на фосфати при ХБН.
Разкриване
Вашингтонския университет и Е.С. може да получава доходи въз основа на лиценз за свързана технология от Университета на Уисконсин (Мадисън, Уисконсин). C.S.R. няма данни за оповестяване.
Благодарности
Тази работа беше подкрепена с грант от Университета във Вашингтон в областта на бъбречните заболявания (3068-31030A), Център за изследване на бъбречни заболявания във Вашингтон O'Brian Center (P30DK079333) и грант на програма AbbVie IIS.
- Роля на анализ на албумин върху нивата на калция и предписване на фосфатни свързващи вещества в хронична форма
- Натриев фосфат едноосновен; Натриев фосфат двуосновна клизма
- Цел на фосфатния кръвен тест, високо срещу
- Токсичност за гъби - StatPearls - NCBI рафт за книги
- Растителна токсичност; Франсис Харкорт-Браун