Катедра по гастроентерология, Медицински колеж Mayo Clinic, Рочестър, MN, САЩ
Катедра по гастроентерология, Медицински колеж Mayo Clinic, Рочестър, MN, САЩ
Катедра по имунология и отделение по ревматология, Медицински колеж Mayo Clinic, Рочестър, MN, САЩ
Кореспонденция: д-р Veena Taneja, отдел по имунология, клиника Mayo, 200 First Street SW, Рочестър, MN 55905. Имейл: [email protected]
Старши автор: Веена Танеха
Катедра по гастроентерология, Медицински колеж Mayo Clinic, Рочестър, MN, САЩ
Катедра по гастроентерология, Медицински колеж Mayo Clinic, Рочестър, MN, САЩ
Катедра по имунология и отделение по ревматология, Медицински колеж Mayo Clinic, Рочестър, MN, САЩ
Кореспонденция: д-р Veena Taneja, отдел по имунология, клиника Mayo, 200 First Street SW, Рочестър, MN 55905. Имейл: [email protected]
Старши автор: Веена Танеха
Обобщение
Здравият чревен микробиом
Фактори на околната среда и микробиома
Секс-пристрастия в микробиома
Диетата сама по себе си не обяснява напълно разликите в състава на чревния микробиом на здрави индивиди и други силно определящи фактори, като пол, също трябва да бъдат взети под внимание. Неотдавнашно проучване проведе многовариатен анализ на ефекта на пола и диетата върху микробиотата на две естествени популации от риби (триколесен прилеп и евразийски костур), за да се определи дали взаимодействието между генотипа и околната среда контролира състава на чревния микробиом. 23 Всеки вид риба консумира смес от ларви на насекоми и зоопланктон. Въпреки това, във всеки вид индивидите се различават по отношение на относителното им използване на тези два вида храни. Това формира континуум, вариращ от само ядене на ларви, до консумиране на смесена диета и само до ядене на зоопланктон. 24 Това проучване показа, че и двата вида риби показват различия в състава на микробиома по отношение на диетата, само когато се взема предвид сексът. 23.
Малко проучвания определят пола като предиктор за чревния микробен състав, но е доказано, че половите хормони и полът влияят върху чревния микробиом, въпреки че точният механизъм не е разбран. 25, 26 Хуманизираните мишки също показват разлики в състава на фекалните микробни органи, базирани на пола. 27 Значението на разликите в микробиома, основани на пола, беше допълнително изяснено в миши модели на автоимунни заболявания, където микробиотите от женски могат да предизвикат автоимунитет при генетично чувствителни мишки. 28, 29
Генетични фактори и микробиома
За да се определи степента, до която генетичните фактори играят роля при контролирането на чревната микробиота, едно проучване сравнява чревния микробен състав на мишки C57BL/6 и безвъзпитаните NMRI (Naval Medical Research Institute) мишки (Таблица 1). 39, 40 Това беше направено с помощта на амплификацията на 16s rRNA гена, последван от анализ на денатурираща градиентна гел електрофореза (DGGE) на фекалната флора. Това проучване установи, че чревните микробиоми на самородни мишки C57BL/6 са по-сходни помежду си, отколкото на невъзпитаните NMRI мишки (индексът на сходство е с 10% по-висок при породените мишки C57BL/6). Този резултат беше силно подкрепен от друго проучване, в което авторите показаха, че чревните микробиоти на осем различни рекомбинантни микробни линии са повлияни по-силно от генетичния фон, отколкото от пола (Таблица 1). 41 HLA гена, кодирани в MHC, също са показали, че влияят върху чревния микробен състав 20, 27, 42, както е обсъдено в раздела за човешки левкоцитен антиген по-долу.
| Нехуманизирани мишки | ||
| IgA нокаут | IgG-медииран отговор на чревни коменсали, показващ активиране на системната имунна система (неефективна компартментализация); увеличен брой сегментирани нишковидни бактерии | 64, 67, 68 |
| TLR ‐ 5 нокаут | Свързано с промени в чревния микробиом Метаболитен синдром; имунен отговор на ваксинация, инактивирана противогрипна ваксина и полиомиелит | 70, 71 |
| MyD88-нокаут | Неефективен отговор на патогени, дисбиоза по отношение на три бактериални семейства (Lactobacillaceae, Rikenellaceae и Porphyromonadaceae) и защита от диабет тип I | 52, 55 |
| NOD2-нокаут | Намалено производство на α‐Дефензини; увеличен брой Bacteroides, Firmicutes и Bacillus и намалена способност за отстраняване Helicobacter hepaticus | 58 |
| RELMB-нокаут | Редки линии от Bacteroidetes, Proteobacteria и Firmicutes са различни в сравнение с контролите | 80 |
| OB-нокаут | Изобилие от Bacteroides в сравнение с контролите | 83 |
| C57/BL6 Inbred срещу NMRI outbred | По-висок индекс на сходство на микробиота при инбредни мишки C57BL/6 в сравнение с безпородни NMRI мишки | 40 |
| MHC ген | Генотипът е по-силна детерминанта на микробиома от секса | 41 |
| Хуманизирани мишки | ||
| α‐Defensin ‐ 5 свръхекспресия | Устойчивост на предизвикателство с Salmonella typhimurium; загуба на сегментирани нишковидни бактерии от червата в сравнение с контролите | 56, 60 |
| HLA-DRB1 * 04 | Доминиране на Клостридий- подобни бактерии с ниско количество Porphyromonadaceae семейство и Bifidobacterium в червата, свързани с профил тип 17 помощник Т; загуба на зависима от възрастта и пола чревна микробиота | 27, 42 |
Гени, свързани със стратификация и компартментализация
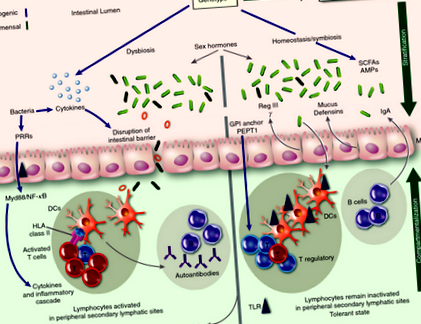
Нараства интересът да се определи и разбере ролята на чревните микроби както за здравето, така и за заболяванията. Взаимодействието между гостоприемника и резидентните чревни микроби е симбиотично при здрави индивиди, като бактериите допринасят за метаболизма на диетата на гостоприемника. В допълнение, бактериите, открити при здрави индивиди (коменсали), играят решаваща роля за поддържането на хомеостазата на чревната имунна система, докато черпят хранителните вещества от диетата на гостоприемника. Един метод, чрез който те поддържат тази хомеостаза, е чрез инхибиране на колонизацията на патогенни бактерии. Само при отклонени обстоятелства самите коменсали стават опортюнистични, което води до възпаление и сепсис. Следователно имунната система на гостоприемника се стреми да ограничи тази опортюнистична инвазия в тъканите на гостоприемника чрез коменсали, чрез процес, наречен стратификация и компартментализация. 17 Стратификацията се отнася до минимизиране на излагането на микроорганизми на чревния епител, а разделянето се отнася до ограничаване на микроорганизмите в чревната стена, което им пречи да взаимодействат със системната имунна система.
Един метод, чрез който чревната имунна система постига стратификация е чрез производството на слуз. Чревната слуз, която е съставена от гликопротеини, се секретира от специализирани клетки (чашевидни клетки), покриващи чревния епител. В дебелото черво слузният слой е дебел (
150 µm) и двуслоен. Въпреки че външният слой има изобилие от микроорганизми, вътрешният слой слуз е изключително устойчив на проникване и предотвратява взаимодействието на микробиотата с лигавицата на епитела. 37 Производството на чревна слуз се регулира от продуктите на чревния микробиом; без микроби мишки имат силно атенюиран слузен слой на дебелото черво въпреки нормалните бокалени клетки и добавянето на бактериален липополизахарид или пептидогликан води до отделяне на чревна слуз от бокаловите клетки. 43 Ролята на слузния слой за предотвратяване на заболявания в червата се илюстрира от факта, че мишките, които нямат основен ген на муцин (MUC ‐ 2) имат увеличена транслокация както на коменсални, така и на патогенни бактерии с повишена пропускливост и бактериална адхезия към епителния слой. 44-46 Като такива, тези MUC-2-дефицитни мишки развиват колит спонтанно. 47
MyD88
Двата слоя слуз, срещани в дебелото черво, обаче не присъстват в тънките черва. 45 Стратификацията в тънките черва се постига чрез производството на антимикробни пептиди (AMP) от клетките на Paneth, които са специализирани клетки в основата на криптите на тънките черва. AMP са от съществено значение за съдържанието на бактериите и минимизирането на контакта им с епителните клетки. Освобождаването на AMP от клетките на Paneth се регулира от интерлевкин (IL) -22, чиято секреция се влияе от чревния микробиом. 49 Това се илюстрира от факта, че изразът на специфичен AMP, наречен Reg III γ е установено, че е намален при мишки без микроби. 50 Рег. III γ е AMP, който предотвратява проникването на тънкочревния слузен слой от микробиотата и по този начин ограничава броя на микроорганизмите, които ще осъществят контакт с епителната повърхност. 51 Докато Рег. III γ предотвратява проникването на бактерии през чревния епител, това не влияе върху състава на чревния микробиом. За разлика, αДефензините (описани по-долу) влияят върху състава на чревния микробиом.
Един от начините за регулиране на производството на Reg III γ е чрез активиране на пътя на миелоидната диференциация на първичен отговор на ген 88 (MyD88) в резултат на взаимодействието на чревния микробиом с клетките на Панет. Избиване на MyD88 ген води до значително намаляване на производството на Reg III γ, което води до неефективен имунен отговор към патогени, 52 включително неуспех в борбата Listeria monocytogenes. 53 Животни, които нямат присъщи за Т-клетките MyD88, показват дисбиоза и тежко чревно заболяване. 54 Микробиомът на MyD88Дефицитни мишки се различава количествено от контролите по отношение на три семейства бактерии (Lactobacillaceae, Rikenellaceae и Porphyromonadaceae; Маса 1). 55
Нуклеотидно свързващ олигомеризационен домейн 2 и α ‐ дефензини
α-Дефензините, за които е доказано, че контролират състава на микробиотата в червата, 56 се освобождават от клетките на панета, отговарящи на микробиота, процес, регулиран от нуклеотидно свързващия олигомеризационен домейн-2 (NOD2) рецептор. 57 NOD2Дефицитните мишки също имат чревен микробиом, който се различава качествено и количествено от контролните мишки. Те не само демонстрират значително увеличен брой Bacteroides, Firmicutes и Bacillus, но също така имат намалена способност за отстраняване Helicobacter hepaticus, който е патогенен вид бактерии (Таблица 1). 58 В допълнение, мутации в NOD2 са сред най-силните рискови фактори за развитието на възпалителни заболявания на червата (Таблица 2). Пациентите с NOD2 мутации показват значителна дисбиоза, повишени актинобактерии и протеобактерии и намаляване на нивата на Clostridium групи IV и XIVa в сравнение с контролите. (Таблица 2). 59
Изследванията върху мишки допълнително изясниха ролята на α- дефензини в здравето и болестите. Неотдавнашно проучване с трансгенни мишки, които свръхекспресират хора α‐Defensin ‐ 5 имат загуба на сегментирани нишковидни бактерии в сравнение с контролните мишки 56 и са устойчиви на Salmonella typhimurium (Маса 1). 60 В допълнение, мишки с дефицит на ензим, необходим за разцепването и активирането на αДефензините имат по-ниско количество бактерии от Bacteroidetes в сравнение с мишки от див тип. 56 Въпреки че точният механизъм, по който α‐Defensin ‐ 5 контролира състава на микробиотата е неизвестен, предложени са различни механизми. Едно от възможните обяснения е това α‐Defensin ‐ 5 действа директно върху луминалните бактерии след дифузия през слузния слой. 17 Алтернативно, α‐Defensin ‐ 5 може да упражнява своята антимикробна активност върху бактериите, разположени във външните слоеве на слуз, които служат като резервоар за бактериите, разположени в лумена на червата. 17
NOD-подобен рецептор от семейство на пирин, съдържащ 6
В допълнение към клетките на панета на тънките черва, епителните клетки на дебелото черво също контролират състава на микробиома. NOD-подобен рецепторен фамилен домен, съдържащ 6 (NLRP6), е вътреклетъчен протеин, експресиран от чревни епителни клетки и може да се свърже с каспаза-1 и по този начин да повлияе на активирането на инфламазомите. 61 Мишки с дефицит на NLRP6 (NLRP6 нокаут) имат промяна в чревния микробиом, което води до увеличаване на Превотела и намаляване на Лактобацилус. Промененият микробиом при мишки с дефицит на NLRP6 увеличава податливостта към колит (Таблица 1). 62 Тази повишена чувствителност към колит, която е резултат от дефицит на NLRP6, се предава на мишки от див тип, което показва, че променен микробиом играе решаваща роля в патогенезата на колита. Въпреки че механизмът, чрез който дефицитът на NLRP6 води до променен микробиом, не е напълно разбран, намалени нива на интерлевкин-18 се наблюдават при мишки с дефицит на NLRP6, което предполага значителна роля на интерлевкин-18 в събития надолу по веригата на NLRP6. 57
Имуноглобулин А при стратификация и компартментализация
Приемащи гени, свързани със специфични състави на чревния микробиом
Идентифицирани са редица гени на гостоприемника, които са свързани със специфични състави на чревната микробиота. Тези гени могат да кодират протеини, участващи в откриването на специфични бактериални продукти, като Toll-like receptor 5 (TLR5), или те могат да бъдат гени, които са свързани с чревни заболявания със специфични промени в чревния микробиом, като например гена Средиземноморска треска. За много от тези гени обаче все още не е ясно как кодираните протеини влияят върху състава на чревния микробиом, като молекулите HLA.
Тол-подобни рецептори
Друг TLR, известен като TLR4, е естествен лиганд за липополизахарид 56, който е важен компонент на мембраните на грам-отрицателни бактерии. Интересното е, че е установено, че активирането на TLR4 определя тежестта на заболяването при животински модели на възпалителен артрит. 72 Установено е също, че е свързано със секрецията на провъзпалителни цитокини от синовиалната тъкан. 73 Въз основа на тези наблюдения се предполага, че стимулацията с TLR4 води до активиране на MyD88-зависими пътища, които контролират възпалителната генна експресия и водят до индукция на противовъзпалителни цитокини на адаптивната имунна система. 74 Подобно на възпалителния артрит, който е свързан с активиране на TLR4, намалена експресия на TLR2 (лиганд за липотейхоева киселина, която може да бъде получена от бактерии) и повишена експресия на TLR9 (която свързва нуклеинови киселини, които могат да бъдат получени от бактерии) наблюдавани при педиатрични пациенти с цьолиакия. 75
Ген на средиземноморска треска
Средиземноморската треска (MEFV) генът кодира протеин, наречен пирин, който може да участва в регулирането на вродения имунитет. 76 Мутациите в този ген водят до автоимунно разстройство, Фамилна средиземноморска треска, което се характеризира с полисерозит и повтарящи се самоограничаващи се епизоди на треска и е свързано с промени в състава на чревния микробиом в сравнение с контролите. 76 Тези промени се характеризират с ниско разнообразие от бактерии, заедно със значителни промени в бактериалните популации в рамките на Bacteroidetes, Firmicutes и Proteobacteria phyla (Таблица 2). 77
Резистиноподобна молекула β
Резистиноподобната молекула β (RELMB) е специфичен за дебелото черво бокалово протеин 78, който се експресира в стомашно-чревния тракт и който може да участва в вродените реакции на чревната микробиота. 79 Препоръчва се също да участвате в регулирането на израза на Рег. III γ. 50 Изследване с използване RELMBДефицитните мишки показват разлика в изобилието на някои редки линии от Bacteroidetes, Proteobacteria и Firmicutes в червата в сравнение с мишки от див тип, когато се хранят с високо съдържание на мазнини (Таблица 1). 80
Затлъстял ген
Лептин, хормон, кодиран от затлъстяването (OB), е от решаващо значение за апетита, енергийните разходи и метаболизма. 81 Лептинът също участва в регулирането на имунните клетки и неговият дефицит е свързан с намалена защита срещу инфекции. 82 Ролята на лептина в контрола на чревния микробиом е показана от нарушаването на OB ген. Мишките с дефицит на лептин не само са с наднормено тегло, но също така показват промени в чревния микробиом, характеризиращи се с изобилие от Бактероиди в сравнение с контролите (Таблица 1). 83
Човешки левкоцитен антиген
MHC кодира алелите на локусите на HLA клас I и клас II, които са най-полиморфните гени при хората. Гените от клас I и клас II са двата основни класа на HLA локусите, които участват в представянето на антигена и изчистването на инфекциите. Полиморфизмът на HLA гените се дължи на селективния натиск на патогените. Следователно, алеите HLA, които генерират отговор срещу повечето патогени чрез активиране на CD4 + Т клетки и продуциране на цитокини, водещи до изчистване на инфекции, са запазени. 84 Някои молекули от клас II обаче са свързани с възпалителни заболявания. Асоциацията на дисбиозата с генетично предразположени заболявания предполага роля на гените гостоприемници при оформянето на чревната микробиота.
Заключения
Благодарности
Изследването е подкрепено с безвъзмездни средства от Министерството на отбраната, W81XWH ‐ 10‐1‐0257 и NIH AR30752.
Разкриване
Всички автори не декларират конкуриращи се интереси.
- Взаимодействие между чревната микробиота на пилето и храносмилането - ScienceDirect
- Влияние на собственото майчино мляко и различни пропорции на адаптирано мляко върху чревната микробиота на
- Масспектрометрия, базирана на метаболомика - Детмер - 2007 - Отзиви за масова спектрометрия - Wiley Online
- Метаболитно въздействие с късен старт на хипогонадизма - Grossmann - 2020 - Andrology - Wiley Online Library
- Високоенергийните диети представляват заплаха за мъжката плодовитост Rato - 2014 - Прегледи за затлъстяване - Онлайн библиотека Wiley