Катедра по медицина Austin Health, University of Melbourne, Melbourne, Vic., Australia
Катедра по ендокринология, Austin Health, Мелбърн, Виктория, Австралия
Катедра по медицина Austin Health, University of Melbourne, Melbourne, Vic., Australia
Катедра по ендокринология, Austin Health, Мелбърн, Виктория, Австралия
Катедра по медицина Austin Health, University of Melbourne, Melbourne, Vic., Australia
Катедра по ендокринология, Austin Health, Мелбърн, Виктория, Австралия
Катедра по медицина Austin Health, University of Melbourne, Melbourne, Vic., Australia
Катедра по ендокринология, Austin Health, Мелбърн, Виктория, Австралия
Катедра по медицина Austin Health, University of Melbourne, Melbourne, Vic., Australia
Катедра по ендокринология, Austin Health, Мелбърн, Виктория, Австралия
Катедра по медицина Austin Health, University of Melbourne, Melbourne, Vic., Australia
Катедра по ендокринология, Austin Health, Мелбърн, Виктория, Австралия
Кореспонденция:
Матис Гросман, Катедра по медицина, Остин Здраве, Университет в Мелбърн, 145 Studley Road, Хайделберг, Вик. 3084, Австралия.
Резюме
Заден план
Затлъстяването и дисгликемията (включващи инсулинова резистентност, метаболитен синдром и диабет тип 2), т.е. затлъстяване, са свързани с намален циркулиращ тестостерон и при някои мъже клинични характеристики, съответстващи на андрогенния дефицит.
Обективен
Да се направи преглед на метаболитното въздействие на късния хипогонадизъм.
Методи
Изчерпателно търсене на литература с акцент върху последните публикации.
Резултати
Затлъстяването е един от най-силно модифицируемите рискови фактори за късно настъпващ хипогонадизъм и съпътстващият диабет води до по-нататъшно потискане на оста на хипоталамус-хипофиза-тестикула. Потискането на оста на хипоталамус-хипофиза-тестикула е функционално и следователно потенциално обратимо и се среща предимно на нивото на хипоталамуса. Въпреки че липсват окончателни механистични данни, доказателствата сочат, че потискането на оста на хипоталамус-хипофиза-тестикули е медиирано от нарушена регулация на провъзпалителните цитокини, водеща до възпаление на хипоталамуса. Дисрегулирането на централната сигнализация за лептин и инсулин също може да допринесе. За разлика от това, последните данни оспорват парадигмата, че излишъкът от естрадиол е основен фактор за потискане на оста на хипоталамус-хипофиза-тестикула. Вместо това относителният дефицит на сигнализация на естрадиол може да допринесе за метаболитна дисрегулация при мъже с диабет. Докато загубата на тегло и оптимизирането на съпътстващите заболявания могат да обърнат функционалното потискане на оста на хипоталамус-хипофиза-тестисите, лечението с тестостерон води до метаболитно благоприятни промени в телесния състав и до подобрения в инсулиновата резистентност.
Дискусия
Връзката между диабетизма и късния хипогонадизъм е двупосочна. Предварителните данни сочат, че при внимателно подбрани мъже мерките за начин на живот и лечението с тестостерон могат да имат адитивни ефекти.
Заключения
Въпреки че неотдавнашните изследвания предоставиха нови прозрения за механистичните и клиничните аспекти на свързания с диабеста хипогонадизъм с късно начало, са необходими повече доказателства от добре проектирани големи проучвания, за да се насочи оптималният клиничен подход към такива мъже.
Въведение
Асоциации на тестостерон с диабетизъм в наблюдателни изследвания
Роля на SHBG
По отношение на затлъстяването е ясно, че докато умереното затлъстяване се свързва предимно с понижен общ тестостерон, успореден на намалената SHBG, по-изразеното затлъстяване (особено ИТМ> 35-40 kg/m 2) също е свързано с намаляване на свободния тестостерон. Това предполага, че по-изразеното затлъстяване е свързано с истински биохимичен хипогонадизъм. В обобщение, докато някои от асоциациите с ниско тестостерон-затлъстяване отразяват понижен SHBG, данните от наблюденията категорично предполагат взаимодействия с андроген-затлъстяване, които са независими от SHBG.
Тестостеронов праг
Предишни наблюдателни и експериментални проучвания при мъже, прегледани другаде (Grossmann, 2018), предполагат, че неблагоприятни метаболитни въздействия, като инсулинова резистентност, се наблюдават предимно при субнормални концентрации на тестостерон (2016). По същия начин в голямо проучване на база данни в Обединеното кралство на 70 541 мъже, в сравнение с референтна група мъже с общ тестостерон ≥ 20 nmol/L, значително повишен риск от T2DM вече е очевиден при мъже с тестостерон между 15 и 19,99 nmol/L, инцидент процентно съотношение = 1,29, 95% CI 1,13; 1.47, стр 2019).
В обобщение, наблюдателните проучвания показват, че ниският тестостерон е свързан и предсказва бъдещи неблагоприятни метаболитни резултати, като инсулинова резистентност, метаболитен синдром, T2DM и затлъстяване. Докато тази асоциация е частично медиирана чрез SHBG, доказателства за независими асоциации със свободен тестостерон и чистия андроген DHT, като се оставят настрана методологичните предупреждения, предполагат независими от SHBG асоциации. Интересното е, че рискът от диабет може да се увеличи при по-високи концентрации на тестостерон, отколкото се оценяваха по-рано.
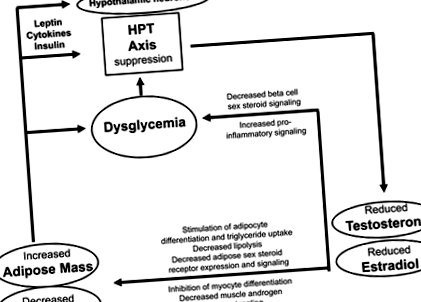
Предишни наблюдателни проучвания, прегледани подробно наскоро (Grossmann, 2018; Gianatti & Grossmann, 2019), съобщават, че затлъстяването (включително метаболитния синдром) е свързано с по-бърз спад на тестостерона, което предполага двупосочна асоциация (вж. По-долу). В съответствие с по-ранна работа, в скорошно проспективно проучване на 141 по-млади (средна възраст 43 години), предимно инсулинорезистентни мъже, инсулиновата резистентност (измерена с помощта на тест за подтискане на панкреаса, базиран на октреотид) прогнозира хипогонадизъм (дефиниран като общ тестостерон 2018). Въпреки това, в по-голямо проспективно проучване сред 1400 шведски мъже (средна възраст 58 години), ниският изходен тестостерон прогнозира инсулинова резистентност (измерена чрез HOMA-IR), но високата инсулинова резистентност на изходно ниво не предсказва нисък тестостерон при проследяване (Ottarsdottir и др., 2018). Въпреки че наблюдателните проучвания, дори ако проспективите не могат да установят причинно-следствената връзка, нито да определят посоката на причинно-следствената връзка, доказателствата като цяло съответстват на двупосочната връзка. От една страна, ниските ендогенни андрогени могат да повишат риска от затлъстяване, а от друга, диабетът може да ускори свързания с възрастта спад на тестостерона. Потенциално ниски ендогенни андрогени и диабетизъм си взаимодействат в самоподдържащ се цикъл (фиг. 1).
Интервенционни и експериментални проучвания (вж. По-долу) предполагат, че някои от ефектите на тестостерона върху мастната маса и метаболизма на глюкозата могат да зависят от ароматизирането на естрадиол. Наблюдателните доказателства, свързващи циркулиращия естрадиол с затлъстяването, обаче са оскъдни и противоречиви, отчасти поради колинеарността на циркулиращия тестостерон (субстрата) с естрадиола (продукта). Освен това естрадиолът е измерван чрез имуноанализ в повечето проучвания, при които липсва точност при количественото определяне на относително ниските концентрации на естрадиол при мъжете (Russell & Grossmann, 2019).
Насоченост на връзката ниско тестостерон-диабетизъм
10% загуба на телесно тегло. Бариатрична хирургия (
30% загуба на телесно тегло) е свързано с по-значително увеличение на общия тестостерон от 8,73 nmol/L (95% CI 6,51; 10,95) (Corona и др., 2013 ). При достатъчна загуба на тегло (≥10% от телесното тегло) също се наблюдава повишаване на гонадотропините и свободния тестостерон, което предполага истинско реактивиране на оста на HPT (Camacho и др., 2013; Корона и др., 2013 ). Като цяло промените в ендогенния тестостерон, постижими с нехирургични мерки за отслабване, са сравнително скромни. В неотдавнашен RCT на лечение с тестостерон плюс диета при мотивирани мъже със затлъстяване, строга структурирана диетична програма, водеща до загуба на тегло от 11 кг в групата на плацебо, увеличи серумния тестостерон само умерено, с 2,9 nmol/L (Ng Tang Fui и др., 2016). Този ефект не се задържа 18 месеца след края на изпитването (Ng Tang Fui и др., 2017a, b, c). В съответствие с реакцията на оста на HPT към промени в телесното тегло, биохимичният хипогонадизъм не е стабилно състояние; в EMAS за средно проследяване от 4,3 години, 43% от мъжете с биохимичен хипогонадотропен хипогонадизъм са възстановили евгонадизъм. Загубата на тегло и ненаднорменото тегло са били най-силните предиктори (Rastrelli и др., 2015).
Обратно, промените в ендогенните концентрации на тестостерон са свързани със сравнително умерени промени в телесното тегло; дори тежкият дефицит на тестостерон, дължащ се на андроген-депривационна терапия (ADT), който намалява тестостерона почти до нула, има само незначителни ефекти върху телесното тегло. В проспективно проучване на по-възрастни мъже с локализиран рак на простатата, които са били евгонадни в началото (общ тестостерон 14 nmol/L), след 12 месеца ADT (намаляване на общия тестостерон до 0,4 nmol/L), ИТМ се е увеличил само с 0,65 kg/m 2 (95% CI 0,14; 1,15) в сравнение със съответстващи контроли за рак на простатата, които не получават ADT (Cheung и др., 2016). ADT обаче е ясно свързан с метаболитно неблагоприятни ефекти върху телесния състав. Мастната маса се увеличава с 3,5 кг [95% ДИ 2,0; 5,0] и чистата маса намалява с 1,5 кг (95% ДИ 0,2; 1,8), свързано с 30% увеличение на инсулиновата резистентност (измерено чрез HOMA-IR) (Cheung и др., 2016). Ефектите от лечението с тестостерон в клинични изпитвания са разгледани по-долу, но са в съответствие с двупосочната връзка между затлъстяването и ниския тестостерон, с по-доминиращи ефекти на първото.
Потенциални механизми на връзката ниско тестостерон-диабетизъм
Диабетност, насърчаваща нисък тестостерон
Докато умереното затлъстяване/инсулинова резистентност се свързва предимно с нисък общ тестостерон поради понижен SHBG, по-изразеното затлъстяване води до истински биохимичен хипогонадизъм, доказан от намаляването и на свободния тестостерон (Grossmann, 2018). Мъже с диабет и/или затлъстяване и нисък тестостерон, както е съобщено за първи път от групата на Dandona (Dhindsa и др., 2018), рядко имат повишени концентрации на гонадотропин. Следователно, свързаното с диабеста намаление на ендогенния тестостерон се счита, че се дължи на потискане на централната гонадна ос. Това може да се случи до голяма степен на нивото на хипоталамуса. Както е прегледано другаде, провъзпалителните адипоцитокини, нарушената инсулинова сигнализация в централната нервна система (ЦНС) и нерегулираното сигнализиране за лептин могат да допринесат за потискане на хипоталамуса, вероятно, поне отчасти, чрез ефекти върху KNDy (kisspeptin/неврокинин В/динорфин) неврони в дъгообразното ядро на хипоталамуса (Dhindsa и др., 2018; Grossmann, 2018; Растрели и др., 2018; Gianatti & Grossmann, 2019).
Нисък тестостерон, насърчаващ затлъстяването
При мъжете не е ясно до каква степен ефектите от лечението с тестостерон върху метаболизма на глюкозата зависят от насърчаването на метаболитно благоприятни промени в телесния състав (т.е. увеличаване на чистата маса и намаляване на мастната маса). Трябва да се отбележи, дали лечението с тестостерон има ефект върху метаболитно активната висцерална мастна тъкан не е сигурно (вж. По-долу). Малки проучвания съобщават, че тестостеронът може да регулира инсулиновата чувствителност директно и остро, преди да се настъпят промени в телесния състав (Yialamas и др., 2007). Освен това, краткосрочни проучвания на хиперинсулинемично-евгликемична скоба при здрави възрастни мъже с фармакологично променени ендогенни концентрации на полови стероиди съобщават за промени в чувствителността към инсулин при липса на промени в ИТМ (Lapauw и др., 2010; Гиб и др., 2016). Тези проучвания също изследват диференцираните ефекти на тестостерона спрямо естрадиола върху инсулиновата чувствителност (допълнително обсъдено по-долу). Други потенциални механизми са промени в енергийните разходи или повишена мотивация за ангажиране с физическа активност (Ng Tang Fui и др., 2016), но не съществуват категорични доказателства.
Роля на естрадиола
Метаболитно въздействие на лечението с тестостерон в клинични проучвания
RCT при мъже с T2DM и/или метаболитния синдром, публикувани преди 2016 г., са подробно прегледани другаде (Dhindsa и др., 2018; Grossmann, 2018; Растрели и др., 2018; Gianatti & Grossmann, 2019). Като цяло откритията показват, че лечението с тестостерон последователно и умерено увеличава чистата маса (с около 2 кг), намалява мастната маса (с около 2 кг) и умерено подобрява инсулиновата резистентност в повечето, но не във всички проучвания. За разлика от това, лечението с тестостерон няма последователни ефекти върху висцералната маса на мастната тъкан и върху гликемичния контрол, измерено чрез HbA1c. Мета-анализ, ограничен до контролирани от плацебо двойно-слепи RCT (н = 7) заключи, че лечението с тестостерон умерено подобрява инсулиновата резистентност, в сравнение с плацебо, обобщена средна разлика (MD) -1,58 (95% CI -2,25; -0,91, стр 2015). Проучванията обаче са относително малки (общо н = 833 мъже) и краткосрочни (≤ 12 месеца). Критериите за включване бяха хетерогенни и участниците обикновено имаха добре контролиран диабет в началото. Освен това, като се има предвид еритропоетичните действия на тестостерона, HbA1c може да не отразява точно околната гликемия. Последващ по-голям метаанализ от Corona и др. (2016) включва 59 проучвания на обща стойност почти 5100 възрастни мъже (средна възраст 62 години), които съобщават за ефектите на тестостерона върху телесния състав и глюкометаболичните резултати. Включени са опити, независимо от изходните концентрации на тестостерон или наличието на метаболитно заболяване. Неконтролирани проучвания без плацебо група също са допустими. Докато лечението с тестостерон не намалява телесното тегло, обиколката на талията или ИТМ, мастната маса намалява (стандартизирани средства -0,34, 95% CI -0,48; -0,20, стр 2016).
Съобщени са няколко скорошно контролирани плацебо двойно-слепи RCT, отчитащи глюкометаболични резултати. При един малък 12-месечен RCT от 55 затлъстели мъже с T2DM на перорални антидиабетни медиации, дългодействащият мускулно ундеканоат намалява HOMA-IR с 4,64 и HbA1c с 0,94% спрямо плацебо, без значителни разлики между ИТМ или талията обиколка (Groti и др., 2018). При вторичен анализ на подгрупа от 134 недиабетни мъже, включени в проучването Тестостеронови ефекти върху атеросклерозата при възрастни мъже (TEAM), със средна изходна възраст 66 години, ИТМ 28 kg/m 2 и общ тестостерон 11,4 nmol/L, 3 години локален тестостеронов гел (постигане на среден серумен тестостерон 16,6 nmol/L в групата на тестостерон) не е оказал ефект върху телесното тегло или върху инсулиновата чувствителност, оценено чрез тестване за супресия на инсулин октреотид (Huang и др., 2019). В голямото проучване с тестостерон, което включва 788 мъже на възраст над 65 години (в началото 72% са били със затлъстяване и 37% са имали диабет) със серумен тестостерон от 2018 г.).
| Телесно тегло | Без промяна a Наблюдава се намаление при нерандомизирани, неслепи проучвания. |
| Мастна маса | Намаляване |
| Постна маса | Нараства |
| Чернодробна мазнина | Няма промяна |
| Висцерална мазнина | Намаляване или липса на промяна |
| Инсулинова резистентност (HOMA-IR) | Намаляване или липса на промяна |
| Инсулинова резистентност (хипергликемично-еугликемични скоби) | Намаляване или липса на промяна |
| HbA1c | Без промяна a Съобщава се за намаляване при нерандомизирани, неслепи проучвания. |
| Общ холестерол | Намаляване |
| LDL холестерол | Намаляване |
| HDL холестерол | Намаляване |
| Триглицериди | Намаляване или липса на промяна |
- a Съобщава се за намаляване при нерандомизирани, неслепи проучвания.
Заключения
ПРИЗНАВАНИЯ
MNTF получи подкрепа за стипендия за изследователски институт ESA-RACP и MG от сътрудник за кариерно развитие (1024139) от NHMRC.
Разкриване
MG е получил финансиране за научни изследвания от Bayer, Novartis, Weight Watchers, Lilly и хонорари на лектори от Besins Health Care. MNTF получи финансиране за научни изследвания от Bayer Pharma. ASC получи почетни лектори от Astra Zeneca и Merck Sharp & Dohme (Австралия).
- Антонио L, Wu FC, O'Neill TW, Pye SR, Carter EL, Finn JD, и др. (2015) Асоциации между половите стероиди и развитието на метаболитен синдром: надлъжно проучване при европейски мъже . J Clin Endocrinol Metab 100, 1396 - 1404 .
Брой пъти цитирани според CrossRef: 12
- Omer Faruk Kirlangic, Didem Yilmaz-Oral, Ecem Kaya-Sezginer, Gamze Toktanis, Aybuke Suveyda Tezgelen, Ekrem Sen, Armagan Khanam, Cetin Volkan Oztekin, Serap Gur, The Effects of Androgens on Cardiometabolic Syndrome: Current Terapeutical Concepts. /j.esxm.2020.02.006, (2020).
Напредналата хронична бъбречна болест е силен предсказател на хипогонадизма и е свързана с намалена маса на постно тъкан
- Високоенергийните диети представляват заплаха за мъжката плодовитост Rato - 2014 - Прегледи за затлъстяване - Онлайн библиотека Wiley
- Ползи за здравето от диетичните фибри - Андерсън - 2009 - Прегледи на храненето - Онлайн библиотека Wiley
- Влияние на затлъстяването върху метаболитния контрол на резултатите от диабета тип 2 в турската национална общност
- Масспектрометрия, базирана на метаболомика - Детмер - 2007 - Отзиви за масова спектрометрия - Wiley Online
- Диетата с високо съдържание на мазнини променя серумните цитокини преди появата на затлъстяване - Песен - 2020 - The FASEB Journal