Субекти
Резюме
Основен лиганд на Schiff (SBL), N 2, N 3-бис (антрацен-9-илметилен) пиридин-2, 3-диамин се синтезира чрез кондензация на 2,6-диаминопиридин и антрацен-9-карбалдехид с използване на 1: Съотношение 2. 1H NMR спектрите потвърждават наблюдението на неангажиращ ароматен карбоксилен протон в SBL. Нова серия базирани на лантанид (т.е. празеодим (Pr), ербий (Er) и итербий (Yb)) базирани на SBL метални комплекси беше успешно синтезирана и техните функционални групи бяха подробно демонстрирани с помощта на UV-видима, инфрачервена трансформация на Фурие (FT -IR) и анализи на флуоресцентна спектроскопия. FT-IR спектрални проучвания разкриват, че SBL се държи като бидентатен лиганд и е структуриран с метални йони от двата азометинови азота. Синтезираните метални комплекси, базирани на SBL, са извършени сложно за цитотоксичност спрямо Vero, рак на гърдата при хора (MCF7) и цервикални (HeLa) противоракови клетъчни линии.
Въведение
След иновативния успех на цисплатина като медицинско признато противотуморно лекарство, медицинските химици започнаха интердисциплинарни изследвания върху метални комплекси за взаимодействие с ДНК/РНК, биомолекули и протеини като противотуморни лекарства 1,2. От друга страна, употребата на платина (Pt) на метална основа цисплатиново лекарство за медицински цели причинява множество странични ефекти, което остава предизвикателство за преодоляване, за да се приготвят ефективни противоракови лекарства 3,4,5. Медицинската неорганична химия предлага широка възможност за проектиране на нови лекарства, базирани на координацията и редокс свойствата на металните комплекси за борба с рака 6,7. Понастоящем различни метални комплекси, включително комплекси от мед, лантан и рутений, се считат за най-способните заместители на класическите лекарства от типа цисплатин 7,8,9,10,11,12,13,14,15,16,17 .
В настоящото разследване бидентатен SBL и неговите нови комплекси от лантанидни метали (III) (празеодим, ербий и итербий) бяха успешно синтезирани чрез прост химически синтез в едно гърне и правдоподобно характеризирани с аналитични техники, включително UV-видими (UV-vis), Инфрачервена трансформация на Фурие (FT-IR) и флуоресцентна спектроскопия. В допълнение, техните цитотоксични ефекти върху клетъчните линии на рака Vero, HeLa и MCF7 инвитро бяха демонстрирани в детайли.
Резултати и дискусия
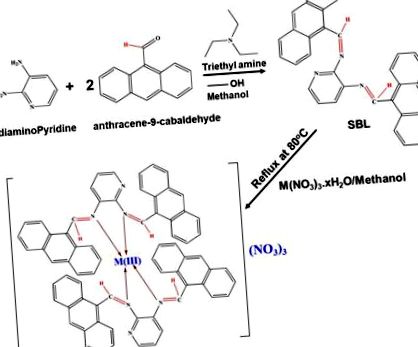
SBL, N2, N3-бис (антрацен-9-илметилен) пиридин-2,3-диамин се синтезира чрез кондензация на 2,6-диаминопиридин и антрацен-9-карбалдехид, използвайки съотношение 1: 2. Схематичното представяне на SBL синтеза е дадено на фиг. 1. Фигура S1 (a) показва 1Н NMR спектър на SBL комплекса, който показва специфичен сигнал при 12,23 ppm поради NH протони и сигнала в диапазона 8,0– 8,7 ppm се приписват на азометинови протони. Сигнал се наблюдава и в областта 6.63–8.29 ppm поради ароматни протони 40,41. От 13 С ЯМР спектър (Фигура S1b), SBL показва специфичен сигнал при 165,37 ppm поради азометинов въглерод 42,43. Той също така показва сигнал в диапазона от 126-132 ppm, който съответства на ароматните въглероди 44,45. Наблюдаваните NMR резултати потвърждават успешното формиране на SBL комплекса. Освен това, нова серия базирани на лантанид (т.е. празеодим (Pr), ербий (Er) и итербий (Yb)), базирани на метални комплекси SBL, беше успешно синтезирана чрез прост химически синтез в едно гърне. Подробните експериментални процедури, използвани за приготвяне на базирани на SBL метални комплекси, са разработени в експерименталната част. Схемата за подготовка на Schiff base ligand – Pr (SBLPr), Schiff base ligand – Er (SBLEr) и Schiff base ligand – Yb (SBLYb) е показана на фиг. 1.
Схематична методология на SBL и неговата метална комплексна подготовка.
Анализ на функционалните свойства на SBL и неговите метални комплекси
UV-vis спектри на SBL и неговите метални комплекси в диапазона 250–800 nm.
FT-IR спектри на SBL и неговите метални комплекси. (а) Азометинова група (ν-HC = N) регион, (б) -M-N-регион и (° С) Пиридинов пръстен N-регион.
Флуоресцентни спектри на SBL метални комплекси (Вмъкване: флуоресцентен спектър на SBL). Деконволютивните спектри, включени за метални комплекси SBLEr и SBLPr, се дължат на комбинирания им широк спектрален пик.
(а) TG и (б) DTA криви на SBL и неговите метални комплекси.
SEM микроснимки на (а) SBL и (б) SBLPr, (° С) SBLEr и (д) Комплекси SBLYb.
Поведение на цитотоксичност срещу ракови клетъчни линии Vero, MCF7 и HeLa, използващи метални комплекси SBLPr и SBLEr
Металните комплекси на базата на SBL (SBLPr и SBLEr) трябва да бъдат полезни като противоракови лекарства поради тяхната стабилност, цитосъвместимост и гъвкаво свързване с биомолекули 64. В последно време напредъкът на системите за доставка на лекарства е широко опитен да доведе до очаквания лечебен ефект при пациенти с ниски противоположни реакции 65. В тази работа антипролиферативните действия на SBLPr и SBLEr бяха изследвани в три различни ракови клетъчни линии (т.е. клетки Vero, HeLa и MCF7) и оценени чрез MTT анализ.
Наблюдения на ефекта на синтезираните SBLPr и SBLEr при различни концентрации (т.е. 5, 10, 25, 50, 75 и 100 μg/ml комплекси) върху клетъчната жизнеспособност на клетките Vero, MCF7 и HeLa бяха направени на 24 часа. Наблюдаваните резултати обясняват жизнеспособността на клетките при 85–90% за концентрациите до 5 μg/ml, както е показано на фиг. 7 (а, б). Както е показано на фиг. 7, SBLPr и SBLEr ефективно индуцират апоптоза в клетки Vero, MCF7 и HeLa в зависимост от дозата. Тестваните от SBLPr клетки Vero показват добра биосъвместимост в сравнение с комплекса на SBLEr, както е показано на фиг. 7. Ефективните намаления в жизнеспособността на клетките са отбелязани в третираните концентрации в сравнение с контролните клетки. По-ранен доклад разкрива, че клетъчните линии Vero при по-високи концентрации на метални комплекси излагат значителна клетъчна смърт 66,67. Освен това характеристиките за биосъвместимост на златните наночастици (AuNP) в крайна сметка бяха извършени спрямо линиите Vero, HeLa, MCF7 и HeP-G2cell 68. Веро клетките, третирани в продължение на 24 часа със съответната IC50 концентрация на SBLPr и SBLEr, се закръгляват и започват да се свиват и да губят взаимодействието си с близките клетки. Морфологичните изображения, показани на фиг. 8 (a-c), потвърждават токсичния ефект на проби SBLPr и SBLEr (@ 25 μg/ml) срещу клетките Vero в сравнение с контролните клетки.
Клетъчна жизнеспособност на ракови клетъчни линии (т.е. MCF7, HeLa и Vero) срещу а) SBLPr и б) Метални комплекси SBLEr.
Морфологични промени, индуцирани от SBLPr и SBLEr метални комплекси, използващи 25 μg/ml в сравнение с контролни клетъчни линии на рак.
Съответно 42–51%. Клетките, третирани със SBLPr и SBLEr, са подложени на клетъчно свиване, което е видно от фиг. 8. Освен това, нашите синтезирани метални комплекси показаха по-добри инхибиращи свойства срещу MCF7 ракови клетъчни линии. В допълнение, те показаха, че апоптотичните тела водят до клетъчна смърт, както се доказва от вариации като ограничаване на клетъчния растеж, цитоплазмена кондензация и загуба на мембранната цялост 70 .
Анализи на фрагментация на ДНК и апоптоза срещу MCF7 и HeLa ракови клетъчни линии с използване на метални комплекси SBLPr и SBLEr
Фрагментацията на ДНК широко се приема като отличителна черта на апоптозата 68,71. Инициирането на апоптоза може да се установи чрез неправилен дефицит в размера на клетките, при който клетките се кондензират, и фрагментация на ДНК 72. Наблюдението на олигонуклеозомални отломки от хромозомното разцепване на ДНК в е основна част от апоптозата. Усъвършенстваната биохимична работа призна фактора на фрагментация на ДНК, водещи апоптотични ендонуклеази при разрушаването на ДНК инвитро. Налични са множество доклади за способността на металните комплекси да катализират разцепването на ДНК 70. Следователно ние изследвахме дейности по разцепване на ДНК чрез анализ на електрофореза, използвайки клетки SBFPr и SBLEr, изследвани с комплекс MCF7 и HeLa. В настоящото проучване HeLa и MCF7 IC50 клетки се третират със SBLPr и SBLEr в продължение на 24 часа, показвайки намаляване на клетъчната преживяемост чрез включване на ДНК фрагментация. Фигура 9 (a, b) показва индуцирането на апоптоза в междинните цитонамазки. Изображенията с електрофореза в пълна дължина са представени на допълнителна фигура S2. За сравнение са осигурени необработени контролни камери за изследване на наблюдението на липса на фрагментация на ДНК.
(а) ДНК фрагментация на MCF7 и HeLa IC50 клетки, третирани със SBLPr комплекс на 24 h. Линия 1: 1 kb ДНК стълба, Линия 2: MCF7 контролна ДНК, Линия 3: Третирана със SBLPr клетка MCF7 (25 μg/ml), Линия 4: Третирана със SBLPr HeLa клетка (25 μg/ml), Линия 5: Контрол HeLa ДНК. (б) ДНК фрагментация на MCF7 и HeLa IC50 клетки, третирани със SBLEr комплекс на 24 h. Път 1: 1 kb ДНК стълба, Път 2: MCF7 контролна ДНК, Път 3: третирана с SBLEr MCF7 клетка (25 μg/ml), Път 4: HeLa контролна ДНК, Път 5: SBLEr-третирана HeLa клетка (25 μg/ml ).
Морфологични вариации на AO/EB двойно оцветени MCF7 и HeLa клетки и техните третирани с SBLPr- и SBLEr клетки, използващи 25 μg/ml за 24 часа.
- Магнитни катализатори, чувствителни към железен фталоцианин, за фоторазграждане на BPA Научни доклади
- Размерът на храненето е критичен фактор за увеличаване на теглото в научните доклади в ранна детска възраст
- IJMS Безплатни пълнотекстови чемеринови изоформи и активност при HTML за затлъстяване
- Филмите на ужасите манипулират експертно мозъчната дейност, за да засилят вълнението - ScienceDaily
- In vitro и in vivo доказателства за засищащ ефект на рибен протеин хидролизат, получен от синьо