Резюме
Въведение
Затлъстяването затруднява зачеването на жените, независимо дали чрез естествени или асистирани методи. Известно е, че затлъстяването влияе върху оста хипоталамус-хипофиза-яйчници, качеството на яйцеклетките и общата плодовитост [1,2,3]. С разпространението на затлъстяването, оценено на над 50% в развитите страни, е важно да се разбере патофизиологията и възможните пътища за намеса [3].
Лутеинизиращият хормон (LH) се произвежда от хипофизните гонадотропи и е от съществено значение за овулацията. Клетъчните механизми включват тека клетките в яйчника, при което продуктите на тези клетки позволяват на гранулозните клетки да произвеждат естрогени. Естрогените осигуряват отрицателна обратна връзка за секрецията на LH от хипофизата през средната фоликуларна фаза. В крайна сметка натрупването на естроген е толкова голямо, че LH скок следва и предизвиква овулация [4]. При овулаторна жена със затлъстяване, както LH, така и FSH постоянно се доказват, че намаляват със съответното намаляване на производството на естроген и прогестерон от яйчниците след овулация. Този относителен хипогонадотропен хипогонадизъм представлява потенциална етиология за общо намален плодовитост при овулаторни затлъстели жени [5].
Инхибиторите на ароматазата (AI) са използвани за разрешаване на хормонален дисбаланс при жени без СПКЯ. Ароматазата е микрозомен цитохром Р450 хемопротеин, за който е известно, че извършва ключовите стъпки за превръщане на андростендион в естрон и тестостерон в естрадиол. [6, 7] Той се открива в много различни видове тъкани, включително мозъчна, гръдна, плацентарна, яйчникова, тестикуларна, ендометриална, кожна, костна и мастна тъкани [7]. Показано е, че инхибиторите на ароматазния ензим спомагат за регулирането на нивата на LH и амплитудата на пулса. [6, 8, 9] Изследване на Bayar et al. показа, че приложението на AI осигурява 81% степен на овулация при ановулаторни участници и общо 9% честота на бременност. [10] По-рано показахме, че чрез прекъсване на първоначалната отрицателна обратна връзка на естрогена върху LH в ранната фоликуларна фаза, нивата на LH се повишават по време на менструалния цикъл [9]. Чрез увеличаване на LH по време на този етап, човек увеличава шанса да има нормални нива на хормоните надолу по веригата. Възможно е, тъй като FSH следва същия модел на секреция като LH и също се секретира от хипофизата, тези нива също могат да се повишат [7].
Целта на настоящия доклад е да разгледа способността на летрозол, инхибитор на ароматазата, да нормализира различните хормонални профили на жените със затлъстяване и нормално тегло (NW). Летрозол има сравнително кратък полуживот, е обратим инхибитор и може да се приема под формата на хапчета [7, 8]. В предишен пилотен доклад ние прилагахме летрозол с 4 часа често вземане на кръвни проби на пет жени с нормално тегло. Стимулирането на GnRH, като част от протокола, не е докладвано преди това [9]. Предполагаме, че даването на летрозол на овулиращите жени със затлъстяване ще измести техния хипогонадотропен фенотип, за да благоприятства повишените нива на LH и FSH чрез прекъсване на отрицателната обратна връзка на естрогена.
Материали и методи
За това проучване, жени на възраст 18–40 с нормален ИТМ 18–25 kg/m 2 (NW; н = 10) и жени с ИТМ над 30 kg/m 2 (затлъстели; н = 12) са били наети и лекувани с летрозол в ранната фоликуларна фаза. Всички бяха изследвани за PCOS, определено от наличието на олигоменорея, както е посочено от NIH. Всички участници са имали редовни менструални цикли в рамките на 25–35 дни. Други критерии за включване включват възраст 18–40 при записване, редовни менструални цикли от 25–35 дни, липса на хронично заболяване, което пречи на репродуктивните хормони, нормален TSH и пролактин и липса на употреба на лекарства, които биха могли да взаимодействат или да нарушат репродуктивните хормони. Жените, които са участвали в прекомерни упражнения (повече от 4 часа на седмица), са изключени.
Протоколът
Започвайки от 2–5-ия ден на цикъла, летрозол се дава общо 7 дни на базата на телесната повърхност. Следователно шест от затлъстелите жени са получавали 5 mg, докато останалите са получавали 2,5 mg. След 7 дни лечение, участниците са подлагани на често вземане на кръвни проби на всеки 10 минути в продължение на 6 часа с болус GnRH (75 ng/kg), даван на 4 часа преди края на проучвателното посещение. Всички, с изключение на един участник в това проучване, са вземали ежедневни проби от урина по време на този менструален цикъл, които са били измервани за нива на FSH, LH, PDG и E1c [6].
Исторически контрол
Във всички проучвания е използван DELFA имунофлуорометричен анализ (Perkin-Elmer) за измерване на LH и FSH. Междуопитни и вътрепробни CV: 4.8% и 5.4%, за LH и 6.3% и 4.2% за FSH. Ежедневните проби от урина бяха изследвани за E1c и Pdg. Концентрациите на хормона бяха коригирани за глицерол и нормализирани до креатинин [12]. Нивата на E1c и Pdg са измерени чрез ELISA и нормализирани до 28-дневен цикъл. CV-те в рамките на анализа и между тестовете са съответно 2,2% и 6,8% за E1c; и 2,3% и 4,5%, съответно за Pdg.
Анализ на данни
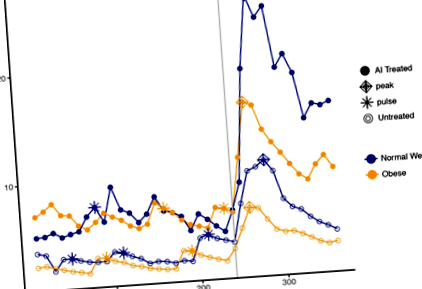
LH пулсативността се характеризира, като се използват първите 4 часа данни от всеки период на изследване. Честотата и амплитудата на LH импулса са изчислени за всеки индивид, като се използва модифициран метод за откриване на импулси на Santen-Bardin, който е бил предварително валидиран [13]. Изчислени са средно ниво на серума, пиково ниво, площ под кривата и максимален отговор след прилагането на GnRH, както LH, така и FSH; представителни профили на LH хормони, илюстриращи тези параметри, от нормално тегло и пациенти със затлъстяване, в контролните и лекувани с AI рамена на изследването са изобразени на фиг. 1. Тези мерки са изчислени, като се използва само времето на болуса и 2 часа след това, за да има еквивалентност в двете проучвания. Пиковото ниво е определено като максимална хормонална концентрация след прилагане на болуса GnRH, а максималният отговор е дефиниран като аритметична разлика между надира преди GnRH и пика след GnRH, където надирът е средното ниво на хормона в часа предшестващо приложението на GnRH. Резултатите бяха преобразувани в log (base-e), за да се обърне внимание на потенциалните изкривявания.
Хормонални криви от субекти, представители на лекувани с AI (твърди точки) спрямо нелекувани (отворени точки) и нормално тегло (синьо) спрямо затлъстяване (оранжево). Приложен е болус на GnRH след 240 минути, както е показано от вертикалната сива линия. Импулсите са представени със звездички; върховете са представени от диаманти
Линейните регресии оценяват дали ИТМ повлиява ефекта от лечението с ИИ върху резултатите. Линейните контрасти бяха използвани за изчисляване на двойни разлики между ИТМ и групите на лечение. Резултатите, които бяха преобразувани в дневника, бяха върнати в естествения си мащаб и представени като геометрични средства, с промяна в гънките (или процента) между групите. Резултатите се считат за значими при ниво на значимост 0,05.
Резултати
Лекуваните с ИИ и нелекувани жени със затлъстяване са имали сходна средна възраст и ИТМ (стр > 0,55; Маса 1). Лекуваните с AI и нелекувани жени в СЗ също имат подобна средна възраст и ИТМ (стр > 0,69; Маса 1). В рамките на лекуваната група, затлъстелите жени и NW имат сходна средна възраст (стр > 0,30; Маса 1).
Разлики в LH и FSH при лечение на AI при затлъстяване
Преди GnRH стимулация, затлъстелите жени, лекувани с AI, са имали по-високи средни нива на LH (4.73 IU/L, 95% CI 3.47, 6.45) в сравнение с жени със затлъстяване, които не са лекувани с AI (2.65 IU/L, 95% CI 1.94, 3.61 ) (стр = 0,011; Фиг. 2; Маса 1). Тези разлики се запазват след стимулация с GnRH (стр = 0,018). Жените, лекувани със затлъстяване с AI и нелекувани, показват сходна честота на LH пулс (2,33 импулса/4 часа, 95% ДИ 1,61, 3,05 срещу 2,00 импулса/4 часа, 95% ДИ 1,28, 2,72, съответно; стр = 0,51). Въпреки това жените със затлъстяване, лекувани с AI, са имали средно по-големи импулси (2,56 IU/L, 95% CI 1,66, 3,97) в сравнение с жени със затлъстяване, които не са лекувани с AI (1,01 IU/L, 95% CI 0,65, 1,56).
Стимулиране след GnRH, лекуваните с AI жени със затлъстяване са имали по-висок среден пик на LH от 13,40 IU/L (95% CI 9,09, 19,74) в сравнение със 7,11 IU/L (95% CI 4,83, 10,48) при нелекуваните с AI затлъстела група (стр = 0,025; Фиг. 2). AUC на LH също е почти двойна за лекуваните с AI жени със затлъстяване в сравнение с нелекуваните жени със затлъстяване (1146 IU/L, 95% CI 756, 1735 срещу 578 IU/L, 95% CI 382, 876, съответно, стр = 0,024).
С изключение на средния FSH след стимулация с GnRH, параметрите на FSH не се различават при затлъстяване при лечение с AI (стр > 0,10). Средните нива на FSH след стимулация с GnRH са по-високи при лекувани с AI затлъстяване в сравнение с нелекувани жени със затлъстяване (6,49 IU/L, 95% CI 5,06, 8,32 срещу 4,59 IU/L, 95% CI 3,62, 5,83, стр = 0,049).
Разлики в LH и FSH при лечение с AI при нормално тегло
Няма статистически разлики в параметрите на LH между лекуваните със СИ AI и жени, които не са лекувани с AI (стр > 0,112) (Таблица 1; Фиг. 2). Наблюдават се няколко интересни модела. Лекуваните с AI NW са имали по-високи средни нива на LH (6,9 IU/L, 95% CI 4,0, 9,6) в сравнение с жени, които не са лекувани с AI с нормално тегло (4,76 IU/L, 95% CI 3,39, 6,69), въпреки статистическата значимост не беше достигнато (стр = 0,11). Този модел съответства на стимулацията след GH (Таблица 1). При стимулация с GnRH средният среден пик на LH е 1,5 пъти по-висок при жени, лекувани с AI в СЗ в сравнение с нелекувани жени в СЗ (20,50 IU/L, 95% CI 13,68, 30,74 срещу 13,45 IU/L, 95% CI 8,80, 20,57; стр = 0,16). Преди GnRH стимулация, средният размер на LH импулс също не се различава между лекуваните с AI и нетретираните групи в NW (2.42 IU/L, 95% CI 1.56, 3.75 срещу 2.05 IU/L, 95% CI 1.30, 3.25; стр = 0,60).
Няма статистически разлики в параметрите на FSH между лекуваните с ИИ и нелекуваните групи при жени с нормално тегло (стр > 0,082).
Сравняване на разликите между групите
В нелекуваните групи, нивата и амплитудата преди GnRH, LH са значително по-ниски при жени със затлъстяване в сравнение с NW (стр = 0,014 и стр = 0,029, съответно). След GnRH, средно ниво на LH, пик и AUC също са значително по-ниски при жени със затлъстяване (стр = 0,033, стр = 0,031, стр = 0,038, съответно) За разлика от това, не са наблюдавани разлики между нормалното тегло и затлъстелите жени в групата, лекувана с AI (стр > 0,091); това е вярно както за LH, така и за FSH параметри (Таблица 1). Въпреки това, затлъстелите жени, лекувани с AI, са имали много сходни параметри на LH с нелекуваните жени в СЗ, на изходно и след GnRH стимулиране (Фиг. 2; Таблица 1).
Дискусия
В това проучване изследвахме LH и FSH при нормални и затлъстели жени, със и без приложение на AI и летрозол и преди и след стимулация на GnRH. Средният LH е по-висок както при жени със затлъстяване, така и при жени с нормално тегло, лекувани с летрозол, и всички групи са имали увеличение на средния LH след стимулация от GnRH. При жените от СЗ обаче общите ефекти на AI не са статистически значими по отношение на параметрите на LH или FSH. При затлъстели жени средните нива на LH и амплитудата на пулса са значително по-високи в отговор на лечението с AI. По същия начин, стимулираните с GnRH нива на LH и FSH са значително по-високи в групата, лекувана с AI. По този начин изглежда, че затлъстелите жени селективно реагират на лечението с ИИ по отношение на нивата на гонадотропин.
FSH следва подобен модел на LH (стойностите са по-високи при прилагане на AI), но процентната разлика е по-малка и не е статистически значима. Макар и да не са статистически значими, възможно е промените в FSH да са клинично значими. В биологично отношение летрозолът блокира биосинтеза на естроген, като по този начин намалява отрицателната обратна връзка на естрогена по оста хипоталамус/хипофиза. Друга работа показва, че това позволява по-голяма секреция на FSH от хипофизата, което спомага за фоликуларния растеж и развитие [14]. По този начин остава възможно дори малките промени в FSH да увеличат резултатите от плодовитостта при затлъстелите жени; обаче, надлъжно проучване с честота на бременност и резултати би отговорило по-добре на това.
Известно е, че затлъстяването променя гонадотропините [5], но установихме, че в отговор на летрозол базовият хормонален профил на овулиращите жени със затлъстяване и отговорът им към GnRH се увеличават, като ги възстановяват до нива, сравними с тези, наблюдавани при нелекувани жени от СЗ. В действителност, при стимулация с GnRH, средната стойност на LH при жени с наднормено тегло, лекувани с AI, надвишава средната стойност на LH при жени, които не са лекувани с AI с нормално тегло (Фиг. 2; Таблица 1). По този начин лечението с ИИ спасява хипогонадотропния фенотип на затлъстяването.
Затлъстяването може да промени експресията на LH на нивото на хипофизата, както е показано от Kucherov et al. [9] В нашето проучване открихме значително увеличение на амплитудата на LH импулс в кохортата със затлъстяване след приложение на AI (Фиг. 2; Таблица 1). Нашите резултати допълнително подкрепят хипофизата като място на действие на инхибирането на ароматазата, тъй като амплитудата, а не честотата, се увеличава след приложението на летрозол.
Силните страни на това проучване включват използване на нормалното тегло и контролните групи със затлъстяване, приспособяване на дозата летрозол към телесната повърхност и гледане директно върху хипофизата, за да се идентифицира като място за контрол на LH. Слабостите включват сравнително малък размер на извадката и период на наблюдение и използването на отделни по време контролни и интервенционни групи, изключващи двойни сравнения на отделни участници. Ние признаваме, че се извеждат потенциални ефекти върху плодовитостта, тъй като проучването не е изследвало резултатите от бременността.
Тъй като разпространението на затлъстяването продължава да расте в развитите и развиващите се страни, за лекарите ще бъде важно да обучават пациентите си как ИТМ влияе върху плодовитостта и резултатите от бременността. Доказано е, че умереното намаляване на теглото повишава овулаторния и репродуктивния успех [15]. Бъдещите проучвания могат да се съсредоточат върху дизайн, който включва прилагане на AI, заедно с наблюдаваната загуба на тегло, за да се наблюдава ефектът от комбинацията от терапии за плодовитост. Това проучване показва потенциала на летрозол да увеличи шанса за спонтанна бременност при жени със затлъстяване чрез нормализиране на техните LH профили.
Препратки
Bazzano MV, Torelli C, Pustovrh MC, Paz DA, Elia EM. Затлъстяването, предизвикано от диета в кафенето, нарушава плодовитостта при плъховете, като засяга множество яйчникови цели. Reprod BioMed Online. 2015; 31 (5): 655–67.
Polotsky AJ, Hailpern SM, Skurnick JH, Lo JC, Sternfeld B, Santoro N. Асоциация на юношеското затлъстяване и доживотна нулипарност - изследването на здравето на жените през цялата нация (SWAN). Fertil Steril. 2010; 93 (6): 2004–11.
Talmor A, Dunphy B. Женско затлъстяване и безплодие. Best Pract Res Clin Obstet Gynaecol. 2015; 29 (4): 498–506.
Choi J, Smitz J. Лутеинизиращ хормон и човешки хорион гонадотропин: произход на разликата. Ендокринол на Mol Cell. 2014; 383 (1–2): 203–13.
Jain A, Polotsky AJ, Rochester D, et al. Амплитудата на пулсиращия лутеинизиращ хормон и отделянето на прогестеронов метаболит са намалени при жени със затлъстяване. J Clin Endocrinol Metab. 2007; 92 (7): 2468–73.
Ross LA, Polotsky AJ, Kucherov A, Bradford AP, Lesh J, Chosich J, et al. Дълбоко намаляване на яйчниковия естроген чрез инхибиране на ароматазата при жени със затлъстяване. Затлъстяване (Сребърна пролет). 2014; 22 (6): 1464–9.
738 ACON, Гинеколози ACoOa. Ароматазни инхибитори в гинекологичната практика. Акушер гинекол. 2018; 131: e194–9.
Klement AH, Casper RF. Използването на инхибитори на ароматазата за индукция на овулацията. Curr Opin Obstet Gynecol. 2015; 27 (3): 206–9.
Kucherov A, Polotsky AJ, Menke M, Isaac B, McAvey B, Buyuk E, et al. Инхибирането на ароматазата причинява повишена амплитуда, но не и честота на хипоталамо-хипофизната продукция при нормални жени. Fertil Steril. 2011; 95 (6): 2063–6.
Bayar U, Basaran M, Kiran S, Coskun A, Gezer S. Използване на инхибитор на ароматазата при пациенти със синдром на поликистозните яйчници: проспективно рандомизирано проучване. Fertil Steril. 2006; 86 (5): 1447–51.
Al-Safi ZA, Liu H, Carlson NE, et al. Грундирането с естрадиол подобрява чувствителността към гонадотропи и провъзпалителните цитокини при жени със затлъстяване. J Clin Endocrinol Metab. 2015; 100 (11): 4372–81.
Santoro N, Crawford SL, Allsworth JE, Gold EB, Greendale GA, Korenman S, et al. Оценка на менструалния цикъл с анализи на пикочни хормони. Am J Physiol Endocrinol Metab. 2003; 284 (3): E521–30.
Santen RJ, Bardin CW. Епизодична секреция на лутеинизиращ хормон при анализ на пулса на човека, клинична интерпретация, физиологични механизми. J Clin Invest. 1973; 52 (10): 2617-28.
Misso ML, Wong JL, Teede HJ, et al. Ароматазни инхибитори за СПКЯ: систематичен преглед и мета-анализ. Актуализация на Hum Reprod. 2012; 18 (3): 301–12.
Нелсън SM, Fleming RF. Предконцептуалната парадигма на контрацепцията: затлъстяване и безплодие. Hum Reprod. 2007; 22 (4): 912–5.
- Оценка на горещи вълни и вагинална сухота при жени със затлъстяване, подложени на бариатрична хирургия
- Акантоза нигриканци и метаболитни рискови фактори при затлъстели деца SpringerLink
- Тревожност и депресивно настроение при затлъстели бременни жени Проспективно контролирано кохортно проучване - FullText
- Блокадата на NLRP3 инфламазома подобрява метаболитното здраве и продължителността на живота при затлъстели мишки SpringerLink
- Мозъчната активност, реакцията на хранителните сигнали се различават при жените със силно затлъстяване, показва проучване - ScienceDaily