Мин Джун Лий
1 Програма за артрит и дегенерация на тъкани, Дейвид З. Розенсвайг Център за геномни изследвания, Болница за специална хирургия, Ню Йорк, Ню Йорк 10021 САЩ
Елисей Лим
1 Програма за артрит и дегенерация на тъкани, Дейвид З. Розенсвайг Център за геномни изследвания, Болница за специална хирургия, Ню Йорк, Ню Йорк 10021 САЩ
Sehwan Mun
1 Програма за артрит и дегенерация на тъкани, Дейвид З. Розенсвайг Център за геномни изследвания, Болница за специална хирургия, Ню Йорк, Ню Йорк 10021 САЩ
Seyeon Bae
1 Програма за артрит и дегенерация на тъкани, Дейвид З. Розенсвайг Център за геномни изследвания, Болница за специална хирургия, Ню Йорк, Ню Йорк 10021 САЩ
Коичи Мурата
1 Програма за артрит и дегенерация на тъкани, Дейвид З. Розенсвайг Център за геномни изследвания, Болница за специална хирургия, Ню Йорк, Ню Йорк 10021 САЩ
Лионел Б. Ивашкив
1 Програма за артрит и дегенерация на тъкани, Дейвид З. Розенсвайг Център за геномни изследвания, Болница за специална хирургия, Ню Йорк, Ню Йорк 10021 САЩ
2 магистърска програма по имунология и микробна патогенеза, Weill Cornell Graduate School of Medical Sciences, New York, NY 10021 USA
3 Катедра по медицина, Медицински колеж Weill Cornell, Ню Йорк, Ню Йорк 10021 САЩ
4 д-р. Парк-Мин и Ивашкив допринесоха еднакво за тази работа
Kyung-Hyun Park-Min
1 Програма за артрит и дегенерация на тъкани, Дейвид З. Розенсвайг Център за геномни изследвания, Болница за специална хирургия, Ню Йорк, Ню Йорк 10021 САЩ
3 Катедра по медицина, Медицински колеж Weill Cornell, Ню Йорк, Ню Йорк 10021 САЩ
4 д-р. Парк-Мин и Ивашкив допринесоха еднакво за тази работа
Свързани данни
Резюме
Въведение
Интравенозният имуноглобулин (IVIG) съдържа обединени имуноглобулини от плазма на хиляди здрави донори, а IVIG терапията е ефективна при различни автоимунни и хронични възпалителни заболявания (Kazatchkine and Kaveri, 2001; Schwab and Nimmerjahn, 2013). IVIG доставя своите сигнали чрез различни рецептори, включително Fc гама рецептори (FcγR), които се свързват с Fc частта на имуноглобулин G и CD209 (известен също като DC-SIGN, дендритна клетъчно-специфична междуклетъчна адхезионна молекула-3-Грабване Неинтегрин) (Anthony et al., 2011). Механизмите на противовъзпалителната функция на IVIG са сложни и са описани редица възможни механизми (Kazatchkine and Kaveri, 2001; Schwab and Nimmerjahn, 2013). Точните механизми за имуномодулиращи и противовъзпалителни ефекти на IVIG терапията обаче не са напълно изяснени.
Активирането на Fcγ рецептори няма пряк ефект върху костната деструкция при антиген-индуцирани модели на артрит (MacLellan et al., 2011; van Lent et al., 2006), но FcγRIV, един от активиращите Fcγ рецептори, играе положителна роля в имунния комплекс -посредствено разрушаване на костите в модела на артрит, индуциран от K/BXN (Ochi et al., 2007; Seeling et al., 2013). FcγR-дефицитни мишки имат нормален костен фенотип (Seeling et al., 2013), демонстрирайки, че Fcγ рецепторите минимално модулират костната хомеостаза във физиологични условия. Важно е, че хората и мишките имат различен репертоар от Fcγ рецептори и FcγRIV не се експресира в човешките клетки. Следователно, рецепторите, отговорни за действието на IVIG в човешките клетки, остават неуловими.
МАТЕРИАЛИ И МЕТОДИ
Мишки и анализ на костния фенотип
Шестседмични женски C57BL/6 са закупени от лабораторията Джаксън (Bar Harbor, ME). Всички експерименти с животни са одобрени от болницата за специална хирургия IACUC. Всички животни бяха разпределени на случаен принцип в експериментални групи. За експериментите с възпалителна остеолиза използвахме утвърден модел на мишка, индуциран от TNF модел на супралкалварна остеолиза (Kitaura et al., 2005) с незначителни модификации. Накратко, TNF се прилага ежедневно в дозите, посочени в легендите на фигурите, на калвариалния надкостник на мишки в продължение на четири до пет последователни дни. След това мишките бяха жертвани за събиране на калвариални кости за секциониране. За хистопатологична оценка, мишките бяха евтаназирани, а калвариалните кости бяха събрани и фиксирани в 4% параформалдехид за 2 дни. След това тези проби бяха декалцифицирани с 10% неутрален буфериран EDTA (Sigma-Aldrich) и вградени в парафин. За да се оцени остеокластогенезата и костната резорбция, срезовете бяха оцветени с TRAP (тартрат-резистентна киселинна фосфатаза) и хематоксилин за визуализация на остеокластите, а хистоморфометричният анализ беше извършен със системата за анализ на изображения BioQuant (Nashville, TN, USA), използвайки стандартни процедури (Parfitt et al. ., 1987). Остеокластите бяха идентифицирани като TRAP + клетки, които бяха многоядрени и съседни на костите.
Реактиви
Човешки M-CSF и sRANKL са закупени от Peprotech (Rocky Hill, NJ). Клинично използваният IVIG препарат Carimune NF ® е закупен от Cardinal Health (Dublin, OH). Антителата, използвани за имуноблотинг, са както следва: NFATc1 (BD Pharmagen); p38 (биотехнология на Санта Круз); Ламин В (Abcam); p65, p100/p52, p100/p50 и I-kBα (клетъчна сигнализация).
Клетъчна култура
Диференциация на остеокластите
Човешките CD14 + клетки се инкубират с 20 ng/ml M-CSF за един ден, за да генерират OCPs. За анализи на човешка остеокластогенеза клетките се добавят към 96 ямкови плаки в три екземпляра при плътност на посяване 5 × 104 клетки на гнездо. Предшествениците на остеокластите се инкубират с 20 ng/ml M-CSF и 40 ng/ml разтворим в човека RANKL за допълнителни 5 дни в α-MEM, допълнен с 10% FBS. Цитокините се попълваха на всеки 3 дни. На 6-ия ден клетките бяха фиксирани и оцветени за TRAP с помощта на диагностичния комплект Acid Phosphatase Leukocyte (Sigma), както се препоръчва от производителя. Многоядрени (повече от 3 ядра) TRAP-положителни остеокласти бяха преброени в три повторни ямки.
Анализ на генната експресия
За PCR в реално време бе получена ДНК РНК с помощта на RNeasy Mini Kit от QIAGEN с обработка с DNase и 1 ug от общата РНК бяха транскрибирани обратно, използвайки комплект за синтезиране на cDNA от първа верига (Fermentas, Hanover, MD). PCR в реално време се извършва в три екземпляра, използвайки iCycler iQ термичен циклер и система за откриване (Applied Biosystems, Carlsbad, CA), следвайки протоколите на производителя. Експресията на тествания ген се нормализира спрямо нивата на GAPDH. Грундовете, използвани в това проучване, са както следва: hA20 5’-CCGGCTGCGTGTATTTTGGGACTC-3 ’, 5’-GGAACCTGGACGCTGTGGGACTGA-3; hNFATc1 5’- ’CTTCTTCCAGTATTCCACCTAT-3’, 5’-TTGCCCTAATTACCTGTTGAAG-3 ’; hITGB3 5’-GGAAGAACGCGCCAGAGCAAAATG-3 ’5’-CCCCAAATCCCTCCCCACAAATAC-3’; hCTSK 5’-CTCTTCCATTTCTTCCACGAT-3 ’, 5’-ACA CCA ACT CCC TTC CAA AG-3’; hBCL6 5’-CCTCGCCAGCCACAAGACCG-3 ’, 5’-CTGGCTCCGCAGGTTTCGCA-3’; hIRF8 5’-TGCGCTCCAAACTCATTCTCGTG-3 ’, 5’-GTCTGGCGGCGGCTCCTC-3’; hMAFB 5’-CTCAGCACTCCGTGTAGCTC-3 ’, 5’-GTAGTTGCTCGCCATCCAGT-3’; hFcγRIIa 5’-CATCACTGTCCAAGTGCCCA-3 ’, 5’-CCACAATGATCCCCATTGGT-3’; hGADPH 5’-ATCAAGAAGGTGGTGAAGCA-3 ’, 5’-GTCGCTGTTGAAGTCAGAGG-3’
РНК интерференция
0,2 nmol от три къси интерфериращи РНК (siRNAs), специално насочени към човешки FcγRIIa (L-014152-00-0005, Dharmacon), човешки A20 (TNFAIP3: M-009919-99-0005, Dharmacon) или нецелеви контролни siRNA ( Dharmacon) са трансфектирани в първични човешки CD14 + моноцити с устройството Amaxa Nucleofector, настроено да програмира Y-001 с помощта на комплекта за човешки моноцитен нуклеофектор (Amaxa), както е описано по-рано (Park-Min et al., 2007).
Поточна цитометрия
Оцветяването за експресия на клетъчна повърхност на различни протеини се извършва с използване на антитела срещу човешки CD64, CD32 и CD16 (BD Parmingen). Използван е потоков цитометър FACSCalibur със софтуер CELLQuest (Becton Dickinson).
Статистически анализ
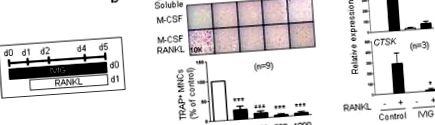
Всички статистически анализи бяха извършени със софтуера Graphpad Prism 5.0, използвайки двустранен, сдвоен t-тест (две условия) или еднопосочен ANOVA с t-тест на Tukey за множество сравнения (повече от две условия). p Фиг. 1а и б). Съответно, IVIG инхибира специфичните за остеокласта генни експресии като CTSK (кодира катепсин К) и ITGB3 (кодира интегрин β3), когато е добавен преди стимулация на RANKL (фиг. 1в). Най-високата доза IVIG, която използвахме (1 mg/ml), има отношение към терапевтичната доза за пациенти (20 mg/kg телесно тегло) и напълно инхибира in vitro остеокластогенезата. IVIG не съдържа ендотоксини и ние допълнително потвърдихме, че този потискащ ефект не е резултат от замърсяване с LPS (допълнителна фигура 1). Нашите резултати показват, че IVIG директно потиска остеокластната диференциация на остеокластните предшественици.
- Интравенозен имуноглобулин (IVIg) Странични ефекти, време за работа
- Първоначалните интравенозни дози имуноглобулин трябва да се основават на коригирано телесно тегло при пациенти със затлъстяване
- Как яденето на сини сливи е от полза за косата, костите и здравето на храносмилателната система
- Прекъсващ костен бульон на гладно за начинаещи бульон по дизайн
- Имуноглобулин интравенозни странични ефекти Чести, тежки, дългосрочни