Сяохуа Лю
1 Катедра по психиатрия, Шанхайски център за психично здраве, Шанхайско училище по медицина Jiao Tong, Шанхай, ПР Китай
Джон Р. Келсо
2 Катедра по психиатрия, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния, САЩ
3 Здравна система за ветераните в Сан Диего, Сан Диего, Калифорния
4 Институт за геномна медицина, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния
Тифани А. Гринууд
2 Катедра по психиатрия, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния, САЩ
Свързани данни
Резюме
Заден план
Биполярното разстройство е хетерогенно разстройство на настроението, свързано с няколко важни клинични съпътстващи заболявания, като хранителни разстройства. Тази клинична хетерогенност усложнява идентифицирането на генетични варианти, допринасящи за биполярната податливост. Тук ние изследваме коморбидността на хранителните разстройства като подфенотип на биполярно разстройство, за да идентифицираме генетични вариации, които са общи и уникални и за двете заболявания.
Методи
Проведохме анализ на асоцииране в целия геном, който контрастира 184 биполярни субекти с коморбидност с хранителни разстройства срещу 1370 контроли и 2 006 субекти с биполярно разстройство само от изследването на биполярния геном (BiGS).
Резултати
Най-значимата констатация за целия геном е наблюдавана биполярно с коморбидно разстройство на храненето спрямо контролите в рамките на SOX2-OT (p = 8,9 × 10 −8 за rs4854912) с вторичен пик в съседния ген FXR1 (p = 1,2 × 10 −6 за rs1805576) на хромозома 3q26.33. Този регион беше и най-забележителната находка в анализа само за случая (p = 3,5 × 10 −7 и 4,3 × 10 −6, съответно). Бяха идентифицирани и няколко региона на интерес, съдържащи гени, участващи в процесите на невроразвитие и неврозащита.
Ограничения
Докато нашата първична констатация не достигна съвсем значимо за целия геном, вероятно поради относително ограничен размер на извадката, тези резултати могат да се разглеждат като копие на скорошно проучване на хранителни разстройства в голяма кохорта.
Заключения
Тези открития възпроизвеждат предишната асоциация на SOX2-OT с хранителни разстройства и до голяма степен подкрепят участието на невроразвитие/невропротективни механизми в патофизиологията на двете разстройства. Освен това те предполагат, че различните клинични прояви на биполярно разстройство могат да отразяват диференцирания генетичен принос и да се аргументират за полезността на клиничните субфенотипове при идентифицирането на допълнителни молекулярни пътища, водещи до заболяване.
ВЪВЕДЕНИЕ
Биполярното разстройство е тежко разстройство на настроението с оценена наследственост от 60–93% (Kieseppa et al., 2004; Lichtenstein et al., 2009; McGuffin et al., 2003; Taylor et al., 2002). Проучвания на големи геномни асоциации (GWA) на големи проби наскоро идентифицираха няколко силни кандидати за гени за чувствителност, включително ADCY2, ANK3, CACNA1C, NCAN, ODZ4 и TRANK1 (Cichon et al., 2011; Ferreira et al., 2008; Green и др., 2013; Chen et al., 2013; Muhleisen et al., 2014; Psychiatric GWAS Consortium Bipolar Disorder Working Group, 2011), въпреки че пътищата, по които генетичните варианти влияят на риска са сложни и остават до голяма степен неизвестни. Биполярното разстройство също се проявява със сложни, силно променливи клинични прояви, включително няколко важни съпътстващи заболявания, които представляват широк спектър от подтипове на разстройства (MacQueen et al., 2005). Тази фенотипна хетерогенност възпрепятства изясняването на генетичните варианти, допринасящи за чувствителността, тъй като дадена проба от биполярни пациенти вероятно се състои от множество различни подтипове, всеки с уникална генетична архитектура (Alda, 2004; Alda et al., 2009). Използването на субфенотипове, получени от клинични фактори, за които е известно, че са свързани с разстройството, може да установи по-хомогенни подгрупи от пациенти с различни основни генетични рискови фактори (Saunders et al., 2008). Докато няколко потенциално важни подфенотипа на биполярно разстройство са идентифицирани като част от характерната симптоматика или коморбидност (MacQueen et al., 2005; Saunders et al., 2008), малко GWA анализи са използвали клинични субфенотипи за биполярно разстройство (Greenwood и Kelsoe, 2013; Swaminathan et al., 2015; Winham et al., 2014).
Натрупването на доказателства предполага силна връзка между етиологията на биполярното разстройство и тази на хранителните разстройства. Пациентите с биполярно разстройство имат повишен процент на хранителни разстройства (McElroy et al., 2013; McElroy et al., 2006; McElroy et al., 2005), като коморбидността с хранителни разстройства се наблюдава по-често сред жените, отколкото при биполярните пациенти от мъжки пол (Kawa et al., 2005; McElroy et al., 2011), в съответствие с наблюденията в общата популация (Hudson et al., 2007). Докато честотата на поведението с преяждане варира от 13% до 38% при биполярно разстройство (Kruger et al., 1996; Ramacciotti et al., 2005), съпътстващата патология на хранителните разстройства изглежда не се ограничава до поведенческите характеристики на аберативното хранене (т.е. преяждане, прочистване, ограничаване на диетата) и може да представлява маркер за повишено натоварване на симптомите и натоварване на болестта (Wildes et al., 2007). И накрая, епидемиологичните проучвания показват връзка между хранителните разстройства и подпраговите биполярни симптоми, включително афективни темпераменти, както и между поведението на хипоманията и преяждането и двете нарушения показват значително припокриване по отношение на феноменологията, курса, коморбидността, фамилната анамнеза и фармакологичните отговор на лечението (Lunde et al., 2009; McElroy et al., 2005).
Тази силна връзка между биполярно разстройство и хранителни разстройства може да предполага частично припокриваща се патогенеза (McElroy et al., 2005) или може да означава, че съпътстващата патология на хранителното разстройство формира специфичен подфенотип на биполярно разстройство с уникална генетична архитектура. Тук имахме за цел да открием генетичните варианти, свързани с повишен риск от хранителни разстройства при лица с биполярно разстройство чрез анализ на GWA.
МЕТОДИ
Субекти
Пациентите за това проучване са получени от изследването на биполярния геном (BiGS). За генотипиране като част от BiGS, биполярни I субекти на европейското предшествие са избрани от тези, събрани от Националния институт по психично здраве (NIMH) Генетична инициатива за биполярно разстройство в пет вълни на 11 места в Съединените щати, както е описано подробно на друго място (Dick et al., 2003; Smith et al., 2009). Всички субекти бяха оценени с помощта на Диагностично интервю за генетични изследвания (DIGS), което беше комбинирано със данни от семейни информатори и медицински досиета, за да се стигне до най-добрата оценка на диагнозите според критериите DSM-III-R или DSM-IV (Nurnberger et al., 1994). Субектите за контрол бяха избрани измежду тези, установени чрез механизма на договора, поддържан от NIMH, между д-р Пабло Гейман и Knowledge Networks, Inc. (Sanders et al., 2010). Избраните контроли бяха съпоставени по пол и етническа принадлежност (т.е. европейски предци) с биполярните пациенти и всички контролни субекти, които са потвърдили анамнеза за биполярно разстройство, психоза или голяма депресия в медицинския въпросник, бяха изключени от това проучване.
Генотипиране и почистване
Първоначалната проба е генотипирана в Broad Institute като част от като част от Информационната мрежа за генетична асоциация (GAIN), използвайки масива Affymetrix 6.0 (1 M SNP). Общо 1001 биполярни случая, 1033 контрола и 724 067 SNPs бяха на разположение за анализ след обширен процес за контрол на качеството (QC) за елиминиране на субекти с ≥5% липсващи данни и SNPs с ≥5% липсващи данни, малки алелни честоти (MAF) -6 (Smith et al., 2009). Втора проба от 1198 биполярни случая и 403 контроли е генотипирана по подобен начин в Института за транслационна геномика (TGEN) и е подложена на сравним QC процес, който води до 728 187 SNP, достъпни за анализ (Smith et al., 2011). Допълнителен кръг от QC, извършен върху обединените проби GAIN и TGEN, доведе до 703 012 преминаващи SNP. Идентичността по държава (IBS) е използвана за идентифициране и премахване на лица с криптична връзка. Генетичната хомогенност на пробата беше осигурена чрез многомерно мащабиране (MDS). Съобщава се, че всички индивиди са от европейски произход и не са открити изключения за популацията. Крайната биполярна кохорта (N = 2190) е 58,7% жена със средна възраст 42,6 ± 12,7, а контролната кохорта (N = 1370) е 46,4% жена със средна възраст 52,2 ± 17,1.
Фенотипове
Скалата на детските събития в живота (CLES) се прилага по време на интервюто за част от кохортата, за да документира различни травматични събития, които могат да се случат на възраст между 3–12 години, използвайки 12-бална скала за 9 събития. Оценихме този инструмент като кумулативен общ резултат и допълнително оценихме субекти, преживяващи ≥2 събития, по установени методи (Anand et al., 2015). Също така оценихме отделно травмата в три категории: 1) смърт на родител или брат или сестра, неочаквано напускане на дома и други сериозни промени в живота; 2) начало на хронично заболяване, продължителна хоспитализация (≥1 месец) и трайно нараняване или увреждане; и 3) физическо насилие и насилствени животозастрашаващи преживявания. Отбелязваме, че някои отговори за втората категория са объркани от появата на симптоми на настроение в тази кохорта. Средният общ резултат на CLES при 1396 биполярни пациенти с валидни данни, включително 131 пациенти с коморбидност с хранително разстройство, е 1,4 ± 1,6 (диапазон 0–10).
Статистически анализи
Първоначален анализ, сравняващ пациенти с коморбидни хранителни разстройства (BD + ED, N = 184) и здравите контроли (CTL, N = 1370), беше извършен, за да се идентифицират генетични фактори, които са уникални за този подтип. В допълващ анализ само за случаи, коморбидната група е сравнена с некоморбидната биполярна група (BDO, N = 2006), за да се идентифицират генетични фактори, които могат да модифицират изразяването на хранителни разстройства в контекста на биполярно разстройство. Тези резултати бяха сравнени с тези от анализ, сравняващ некоморбидната група с контролите, за да се оцени специфичността на получените асоциации за коморбидност с хранителни разстройства. Специфичните женски секс анализи за 3q36.33 региона включват 158 BD + ED, 1127 BDO и 636 CTL субекти. Всички анализи на асоцииране са извършени с помощта на логистична регресия в PLINK (Purcell et al., 2007). Тъй като факторите за геномна инфлация за анализите варират от 1,00 до 1,016, не се счете за необходима корекция за стратификация на населението. Бяха извършени пермутации за превключване на етикети, за да се оцени емпиричното значение и стабилност на резултатите.
РЕЗУЛТАТИ
Всички биполярни пациенти първо бяха оценени за различни клинични характеристики, свързани с поведението на преяждане и прочистване и модели на диета, упражнения и загуба на тегло. Сред общо 2190 биполярни пациенти 272 (12,4%) умишлено са отслабнали много, а 320 (14,6%) са имали чести преяждания два пъти седмично в продължение на поне три месеца. Само 184 (8,4%) обаче отговарят на пълните диагностични критерии за хранително разстройство, което включва 66 (3%) с нервна анорексия, 109 (5%) с нервна булимия и 9 (0,4%) с хранително разстройство, което не е посочено друго. Сред тези с коморбидни хранителни разстройства 15,8% са ограничавали анорексията от тип, 20,1% са били с преяждане/прочистване на анорексия, 39,7% са били с прочистваща булимия и 19,6% са били с непрочистваща се булимия. Тъй като данните показват, че анорексията и булимията невроза споделят генетични рискови фактори и съществуват на континуум на отговорност (Kaye, 2008), ние комбинирахме тези диагнози и техните подтипове за оценка на коморбидността на хранителното разстройство при биполярно разстройство.
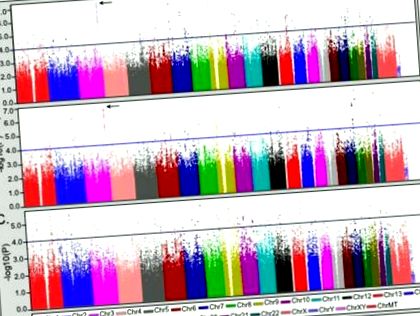
Резултатите от клиничните сравнения предполагат, че коморбидността на хранителното разстройство може да формира специфичен подфенотип на биполярно разстройство. За да се разграничат генетичните фактори, които са уникални за подтипа на коморбидното хранително разстройство, от тези, които модифицират експресията на хранителни разстройства в рамките на биполярно разстройство, коморбидната група (BD + ED) е сравнена със здравите контроли (CTL) и само с биполярните група (BDO), съответно. След това тези резултати бяха сравнени с анализа на BDO спрямо CTL, за да се оцени специфичността за съпътстващата болест на хранителното разстройство. Резултатите от анализите за целия геном са показани на фигура 1. Геномните региони от интерес бяха дефинирани като тези с най-малко два SNPs с p -4 с допълнителна подкрепа за асоцииране (т.е. p -3), осигурена от околните SNP в рамките на 100kb. Изчерпателен списък на регионите, отговарящи на тези критерии, е даден в допълнителна таблица S1 със сравнение на статистическите данни от всички анализи.
Резултати от анализа на геномната асоциация на биполярно с коморбидно разстройство на храненето (BD + ED) спрямо здрави контроли (CTL) и некомморбидна биполярна само група (BDO). (A) Анализ на BD + ED (N = 184) спрямо CTL (N = 1370). (B) Анализ само на BD + ED срещу BDO (N = 2006). (C) Анализът на BDO спрямо CTL е предоставен за сравнение. Във всеки панел синя линия показва p −4, а стрелка показва областта 3q26.33.
Подробности за областта 3q26 от LocusZoom (Pruim et al., 2010), показваща хромозомния контекст, неравновесна структура на връзката и модели на рекомбинация около пика SNP, rs4854912, който е показан като лилав диамант. Всички местоположения се основават на сглобката hg 18 и моделите на неравновесие на връзките в целия регион са показани според референтната популация на CEPH от издание 22 на HapMap с червено, показващо пълно неравновесие (D ′ = 1). Показаните резултати от асоциацията съответстват на BD + ED спрямо CTL анализ (виж Фигура 1А), с пикова стойност p от 8,9 × 10 -8, наблюдавана за rs4854912. Показани са и близките гени SOX2-OT и FXR1. Анализът BD + ED срещу BDO дава много подобен регионален асоциационен парцел и е посочен и пиковият SNP от този анализ, rs10386738.
Няколко други геномни области от интерес също бяха открити при тези анализи (вж. Таблица S1 и фигура S1). Асоциацията с NALCN на хромозома 13q33.1 се наблюдава най-видно при сравнението BD + ED спрямо CTL (пик p = 6,0 × 10 −6, OR = 1,7 за rs9554752) и регионът на значимост се разширява в съседния NALCN-AS1 ген, който кодира антисмислената РНК на NALCN, с р стойности -4. Други гени от интерес, които са най-видни в анализа на BD + ED спрямо CTL, включват NRF1 на 7q32.2, NRG3 на 10q23.1 и ADNP на 20q13.13. Генът ABCG1 върху хромозома 21q22.3 е най-забележим в анализа на BD + ED спрямо BDO (пик p = 4.3 × 10 −7). Гените, представляващи интерес за анализите на BD + ED спрямо BDO и срещу CTL, включват CADM3 на хромозома 1q23.2, ATP2B4 на 1q32.1 и RYR2 на 1q43.
ДИСКУСИЯ
Биполярното разстройство показва значителна клинична фенотипна хетерогенност, което може да отразява различията в основната генетична архитектура. Използването на клинични характеристики за прецизиране на диагнозата и намаляване на фенотипната хетерогенност може да осигури допълнителна сила за откриване на варианти на генетичен риск (Manchia et al., 2013). Въз основа на предварителни доказателства, предполагащи частично припокриваща се патогенеза, ние изследвахме биполярно разстройство с коморбидност с хранително разстройство чрез анализи на GWA към идентифициране на варианти, допринасящи или уникално за този субфенотип, или за риск както за биполярни, така и за хранителни разстройства (McElroy et al., 2005).
SOX2-OT кодира за SRY-кутията, съдържаща ген 2 (SOX2), припокриващ се транскрипт и е идентифициран като снадена, дълга не-протеинова кодираща РНК (lncRNA) с интрон, припокриващ гена SOX2 в същата транскрипционна ориентация. SOX2-OT може да регулира експресията на SOX2, чийто продукт играе ключова роля както в ембрионалната, така и в неврогенезата на възрастни (Amaral et al., 2009). SOX2-OT изглежда също представлява биомаркер за ранните и късните етапи на невродегенерация (Arisi et al., 2011), а изоформа на SOX2-OT, транскрибирана от дистален, силно консервиран елемент, намиращ се в района на върха на нашата асоциация, е експресирано изключително в мозъка с обогатяване в области на неврогенеза за възрастни (Amaral et al., 2009). FXR1 е автозомен хомолог на свързания с умственото забавяне протеин 1 (FMR1) на Fragile X, който е отговорен за синдрома на Fragile-X при хора (Ashley et al., 1993; Siomi et al., 1993; Siomi et al., 1995 ). По време на ембрионалното развитие експресията на FXR1 е ограничена до ранните етапи на пролиферация и диференциация в регионите на централната нервна система, което предполага, че FXR1 може да играе важна роля в пролиферацията на нервните клетки и ранното развитие на мозъка (Coy et al., 1995).
Анализът само за случая, чиято цел е да идентифицира гени, модифициращи експресията на коморбидност на хранително разстройство при биполярно разстройство, е замесен ABCG1 върху хромозома 21q22. Този регион преди е бил замесен в проучвания за генетична връзка на биполярно разстройство (Aita et al., 1999; Kaneva et al., 2004; Straub et al., 1994), а ABCG1 е предложен като позиционен и функционален кандидат ген за биполярно разстройство (Kirov et al., 2001) . ABCG1 кодира ATP-свързващата касета от подсемейство G член 1, транспортен протеин, участващ в клетъчното усвояване на триптофан, предшественик на серотонина, който участва в патофизиологията на настроението разстройства. Серотонинът също е ключов регулатор на хранителното поведение и генетичните варианти, допринасящи за риска от въздействие на серотонинергичната дисфункция при хранителни разстройства (Kaye, 2008; Lucki, 1998).
Областите, представляващи интерес в настоящото проучване, не включват гени, идентифицирани от предишни проучвания на GWA за биполярно разстройство, като ADCY2, ANK3, CACNA1C, NCAN, ODZ4 и TRANK1 (Cichon et al., 2011; Ferreira et al., 2008; Green et al., 2013; Chen et al., 2013; Muhleisen et al., 2014; Психиатрична работна група за биполярно разстройство на консорциума GWAS, 2011). Тези региони също не включват гени, за които се съобщава, че са свързани с анорексия, като CTNNA2, CNTNAP2, EPHX2, GABRG1, HTR1D, OPRD1 и PPP3CA (Bloss et al., 2011; Boraska et al., 2014; Scott -Van Zeeland et al., 2014; Wang et al., 2011). Това, в комбинация с идентифицирането на гени в анализите на BD + ED, които не са били значими при анализа на BDO спрямо CTL, предполага, че биполярното разстройство с коморбидност с хранително разстройство може да представлява уникален клиничен фенотип, който се различава както от биполярно разстройство, така и от хранене разстройства. Нашите анализи също изглежда широко подкрепят гените за участие, свързани с невроразвитието и невропротективните механизми в патофизиологията на биполярно разстройство и модификацията на експресията на този клиничен подтип (Harwood, 2003; Rowe и Chuang, 2004; Sanches et al., 2008; Soeiro -de-Souza et al., 2012).
В обобщение потвърдихме връзката на наскоро идентифициран кандидат ген за нервна анорексия при биполярни пациенти с коморбидност с хранителни разстройства. Също така идентифицирахме няколко геномни области от интерес, съдържащи гени, участващи в процесите на невроразвитие и неврозащита, които могат да бъдат от значение за специфичната патофизиология на съпътстващото заболяване на хранителното разстройство при биполярно разстройство или може да представляват част от споделената патофизиология, лежаща в основата както на биполярно разстройство, така и на хранителни разстройства. Въпреки че тези констатации изискват потвърждение в по-големи набори от данни, те подкрепят концепцията, че различните клинични прояви на биполярно разстройство могат да отразяват различията в основната генетична архитектура.
АКЦЕНТИ
Беше оценена общата връзка на генома с хранителни разстройства в рамките на биполярно разстройство.
Тези резултати възпроизвеждат предишната връзка на SOX2-OT с хранителни разстройства.
- 10 признака, че може да имате хранително разстройство
- 10 фини знака Някой, когото обичате, може да има САМО разстройство на храненето
- Анорексия, булимия, факти за разстройство при преяждане - Thriveworks
- Студентка с анорексия постави смъртоносното хранително разстройство зад себе си, за да бъде коронована за шампион по бикини -
- 5 фини признака на хранително разстройство, което повечето родители не успяват да забележат