Бронвен Мартин
лаборатория по невронауки, Национален институт за стареене Интрамурална програма за изследвания, 5600 Nathan Shock Drive, Балтимор, MD 21224, САЩ
Марк П. Матсън
лаборатория по невронауки, Национален институт за стареене Интрамурална програма за изследвания, 5600 Nathan Shock Drive, Балтимор, MD 21224, САЩ
b Катедра по неврология, Медицински факултет на Университета Джон Хопкинс, 750 Wolfe Street, Балтимор, MD 21205, САЩ
Стюарт Модсли
лаборатория по невронауки, Национален институт за стареене Интрамурална програма за изследвания, 5600 Nathan Shock Drive, Балтимор, MD 21224, САЩ
c Изследователски институт Medstar, болница Харбър, 3001 S. Hanover Street, Балтимор, MD 21225, САЩ
Резюме
Уязвимостта на нервната система към напредване на възрастта твърде често се проявява в невродегенеративни разстройства като болестта на Алцхаймер и Паркинсон. В тази прегледна статия ние описваме доказателства, които предполагат, че две диетични интервенции, ограничаване на калориите (CR) и периодично гладуване (IF), могат да удължат здравословния период на нервната система, като въздействат върху основните метаболитни и клетъчни сигнални пътища, които регулират продължителността на живота. CR и IF влияят на метаболизма на енергията и кислородните радикали и на клетъчните системи за реакция на стрес по начини, които предпазват невроните от генетични и екологични фактори, на които те иначе биха се поддали по време на стареенето. Има множество интерактивни пътища и молекулярни механизми, чрез които CR и IF се възползват от невроните, включително тези, включващи инсулиноподобна сигнализация, транскрипционни фактори на FoxO, сиртуини и активирани от пероксизома пролифератор рецептори. Тези пътища стимулират производството на протеинови шаперони, невротрофни фактори и антиоксидантни ензими, всички те помагат на клетките да се справят със стреса и да се противопоставят на болестите. По-доброто разбиране на въздействието на CR и IF върху застаряващата нервна система вероятно ще доведе до нови подходи за предотвратяване и лечение на невродегенеративни разстройства.
1. Въведение
2. Молекулни действия, свързани със стареенето и дегенерацията
3. Продължителност на живота и удължаване на здравето чрез ограничаване на калориите и периодично гладуване
През цялата история много общества са признавали благоприятните ефекти върху здравето и общото благосъстояние от ограничаването на приема на храна за определени периоди от време, било по религиозни причини, или когато храната е била оскъдна. Първото широко признато научно изследване на ограничените диети и способността им да удължават живота е публикувано от McCay et al. (1935). McCay показа, че храненето на плъхове с диета, съдържаща несмилаема целулоза, значително удължава средния и максималния живот на тези животни (McCay et al., 1935). Много изследвания потвърждават този резултат и го разширяват върху мишки (Weindruch and Walford, 1988; Sprott, 1997) и други видове, включително плодови мухи (Chapman and Partridge, 1996), нематоди (Houthoofd et al., 2002), водни бълхи, паяци и риба (Weindruch and Walford, 1988).
4. Молекулни механизми на невропротекция чрез CR и IF
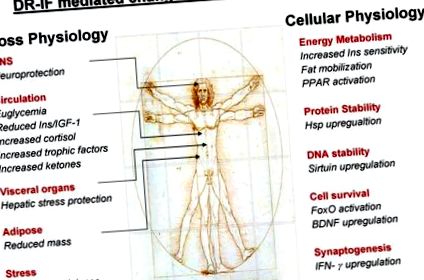
Данните от проучванията върху животни, описани в този преглед, показват, че невроните в мозъка на плъхове и мишки, поддържани на CR или IF режими, показват повишена устойчивост към оксидативни, метаболитни и екситотоксични обиди. Критичният въпрос, който трябва да зададете по отношение на тези проучвания, е какви са основните молекулни механизми, които отчитат защитата срещу това безброй мощни клетъчни обиди? Изследователите са се заели с този важен въпрос чрез измерване на множество протеини и липиди, за които е известно, че играят роля в защитата на невроните срещу много различни обиди. Ще обсъдим и демонстрираме какъв сложен физиологичен отговор на CR/IF възниква в организма и как това в крайна сметка може да се превърне в здравословно стареене.
4.1. Стресови реакции
Прекомерният неврологичен стрес често приема формата на повишени нива на глутаматергична невротрансмисия, напр. при пост-исхемични събития или епилептични припадъци може да има претоварване на клетките с калций, предизвикано от явното освобождаване на глутамат, което води до евентуална клетъчна смърт. Тази форма на екситоксична клетъчна смърт може да бъде имитирана чрез инжектиране на каинова киселина (КА) в мозъчните вентрикули/мозъчните области на експериментални животни. Когато екситотоксичният КА се инжектира в дорзалния хипокампус на мишки, той предизвиква гърчове и увреждане на пирамидални неврони в области CA3 и CA1 (Duan et al., 2001). Значително увеличение на преживяемостта на CA3 и CA1 неврони в IF мишки в сравнение с мишки, хранени ad libitum, след като е демонстрирана каиничната обида (Anson et al., 2003).
4.2. Невротрофни фактори
Тъй като IF и CR индуцират лека реакция на стрес в мозъчните клетки, това може да доведе до активиране на компенсиращи механизми, напр. повишеното регулиране на невротрофични фактори като BDNF и невротрофичен фактор, получен от глиални клетъчни линии (GDNF), както и гореспоменатите протеини на топлинен шок (Bruce-Keller et al., 1999a, b; Duan and Mattson, 1999; Duan et al., 2003; Maswood et al., 2004). Доказано е, че режимите на IF подобряват и намаляват невронните увреждания и подобряват функционалния резултат при животински модели на неврологична травма като инсулт (Yu и Mattson, 1999), както и невродегенеративни разстройства като болестта на Паркинсон (Duan and Mattson, 1999) и Huntington's заболяване (Duan et al., 2003). Невропротективният механизъм на IF не е известен, но се съобщава, че IF индуцира производството на мозъчен невротрофичен фактор (BDNF), който е свързан с повишена хипокампална неврогенеза при плъхове и мишки (Lee et al., 2002). Един от основните невропротективни механизми, приписвани на BDNF, изглежда е способността на BDNF-медиирано активиране на неговия сроден TrkB рецептор, който след това включва стимулация на множество сигнални пътища. Виден сред тези сигнални пътища на TrkB е пътят на фосфатидил инозитол 3-киназа (PI3K)/протеин киназа B (Akt), който е замесен в няколко от защитните механизми CR/IF, които ще бъдат разгледани по-подробно в този преглед.
4.3. Кетонни тела
Известно е, че диетичното гладуване води до повишено производство на кетонни тела, напр. β-хидроксибутират, който може да се използва от организма като енергиен източник в условията на ограничена наличност на глюкоза (Mitchell et al., 1995; Vazquez et al., 1985). По отношение на кетогенезата изглежда, че режимите на IF изглеждат по-податливи на този път на производство на енергия от по-строгите CR протоколи. Доказано е, че мишките на IF режими тежат средно повече от мишките на CR режими. Те също имат по-големи мастни резерви и по-голям кетогенен отговор от CR мишките. Ако диетичните режими могат да развият двукратно увеличение на серумната концентрация на β-хидроксибутират на гладно в сравнение с мишки, хранени ad libitum (Anson et al., 2003). Това преминаване към кетогенеза може да играе пряка роля в цитопротективните ефекти на IF, тъй като е съобщено, че плъхове, хранени с кетогенна диета, показват повишена устойчивост на гърчове (Bough et al., 1999) и че самият β-хидроксибутират може да защити невроните в модели на гризачи на болестта на Алцхаймер и Паркинсон (Kashiwaya et al., 2000). Кетогенни диети, които насърчават метаболитна промяна от усвояването на глюкозата към кетогенеза, също се предписват на някои пациенти с епилепсия (Gilbert et al., 2000), тъй като това е профилактично средство срещу прогресиращото екситотоксично увреждане и деградация, което може да възникне, ако състоянието не се лекува.
4.4. Сигнализиране за глюкоза/инсулин
По време на гладно или диетично ограничение основната промяна в организма е наличието на глюкоза за окислително дишане. Механизмите, чрез които енергията се получава от алтернативни източници или как се борави с останалата глюкоза, са основни за екстраполирането на ползите за здравето от режимите CR/IF. Значението на ефективността на манипулацията с глюкоза за здравословното стареене може да бъде демонстрирано от факта, че нивата на глюкоза в кръвта, интегрирани с течение на времето, се предполага, че водят до високи нива на не-ензимно гликиране, форма на увреждане на протеините. Доказано е, че CR намалява специфично оксирадикалното производство и увреждане (Weindruch и Sohal, 1997) и неензимното гликиране (Cefalu et al., 1995).
4.5. Цитокини
4.6. Ситост и хормони, генерирани от мастна тъкан
4.7. Сиртуини
Като нисши организми, напр. дрожди и нематодни червеи, имат значително по-кратък живот от бозайниците, те се оказаха полезни за откриването на молекулярните детерминанти на здравословното дълголетие. Стана очевидно, че сред множеството фактори, които са идентифицирани, които контролират продължителността на живота в тези нисши организми, много от тях също свързват изменението на приема на калории с увеличаването на здравословния период, така желано от диетичните интервенции на болестни процеси.
4.8. Рецептор, активиран от пероксизомен пролифератор (PPAR) и ко-фактори
Както видяхме, PPAR са членове на подсемейството на ядрените хормонални рецептори на транскрипционни фактори. PPARs образуват функционални хетеродимери с ретиноидни X рецептори (RXR) и тези хетеродимери регулират транскрипцията на различни гени. Има три известни подтипа на PPARs, α, δ и γ. Тези транскрипционни фактори на ядрените рецептори регулират гените, участващи в транспорта на хранителни вещества и метаболизма, както и устойчивостта на стрес. Самите PPAR също наемат други протеини в допълнение към RXR, за да посредничат за пълната им функция. Един такъв протеин е активираният от пероксизомен пролифератор γ (PPARγ) коактиватор 1 (PGC-1). Доказано е, че този коактиватор е тясно регулиран от диетичните промени при нисшите организми и висшите бозайници. PGC-1 съществува в две изоформи, α и β, и тези изоформи се появяват като видни регулатори на адаптивните реакции към лишаване от калории. PGC-1 регулира лиганд-зависимото и независимото активиране на голям брой ядрени рецептори, включително PPARs. Съобщава се за възрастово зависимо намаляване на PGC-1α (Ling et al., 2004), което може да изостри процеса на стареене. Доказано е обаче, че при мишки и примати CR намалява това зависимо от възрастта намаление на PGC-1α, PPAR и регулираните гени (Weindruch et al., 2002; Kayo et al., 2001).
PGC-1 изоформите се транскрипционно или посттранслационно регулират при бозайници чрез няколко сигнални пътеки, замесени във връзката между CR/IF и удължаването на живота. Те включват транскрипционни фактори на „forkhead box“ (други) (FoxO) (чрез инсулин/инсулиноподобен растежен фактор-I-зависим път), стимулиращ глюкагон клетъчен AMP (cAMP) свързващ протеин (CREB), стрес-активирани протеинкинази (р38 и c-jun N-терминална киназа) и не е изненадващо SIRT1. След това ще обсъдим как тези фактори взаимодействат, за да контролират молекулярните механизми на CR/IF, които влияят върху транслацията към здравословното стареене.
4.9. Транскрипционни фактори на FoxO
Една от най-важните скорошни области на изследване на калоричните ограничения е демонстрацията, че CR може да бъде в състояние да предотврати генерирането на множество форми на самия рак. Например, при мишки с генетично атенюирани нива на p53 CR увеличава латентността на спонтанното туморно развитие (предимно лимфоми) с приблизително 75% (Hursting et al., 2001). Следователно е ясно, че има фина и сложна връзка между тези свързани фактори, които са свързани помежду си чрез промени в приема на енергия с храната.
В допълнение към отрицателната регулация от инсулин/IGF-1 сигнализиране и p53, FoxO факторите се регулират от CREB свързващия протеин (CBP) и свързания с него протеин, p300. Интересното е, че клетъчната свръхекспресия на CBP (Daitoku et al., 2004) или p300 (Fukuoka et al., 2003) засилва способността на FoxO факторите да активират функционалната генна експресия. Изглежда, че SIRT1 играе централна роля в адаптивните промени в регулирането на енергията, тъй като може да обърне негативната регулация на членовете на семейството FoxO от CBP. Подобно на PGC-1, нивата на SIRT1 се повишават по време на CR в черния дроб на плъх и се регулират отрицателно от инсулин и IGF-I (Cohen et al., 2004). Освен това родственият член на семейството SIRT3, митохондриален протеин, показва повишена експресия в бяла и кафява мазнина при CR (Shi et al., 2005).
Изглежда, че FoxOs съществуват в връзка между механизми, които свързват клетъчните реакции на стрес с евентуални механизми за оцеляване. Например свързаната със стреса протеинкиназа cJun N-терминална киназа 1 (JNK-1), която служи като молекулярен сензор за различни стресори, може активно да контролира транскрипционното действие на FoxO. При C. elegans JNK-1 директно взаимодейства и фосфорилира FoxO хомолога Daf-16 и в отговор на топлинен стрес JNK-1 насърчава транслокацията на Daf-16 в ядрото. Свръхекспресията на JNK-1 в C. elegans води до увеличаване на продължителността на живота и увеличаване на преживяемостта след топлинен стрес (Oh et al., 2005). И при D. melanogaster лекото активиране на JNK води до повишена толерантност към стрес и дълголетие (Wang et al., 2003) в зависимост от непокътнат FoxO (Wang et al., 2005).
В заключение изглежда, че транскрипционните фактори на FoxO са обещаващи кандидати да служат като молекулярна връзка между диетичните модификации и дълголетието. В условия като CR/IF, при които циркулиращите нива на инсулин/IGF-1 са отслабени, за да се подобри евгликемията, ядрената транслокация на FoxO води до повишено регулиране на серия от целеви гени, които насърчават спирането на клетъчния цикъл, устойчивостта на стрес и апоптозата. Външните стресови стимули също задействат преместването на FoxO факторите в ядрото, като по този начин позволяват адаптивен отговор на стресовите стимули. В съответствие с идеята, че устойчивостта на стрес е силно свързана с удължаване на живота, активирането на транскрипционните фактори на FoxO при червеи и мухи увеличава дълголетието. FoxO протеините превръщат стимулите на околната среда, включително стреса, предизвикан от ограничаване на калориите, в промени в програмите за генна експресия, които могат да координират здравословното стареене на организма и евентуално дълголетие.
5. Калорична рестрикция при хората?
Приближаваме се към цялостно разбиране на различните молекулярни механизми, чрез които промените в приема на калории могат да бъдат пренесени в подобрено оцеляване на клетките по време на процеса на стареене. Остава обаче въпросът дали CR и IF ще имат благоприятно въздействие върху хората. Към днешна дата не е имало добре контролирани научни проучвания, които да определят ефектите на дългосрочните CR върху хората. Понастоящем има проучвания, включващи 30% CR при примати, които не са хора (резус маймуни) и данните досега от тези проучвания изглеждат обещаващи, тъй като те подкрепят свойствата на живота и здравето, удължаващи този диетичен режим (Lane et al., 1995, 1996).
Прекомерната загуба на телесни мазнини и съпътстващият спад на половите стероиди могат да доведат до менструални нарушения, аменорея, изтъняване на костите и развитие на остеопороза при жените. Може би вариация на протоколите CR/IF, при които има по-леко калорично ограничение, съчетано с промяна в честотата на хранене, може да има по-голяма вероятност за съответствие между хората. Надяваме се, че тази по-нежна промяна в приема на диетична храна ще запази предимствата на експерименталните режими, използвани досега. Струва си да се отбележи, че към днешна дата повечето проучвания, използващи CR, са сравнявали благоприятните ефекти на CR с наднормено тегло (или дори със затлъстяване) контролни животни, съответстващи на възрастта. Не е ясно дали животните със здравословно телесно тегло, които могат да участват в редовни физически упражнения и имат някаква форма на психично стимулиране (както биха направили в дивата природа), биха се възползвали от режим на CR. Неотдавнашни проучвания, проведени с хора, подложени на 25% CR, обаче се опитват да се справят с това, тъй като използват контролни субекти с нормални индекси на телесна маса.
Разработването на химичен CR миметик може да бъде обещаващ терапевтичен път за лечение на невродегенеративни заболявания и да забави процеса на стареене, тъй като би осигурил подобни ползи за здравето на CR (като удължаване на здравето и живота), като същевременно заобикаля дългосрочна нужда от намаляване на приема на храна. Остава да се види обаче дали CR миметикът би бил осъществимо лекарство за производство, особено след като оценката на процесите, при които CR упражнява своите защитни ефекти, все още е донякъде непълна и основните механизми се оказват много сложни. Също така не трябва да се отхвърлят психологическите ефекти от приема на храна при по-висши, по-интроспективни организми като хората. Ние притежаваме почти уникална емоционална връзка с огромно разнообразие от храни. Следователно премахването на тази психологическа помощ по време на подобен на CR/IF режим може частично да противодейства на физиологичните ползи от тези парадигми.
Основният фактор, който може да отрече широкото прилагане на CR/IF като ефективно геронтотерапевтично средство, е потенциално съвременният западен начин на живот с почти постоянна работа и постоянно високи нива на стрес. Следователно, за да изградим обществото и технологичния напредък, с които сме свикнали, оставихме моделите на хранене на нашите древни предци в полза на постоянна умствена дейност и ограничени физически упражнения. Поради увеличаването на ежедневната ни активност, ние имаме повишена потребност от енергия (главно глюкоза), докато нашата физиология до голяма степен все още е насочена към пиршество и глад на енергийния прием, характерен за нашите предци-ловци-събирачи. Тази дилема между нашето съвременно общество/поведение и нашата древна физиология ще представлява повтарящ се проблем за геронтологията през следващите години. Надяваме се, че с бързо напредващата ни оценка на процеса на стареене няма да има нужда да чакаме физиологичната ни еволюция да настигне начина ни на живот.
Признание
Тази работа беше подкрепена от Националния институт за програма за стареене на вътрешни изследвания.
- Ограничението на калориите забавя признаците на стареене при хората The Scientist Magazine®
- Обяснени 4 диети с периодично гладуване
- 4 причини да не се опитвате с периодично гладуване
- 4 причини, поради които трябва да прекъсвате гладуването
- 9 Чести нежелани реакции на периодичното гладуване и как да се справим с тях