Оксана А Красилникова
1 Харковски национален университет, Институт по биология, 4, пл. Свободи, Харков, 61077, Украйна
Наталия С Кавок
1 Харковски национален университет, Институт по биология, 4, пл. Свободи, Харков, 61077, Украйна
Наталия А Бабенко
1 Харковски национален университет, Институт по биология, 4, пл. Свободи, Харков, 61077, Украйна
Резюме
Заден план
Тиреоидните хормони са добре известни модулатори на сигналната трансдукция. Определен е ефектът от хипер- и хипотиреоидизъм върху сигнализирането на диацилглицерол/протеин киназа С (DAG/PKC) в кардиомиоцитите. Доказано е, че трийодтиронинът (Т3) предотвратява медиираното от α1-адренорецептора активиране на ПКК, но не променя стимулацията на ензимния и чернодробния метаболизъм от етери на форбол. Предполага се, че повишаването на ендогенния DAG в стареещи или хипотиреоидни клетки променя PKC-зависимия отговор на клетките към естерите на форбол и хормоните. В настоящото проучване беше изследвано образуването на DAG и активирането на ПКК в чернодробните клетки от плъхове с различен статус на щитовидната жлеза.
Резултати
Заключения
Горните данни показват, че хормоните на щитовидната жлеза са важни физиологични модулатори на нивото на DAG в чернодробните и клетъчните плазматични мембрани. Индуцираната от възрастта и лекарствата неправилна работа на щитовидната жлеза доведе до значително намаляване на синтеза на глицеролипиди, което може да стимулира натрупването на DAG в черния дроб.
Заден план
Многобройни изследвания демонстрират нова роля на тиреоидните хормони като модулатори на сигналната трансдукция. PKC е от решаващо значение за механизма, чрез който тиреоидните хормони бързо индуцират фосфорилиране и ядрена транслокация на митоген-активирана протеин киназа и впоследствие усилват както антивирусните, така и имуномодулиращите действия на IFNγ в култивирани клетки [14] и регулират обмена на сигнални фосфолипиди (PL) хепатоцити [15,16]. Установено е, че L-T4 бързо индуцира двуфазното натрупване на DAG и активирането на ПКК в чернодробни филийки и изолирани хепатоцити [17]. Ефектът от L-T4 върху натрупването на PLC, -D, PKC и DAG беше твърде бърз: от секунди до няколко минути. Перфузията на черния дроб на хипотиреоидни плъхове с L-T4-съдържащ разтвор в продължение на 10 минути повишава съдържанието на DAG в черния дроб [18]. Въпреки това, ефектът на хипотиреоидизма върху базалното ниво на DAG в черния дроб не е определен.
В настоящото проучване ние изследвахме нивото на DAG и активността на ПКК в черния дроб и изолираните мембрани по време на продължителна стимулация на тиреоидния хормон и при различно състояние на щитовидната жлеза на организма. Влошаването на функцията на щитовидната жлеза при стареене или под действието на мерказолил намалява синтеза на PL и TAG в черния дроб и повишава нивото на DAG в чернодробни резени и изолирани чернодробни клетъчни плазматични мембрани. Хипотиреоидизмът значително намалява PKC активността. Приложението на L-T4 на интактни или лекувани с мерказолил плъхове намалява нивото на DAG и увеличава синтеза на PL и TAG в черния дроб. Тези резултати предоставят доказателства, че тироксинът е от решаващо значение за понижаване на DAG чрез превръщането им в PL и TAG по време на продължително хормонално действие.
Резултати и дискусия
Настоящата работа е насочена към изясняване на влиянието на функционалния статус на щитовидната жлеза върху нивото на DAG в чернодробните и плазмените мембрани. За да се определи ролята на тиреоидните хормони в регулирането на нивото на DAG в черния дроб, е направено сравнение на лекувани с еутироиди, мерказолил и мерказолил + L-T4 плъхове или непокътнати животни след инжектиране на L-T4.
Резултатите от изследването на съдържанието на хормони на щитовидната жлеза в кръвния серум на плъхове са дадени в таблица Таблица1. 1. Показано е, че нивата на тироксин и трийодтиронин са значително по-ниски в кръвния серум на 720-дневни непокътнати плъхове и плъхове, лекувани с мерказолил, в сравнение с подходящите контроли. Получените данни са в съответствие с предишни наблюдения на възрастова и лекарствена недостатъчност на щитовидната жлеза [19-21].
маса 1
Съдържание на тироксин и трийодтиронин в серума в кръвта при плъхове на различна възраст и статус на щитовидната жлеза
| Животни | Възраст | |||
| На 90 дни | На 720 дни | |||
| Т4 | Т3 | Т4 | Т3 | |
| Контрол | 88,0 ± 6,9 | 1,5 ± 0,07 | 58,2 ± 3,2 * | 0,82 ± 0,0 * |
| Лекуван с Мерказолил | 48,6 ± 0,9 ** | 0,3 ± 0,08 ** | 20,6 ± 4,26 ** | 0 |
| Лекувани с тироксин | 410 ± 51,0 *** | 5,86 ± 0,48 *** | 270 ± 10,0 *** | 3,9 ± 0,09 *** |
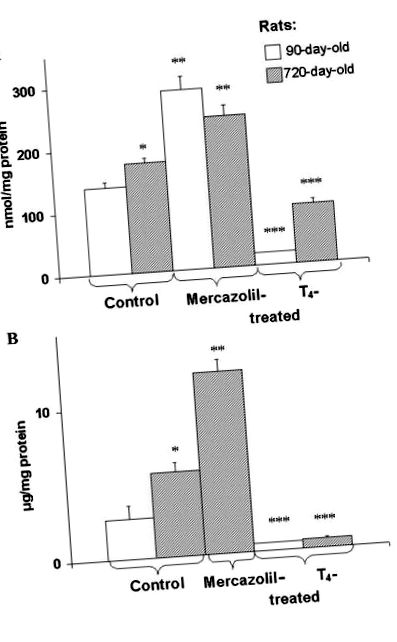
Съдържанието на Т4 и Т3 в кръвния серум се определя чрез радиоимунологични комплекти. Количеството на хормоните на щитовидната жлеза в серума е представено като nmol на литър. Третирането на плъхове с мерказолил се извършва, както е описано в "Материали и методи". Т4 (200 μg/100 g телесно тегло) се инжектира на нормалните плъхове три пъти седмично. Последната инжекция на хормона е направена 48 часа преди убийството. Резултатите са средни ± S.E. от 8 индивидуални експеримента. Тук и в Таблица Таблица2 2 и Фигури Фигури1 1, 2 2, 3 3, 4 4, 5 5 един експеримент е еквивалентен на измерване на параметрите, изследвани в проба от серум или черен дроб на едно животно. * p ** p *** p 1A, 1B) и [14 C] DAG (Фиг. (Фиг. 2A, 2A, 3) 3) натрупване както в почиващ черен дроб, така и в клетъчни плазмени мембрани на възрастни плъхове. Установено е, че изолираните [14 C] олеинова киселина предварително маркирани хепатоцити съдържат по-високи базални нива на DAG: 7359 ± 746, за разлика от 1171 ± 228 cpm/10 7 клетки (P ≤ 0,05, n = 5) в клетки на възрастни животни. Мерказолил води до по-нататъшно увеличаване на DAG масата в черния дроб (фиг. (Фиг. 1А) 1А) и изолираните плазмени мембрани (фиг. (Фиг. 1В) 1Б) на животни от различна възраст. Третирани с L-T4 плъхове показват значително намаляване на нивото на DAG в черния дроб (фиг. (Фиг. 1А) 1А) и изолирани мембрани (фиг. (Фиг. 1В) 1В) и [14 С] DAG в черния дроб ( Фиг. (Фиг. 2В) 2В) на плъхове от различна възраст. Въпреки това, Т4 не увеличава натрупването на свободна 14 С-мастна киселина (FFA) в черния дроб (Фиг. (Фиг. 2С). 2С). По този начин въздействието на DAG липаза в свързаното с хормони намаляване на нивото на DAG в черния дроб може да бъде изключено. Наблюдавано е възрастово и свързано с мерказолил нарастване на новосинтезиран [14 C] DAG в чернодробни филийки (фиг. (Фиг. 3). 3). Прилагането на L-T4 на лекувани с мерказолил плъхове намалява натрупването на [14 C] DAG в чернодробни филийки. Mercazolil и L-T4 намаляват възрастовите особености на [14 C] DAG ниво в черния дроб. Последното наблюдение е индикация, че наблюдаваните промени в състоянието на щитовидната жлеза на организма в напреднала възраст могат да допринесат за свързаните с възрастта промени в нивото на DAG в черния дроб.
Таблица 2
Съотношение 14 C/3 H на класовете 1,2-диацилглицерол и фосфолипиди в чернодробни парчета плъхове с различен статус на щитовидната жлеза
| Класове по липиди | Животни | ||
| Контрол | Лекуван с Мерказолил | Лекувани с тироксин | |
| DAG | 2,33 ± 0,19 | 4,33 ± 0,56 | 3,17 ± 0,38 |
| настолен компютър | 1,24 ± 0,16 | 0,94 ± 0,16 | 0,93 ± 0,18 |
| PE | 0,69 ± 0,20 | 1,18 ± 0,15 | 0,44 ± 0,09 |
| PI | 1,32 ± 0,17 | 0,90 ± 0,09 | 0,44 ± 0,09 |
| PIP | 0,52 ± 0,15 | 0,39 ± 0,03 | 0,50 ± 0,12 |
| PIP2 | 0,32 ± 0,04 | 0,44 ± 0,04 | 0,33 ± 0,07 |
Чернодробни парчета от 90-дневни плъхове бяха предварително маркирани с [14 С] олеинова и [3Н] арахидонова киселина и липиди, извлечени и разделени, както е описано в "Материали и методи". Данните са средни ± S.E. от три отделни експеримента.
Новосинтезиран [14 C] -PC и [14 C] -TAG в чернодробни парчета плъхове на различна възраст и статус на щитовидната жлеза. Mercazolil се инжектира на животните, както е описано в "Материали и методи". Т4 (10 μg/100 g тегло) се инжектира на третираните с мерказолил плъхове 48 h преди убиването. Контролните плъхове получават същия обем от 0,9% NaCl. Чернодробните филийки бяха маркирани чрез инкубация в среда Eagle, съдържаща 10% фетален телешки серум, 100 единици/литър стрептомицин, 100 единици/литър пеницилин, 13 mg/ml гентамицин и 2,5 μCi/ml [14 C] палмитинова киселина за 1 h в 95% O2/5% CO2 атмосфера при 37 ° C. Липидите бяха извлечени и анализирани, както е описано в "Материали и методи". Резултатите са средни ± S.E. от шест отделни експеримента. * P ** P *** P (Фиг. 5). 5). Имаше само леки разлики в субклетъчното разпределение на ПКК в чернодробните клетки на двете групи плъхове. Въпреки това, общата PKC активност в черния дроб на третирани с мерказолил животни е по-малка, отколкото при контролните плъхове. Добавянето на екзогенен DAG напълно премахва разликите между PKC активността в чернодробните клетки на eu- и хипертиреоидни плъхове [39]. Известно е, че продължителната инкубация с форбол естери изчерпва клетките на РКС а и β [за преглед вж. [40]]. Освен това са получени доказателства за повишено разграждане на ПКК след продължително клетъчно инкубиране с етери на форбол и DAG. Резултатите от настоящото проучване показват, че неподходящото натрупване на DAG в чернодробните клетки на хипотиреоидни животни допринася за изчерпването на ПКК. Намаляването на експресията на PKC изозим обаче не може да бъде изключено. Необходима е допълнителна работа за изясняване на тази точка.
Ефект на мерказолил върху PKC активността в чернодробните клетки. Mercazolil се инжектира на животните и PKC активността се определя, както е описано в "Материали и методи". Резултатите са средни ± S.E. от четири отделни експеримента. * P 2+ йонофор> A23187 [41]. Предишни данни показват, че само форбол 12-миристат 13-ацетат, но не и неговият неактивен аналог, форбол 12-миристат 13-ацетат 4-О-метилов етер, включване на активирана линолова киселина в PL [15] и синтез на фосфоинозитид de novo в чернодробни филийки и изолирани хепатоцити [16]. PKC-зависима сигнализация е показана в плазмените мембрани на млади непокътнати 90-дневни плъхове. Не е открит ефект в плазмените мембрани, изолирани от черния дроб на 720-дневни плъхове, третирани с мерказолил. Тези открития предполагат, че десенсибилизацията на отговора към агонист в клетката на хипотиреоидни плъхове зависи от регулирането на PKC надолу при такова патологично състояние на организма.
Заключения
В заключение, резултатите от настоящото проучване показват, че хормонът на щитовидната жлеза е потенциално важен физиологичен модулатор на нивото на DAG в черния дроб на плъх. За разлика от предишната ни работа [17], когато беше показано, че тироксинът (във физиологична концентрация) индуцира PLC/PLD активиране и краткотрайно натрупване на DAG в чернодробните клетки, ние открихме забележимото намаляване на нивото на DAG при нефизиологични дози на хормонално приложение на плъхове. Зависимият от възрастта и мерказолил спад на нивото на тиреоидния хормон в кръвния серум съвпада с повишаване на съдържанието на DAG в чернодробните и чернодробните клетъчни плазмени мембрани. За разлика от това, при хипотиреоиден статус на организма синтезът на PL и TAG намалява в черния дроб. Намаляването на синтеза на глицеролипиди и повишаването на нивото на DAG може да бъде коригирано чрез лечение с тироксин на плъхове с хипотиреоидна жлеза. По този начин, зависимите от хормоните на щитовидната жлеза промени в съдържанието на DAG вероятно са свързани със синтеза на глицеролипиди. Изключително високото базално ниво на DAG в хипотиреоиден черен дроб съвпада с намалена PKC активност както в цитозола, така и в мембраната на чернодробните клетки. Предполага се, че стабилните промени в метаболизма на DAG в хипотиреоиден черен дроб водят до нарушения в реакцията на агонистите на чернодробните клетки.
Материали и методи
Материали
[14 C] олеинова киселина (58 mCi/mmol) и [3 H] арахидонова киселина (60 Ci/mmol) - Amersham Corp., [14 C] палмитинова киселина (58 mCi/mmol), [γ- 32 P] ATP (1000 Ci/mmol) и [14 C] CH3COOH (25 mCi/mmol) - BPO Isotop (Русия); DEAE-52-целулоза от Whatman (Англия); силикагел от Woelm (Германия). Фосфатидилсеринът е изолиран от мозъка на вол; други липидни стандарти и хистон Н1 са получени от Sigma (САЩ). Т4 и мерказолил (1-метил, 2-меркаптоимидозол) са от Zdorov'e Trudyaschikhsya (Харков, Украйна). Комплектите за радиоимуноанализ T4 и T3 бяха от Минск (Беларус). Други използвани химикали са от химически чист клас.
Животни
За експерименти са използвани възрастни 90- и 720-дневни мъжки плъхове Wistar, които са имали свободен достъп до храна и вода и са били държани при 24 ° C при цикъл от 12 часа светлина/12 часа тъмнина. Mercazolil се инжектира интраперитонеално (1 mg/100 g тегло) в 0,9% NaCl на експериментални животни всеки ден по време на 16-дневен експеримент. В някои случаи, лекуваните с мерказолил плъхове се инжектират интраперитонеално от Т4 (10 μg/100 g тегло) 48 часа преди убиването. Освен това Т4 (200 μg/100 g тегло) се инжектира на нормалните плъхове 15, 30 и 60 минути преди умъртвяването или три пъти седмично, като в този случай последната инжекция на хормона е направена 48 часа преди убиването. Контролните плъхове получават 0.9% NaCl от същия обем. Животните са гладували цяла нощ преди експеримента. Състоянието на щитовидната жлеза на плъховете се наблюдава чрез радиоимунологично определяне на Т4 и Т3 в кръвен серум.
Експерименти с резени на черния дроб
1 mCi от [14 C] CH3COOH се инжектира интраперитонеално на плъхове четири пъти на всеки 30 минути в продължение на 2 часа [42]. Черният дроб беше перфузиран с 0.9% NaCl, след това отстранен и промит в буфер на Krebs-Henseleit, рН 7.4, съдържащ 2 mM CaCl2 и 0.2% BSA. Предварително белязани резени черен дроб бяха използвани за [14 C] -DAG и [14 C] -FFA анализ. Освен това чернодробните филийки бяха маркирани чрез инкубация в среда Eagle, съдържаща 10% фетален телешки серум, 100 единици/литър стрептомицин, 100 единици/литър пеницилин, 13 mg/ml гентамицин и 2,5 μCi/ml [14 С] олеинова киселина и 2,5 μCi/ml [3 H] арахидонова киселина или 2,5 μCi/ml [14 C] палмитинова киселина самостоятелно за 1 h в 95% O2/5% CO2 атмосфера при 37 ° C. Липидите бяха извлечени и анализирани, както е описано по-долу.
Експерименти с клетъчно суспендиране
Хепатоцитите са изолирани от 90- и 720-дневните мъжки плъхове Wistar, които са имали свободен достъп до храна и вода и са били държани при 24 ° C на цикъл от 12 часа светлина/12 часа тъмнина по метода, описан в [41 ]. Подготовката на хепатоцитите започна между 9:00 и 10:00 ч. Клетките (10 7/ml) бяха маркирани чрез инкубация в среда Eagle, съдържаща 10% фетален телешки серум, 100 единици/литър стрептомицин, 100 единици/литър пеницилин, 13 mg/ml гентамицин и 2,5 μCi/ml [14 C] олеинова киселина за 3 h в 95% O2/5% CO2 атмосфера при 37 ° C. Преди екстракция с липиди, клетките се промиват два пъти с буфер на Krebs-Henseleit рН 7,4, съдържащ 2 mM CaCl2, 25 mM HEPES, 0,1% BSA. Липидите бяха извлечени и анализирани, както е описано по-долу.
Изолиране на плазмените мембрани на чернодробните клетки
Плазмените мембрани се приготвят чрез диференциално центрофугиране чрез различна концентрация на захароза и се характеризират с техните специфични маркери ензими, както е описано в [43]. Липидите бяха извлечени и анализирани, както е описано по-долу.
Екстракция и отделяне на липиди
Липидите се екстрахират съгласно Folch et al. [44] и фосфоинозитиди, както е описано в [45]. Хлороформната фаза се събира и суши под N2 при 37 ° С. Липидите се разтварят отново в хлороформ/метанол (1: 2, v/v) и се нанасят върху TLC плаки. За DAG и FFA изолиране се използва системата от разтворители: хексан/диетилов етер/оцетна киселина (80: 20: 2, v/v); за разделяне на PC и PE - хлороформ/метанол/оцетна киселина/вода (25: 15: 4: 2, v/v) и за PI, PIP и PIP2 - хлороформ/метанол/NH4OH (50:40:10, v/v ). Подходящи стандарти бяха приложени на всяка плоча за количествено определяне. Гелните петна, съдържащи липиди [14 C/3 H], бяха изстъргани и прехвърлени в сцинтилационни флакони. Радиоактивността се измерва чрез сцинтилационен брояч.
Ензимен анализ на протеин киназа С
Дейността на протеин киназа С в цитозола и в суровата мембранна фракция на чернодробните клетки се определя след частично ензимно пречистване чрез хроматография върху DEAE-целулоза [46]. Активността на протеин киназа С се определя чрез прехвърляне на 32 Р от [γ- 32 Р] АТР в Н1 хистон в присъствието на фосфатидилсерин и Са 2+ (0.2 тМ). Тъй като хистонът е лош субстрат за нечувствителни на калций изоформи на PKC, преобладаващите открити изоформи на PKC са cPKC и aPKC. Ензимната активност се изразява като pmoles фосфат, прехвърлен от [γ- 32 P] ATP в H1 хистон за минута. Съдържанието на протеин се определя по метода на Брадфорд [47].
Съкращения
T4 - тироксин, T3 - трийодтиронин, PKC - протеин киназа C, PI - фосфатидилинозитолфосфат, PIP - фосфатидилинозитол 4-фосфат, PIP2 - фосфатидилинозитол 4,5-бисфосфат, PLC - фосфолипаза C, DAG - безмаслена киселина DAG - триацилглицерол, PL - фосфолипиди, PAP - фосфатидна киселина фосфатидна киселина, PC - фосфатидилхолин, PE - фосфатидилетаноламин, TPA - 12-O-тетрадеканоилфорбол 13-ацетат.
- Почистете черния дроб - Как да прочистите черния дроб и бъбреците си
- Ядене на черен дроб за отслабване; Загубени цици
- Клинично изпитване на безалкохолна мастна чернодробна болест Runihol, плацебо - Регистър на клиничните изпитвания -
- Диетични натурални продукти за профилактика и лечение на рак на черния дроб
- Ефект от намаляването на теглото върху чернодробната хистология и биохимия при пациенти с хроничен хепатит С