Обобщение
Метаболитната гъвкавост е способността да се реагира или да се адаптира към условни промени в метаболитното търсене. Тази широка концепция е разпространена, за да обясни инсулиновата резистентност и механизмите, регулиращи избора на гориво между глюкоза и мастни киселини, подчертавайки метаболитната гъвкавост на затлъстяването и диабет тип 2. Успоредно с това, съвременните физиологични изследвания на упражненията помогнаха да се идентифицират потенциалните механизми в основата на променения метаболизъм на горивото при затлъстяване и диабет. Напредъкът в технологиите „omics“ допълнително стимулира допълнителни основни и клинично-транслационни изследвания за по-нататъшно разпитване на механизми за подобрена метаболитна гъвкавост в скелетната мускулатура и мастната тъкан с цел предотвратяване и лечение на метаболитни заболявания.
Какво е метаболитна гъвкавост?
Метаболитната гъвкавост описва способността на организма да реагира или да се адаптира според промените в метаболитните или енергийните нужди, както и преобладаващите условия или активност. За първи път се използва като термин, описващ увеличения капацитет на хелминти, паразитен червей, за генериране на химическа енергия и ключови метаболити или аеробно, или чрез използване на анаеробни дишания, за да му се придаде по-голяма гъвкавост и метаболитна гъвкавост, за да реагира и да се адаптира към промените в околната среда в местообитанието си (Kohler, 1985).
По-често срещаната концепция за метаболитна гъвкавост е разпространена в контекста на избора на гориво при прехода от гладуване към състояния на хранене или гладуване към инсулинова стимулация, за да се обясни инсулиновата резистентност (Goodpaster and Kelley, 2008). Оригиналният цикъл на Randle (Randle et al., 1963) е изложен като принцип, който обяснява повишеното окисление на мастните киселини и намаленото окисление на глюкозата в основата на инсулиновата резистентност и диабет тип 2. По-късно Кели и Мандарино преразгледаха тези концепции след поредица от елегантни проучвания за баланс на крайниците in vivo, демонстриращи метаболитна гъвкавост при диабет тип 2 и затлъстяване при хора, при които по време на пост-абсорбционни състояния скелетните мускули са повишили окислението на глюкозата и реципрочното намалено окисление на мастните киселини ( Kelley, 1994, 1993; Kelley and Mandarino, 1990; Kelley et al., 1993). Откакто бяха описани тези първи експерименти, терминът метаболитна гъвкавост се е развил, за да обхване други метаболитни обстоятелства и тъкани и по-широко се отнася до физиологична адаптивност. Предполага се също, че метаболитната гъвкавост има тъканна специфичност в отговор на нощни и дневни условия на гладно и хранене (Kelley et al., 1999).
Упражнението е друго физиологично състояние, което изисква метаболитна гъвкавост, за да се съпостави наличността на гориво с метаболитната техника, за да се отговори на огромно нарастване на енергийните нужди. Продължителността и интензивността на упражненията могат да повлияят дълбоко на потреблението на енергия, като по този начин облагат енергийните запаси и катаболните пътища по много различни начини. Въпреки че темата за промените в метаболизма, предизвикани от физическо натоварване, беше разгледана в последните прегледи (вж. (Egan and Zierath, 2013; Hawley et al., 2014)), механизмите, залегнали в основата на метаболитната гъвкавост при упражнения, заслужават допълнително проучване. „Мускулна пластичност“ се използва за първи път (Pette, 1980) като термин, използван за характеризиране на способността на мускулите да реагират на различни стимули и включва метаболитна гъвкавост. Обучението с упражнения може да промени съхранението и наличността на гориво, както и скорошни доказателства, че упражненията насърчават промените в епигенома на скелетните мускули (Rasmussen et al., 2014), транскриптома (Keller et al., 2011; Raue et al., 2012) и протеома (Hoffman и др., 2015), които представляват анаболна гъвкавост, за да се отговори на промените в енергийните изисквания за всеки пристъп на упражнение или дейност, заслужават по-задълбочени изследвания на молекулярните механизми, движещи метаболитната гъвкавост.
Всеки преглед или дискусия на тези общи концепции за метаболитна гъвкавост заслужава да бъде поставен в някакъв контекст и рамка; тъй като без това рецензията може да бъде твърде широка и тромава. Ще разгледаме процесите и някои от основните механизми на здравословните метаболитно гъвкави реакции на гладуване и хранене и от почивка към упражнения, както и с някои изводи за метаболитна гъвкавост, свързана с патобиологията. В този контекст ще разгледаме доказателствата, че тренировъчните тренировки могат да подобрят метаболитната гъвкавост, изключително важна за подобряване на патофизиологичните аспекти на затлъстяването, диабет тип 2 и стареенето. Също така ще се опитаме да обобщим доказателствата, сравняващи и противопоставящи ефектите от тренировките за упражнения и индуцираното от ограничаване на калориите отслабване върху метаболитната гъвкавост и последиците, които това вероятно има върху превенцията и лечението на тези състояния.
Подчертаваме ролята на скелетните мускули и мастната тъкан в метаболитната гъвкавост при хората. Това са две тъкани, които играят решаваща роля в енергийния метаболизъм и и двете могат да бъдат достъпни при хора с биопсии, за да се разпита тяхната биология и отговор на остри и хронични интервенции. Независимо от тъканите, метаболитната гъвкавост се задвижва от клетъчни и органелни процеси, може би най-подходящите в митохондриите. Тук ние обмисляме метаболитна гъвкавост по време на съответните условия на гладно, инсулинова стимулация и упражнения. Ние също така обсъждаме някои от клетъчните аспекти на метаболитната гъвкавост, които са повторно капитулирани in vitro.
На гладно към хранене - инсулинова резистентност като част от метаболитната гъвкавост при затлъстяване и диабет тип 2
Скелетните мускули задвижват катаболизма на горивото
Оригиналната техника за непряка калориметрия на крайниците, установена от Andres и колеги през 1956 г., измерва окислението на глюкозата и мастните киселини чрез дихателния коефициент (RQ) на предмишницата по време на пост-абсорбционни условия (Andres et al., 1956). Те ясно показаха, че нормалният, здравословен преход от гладуване към хранене включва промени в избора на гориво от предимно окислителния метаболизъм на мастните киселини към повече окисляване на глюкозата в скелетните мускули. По-късно Кели и колеги демонстрират, че тази промяна включва, макар и в количествено по-малка степен, увеличаване на производството на гликолитична енергия (Kelley et al., 1999).
Тъй като енергийните разходи, най-вече от термичния ефект на храната, се увеличават с по-малко от 10% (Acheson et al., 1984), тази промяна на субстрата служи за ефективно използване на енергийните източници въз основа на съдържанието или сместа на макронутриентите в храната. Основната цел на тази смяна на субстрата е да премине от катаболни към анаболни процеси, при които енергията може ефективно да се съхранява в скелетните мускули, мастната и чернодробната тъкани. Освобождаването на инсулин в отговор на хранене е основен двигател на тази промяна.
Голяма част от вниманието около метаболитната гъвкавост се дължи на нейното отражение върху инсулиновата резистентност, концепция, за първи път предложена от Вилхелм Фалта и публикувана във Виена през 1931 г. като възможна основна причина за диабет тип 2 (Falta и Boller, 1931). През следващите 85 години инсулиновата резистентност се превърна в общоприета като преобладаващ фактор, водещ до диабет тип 2, и най-вероятната единична връзка между съзвездието от кардиометаболитни рискови фактори, известни като метаболитен синдром, свързващ затлъстяването, диабет тип 2 и сърдечно-съдови заболявания (Рийвън, 1988).
Резистентност към инсулин на скелетните мускули и метаболизъм на мастните киселини
Инсулиновата резистентност е ключов компонент на метаболитната гъвкавост, която може да се развие в много тъкани и органи. Клетъчните механизми за инсулинова резистентност са разгледани подробно (Flier et al., 1979; Holland and Summers, 2008; Shulman, 2004). Значителен акцент върху механизмите, залегнали в основата на инсулиновата резистентност в черния дроб и скелетните мускули, е поставен върху ролята на нарушеното окисление на митохондриалните мастни киселини и излишното натрупване на липидни метаболити диацилглицерол и керамиди.
Скелетните мускули представляват
60–80% от увеличаването на метаболизма на глюкозата в отговор на инсулин (Ng et al., 2012) и огромна работа подкрепят причинно-следствената роля за инсулиновата резистентност на скелетните мускули при диабет тип 2 (DeFronzo and Tripathy, 2009; Petersen и др., 2007). Интуитивно, намаляването на количеството глюкоза, постъпващо в мускулните клетки и адипоцитите от кръвния поток, заедно с намаленото потискане на производството на чернодробна глюкоза, ще повиши глюкозата в кръвта при липса на съответно увеличение на отделянето на инсулин от бета-клетките на панкреаса . Според аргумента, диабетът се развива, ако и когато бета клетките не успеят да компенсират по подходящ начин тази инсулинова резистентност с по-висока секреция на инсулин.
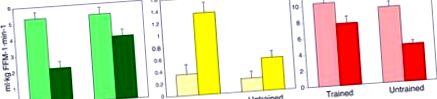
По време на хиперинсулинемично-евгликемична скоба „глюкоза” без (светли стълбове) или с (тъмни стълбове) съвместна инфузия на интралипид, обучените лица намаляват окисляването на глюкозата (зелени стълбове), увеличават окисляването на мастните киселини (жълти стълбове) и запазват съхранението на мускулен гликоген червени ленти) спрямо нетренирани субекти, които проявяват метаболитна гъвкавост. С други думи, нетренираните субекти не намаляват ефективно окисляването на глюкозата или увеличават окисляването на мастните киселини и намаляват съхранението на гликоген при претоварване с липиди. Данните са получени от (Dube et al., 2014).
Бялата мастна тъкан оркестрира горивен поток
Фигура 2 улавя силата на метаболитната адаптивност на WAT, за да повлияе на метаболизма в други тъкани като скелетните мускули. Притъпеното потискане на липолизата от инсулин по време на хиперинсулинемично-евгликемична скоба се свързва с намален гликолитичен катаболизъм и метаболитна гъвкавост при здрави хора (2a) (Sparks et al., 2009) и се разделя по диабет, а не по масова маса (2b) (непубликувани данни). Нощното гладуване предизвиква висока липолитична активност в WAT за стабилно снабдяване с FFA (Frayn et al., 1996) и пропорционално високи нива на окисляване на мазнините в скелетните мускули (ниско RQ), способност, която е притъпена при лица с фамилна анамнеза от тип 2 диабет (Ukropcova et al., 2007). В контекста на инсулиновата чувствителност на WAT (EC50) (Nurjhan et al., 1986) са необходими ниски нива на инсулин, за да може WAT да отговори на това предизвикателство на предизвиканото от гладуване търсене на FFA. Когато трептенията на секрецията на инсулин са отслабени и/или отсъстват, като например при хора с фамилна анамнеза за диабет тип 2 (Matthews, 1996; O'Rahilly et al., 1988), WAT може да развие инсулинова резистентност като адаптивна реакция или защита механизъм, за да продължи доставката на FFAs към скелетните мускули и други тъкани, ако е необходимо. Следователно патобиологията е трудна за определяне без условен контекст.
а) Свободните мастни киселини (FFAs) по време на хиперинсулинемично-евгликемична скоба с непрекъсната инфузия на инсулин от 80 mU/m 2/min за 3-4 часа са свързани с намалена метаболитна гъвкавост (делта RQ) в популация от 56 здрави млади мъже, разделени на квартили с метаболитна гъвкавост. б) Хората с диабет тип 2 (T2D; n = 18) имат значително по-високи нива на FFAs по време на хиперинсулинемично-евгликемична скоба с първоначално непрекъсната инфузия на инсулин от 100 mU/m 2/min за 3-4 часа в сравнение с възрастта и ИТМ -съответстващи здрави хора (ND; n = 6) и силно активни хора (Active; n = 8). ANOVA се използва за тестване за разлики между квартилите на метаболитна гъвкавост (делта RQ), с post hoc тестване чрез среден контраст на равенство между различни групи, използвайки Tukey-Kramer HSD; алфа = 0,05. Честота на грешки от тип I е зададена априори при p Фигура 3 илюстрира елегантно анаболния капацитет на WAT. По време на три хранения в рамките на 24 часа мъжете с коремно затлъстяване имат значително по-нисък транскапиларен поток на FA (нетно съхранение и освобождаване на мазнини) от WAT (McQuaid et al., 2011). Интуитивно, тъй като по-малко диетични FFAs се съхраняват постепенно във WAT с всяко хранене, тези FFA остават в обращение и вероятно се отлагат извънматочно в други тъкани и водят до метаболитни смущения в тях. Фигура 4 изобразява прогресивно увеличаване на RQ след хранене (така изгарянето на повече въглехидрати, отколкото мазнини) от 3-то от 3 хранения за период от 24 часа при слаби здрави индивиди (непубликувани данни). Същността на координираната метаболитна гъвкавост между тъканите в здравословно състояние диктува, че колкото повече мазнини се съхраняват (и инертно отделят) в WAT след хранене, толкова по-малко мазнини са налични за катаболизъм от други тъкани, което води до по-голяма зависимост от окисляването на въглехидратите ( по-висок RQ).
Ефекти от тренировъчните упражнения и индуцираното от калории отслабване върху метаболитната гъвкавост
Намаляването на мастната маса чрез хирургично отстраняване (липосукция) на WAT не води до метаболитно полезни резултати (Klein et al., 2004), което сочи към необходимостта от ограничаване на калориите и/или упражняване, преустройство на WAT, за да се постигнете метаболитни подобрения в мастната тъкан. Малко се знае за ефектите от упражненията върху метаболитната гъвкавост (по отношение на инсулина и отзивчивостта при остра физическа активност) и свързаните с тях молекулярни механизми в WAT. Индуцираната от ограничаване на калориите загуба на тегло има по-широк ефект върху транскриптома в WAT в сравнение с ограничаването на калориите плюс упражнения (Lam et al., 2016). Допълнителни проучвания са оправдани, за да се определи дали тренировките за упражнения и отслабването могат да имат общи подписи, които подобряват митохондриалната функция, ефективността или намаляват оксидативния стрес, съпътстващ с повишена метаболитна гъвкавост.
Може ли метаболитната гъвкавост да бъде цел за предотвратяване или лечение на болести?
Метаболитната гъвкавост обхваща разнообразни пътища и механизми. Доколкото една цел може да бъде ангажирана за промяна на избора на гориво или разхода на енергия, метаболитната гъвкавост или поне компоненти от тях, следователно, биха могли да бъдат жизнеспособни цели за терапия. Полагат се огромни усилия за промяна на метаболитната гъвкавост при затлъстяване и диабет. Ключов спор в тази област е дали промените в избора на гориво без съпътстващо увеличаване на енергийното търсене ще се окажат терапевтични при претоварване с хранителни вещества или затлъстяване (вж. Преглед от Muoio (Muoio, 2014). Например, увеличаване на потока на митохондриалните мастни киселини и окислението може (Bruce et al., 2009) или не (Koves et al., 2008) да подобри инсулиновата резистентност. Нито една от стратегиите обаче не увеличава енергийните разходи или търсенето (като упражнения). Просто казано, докато стратегиите за промяна на метаболизма на субстрата или метаболитната гъвкавост може да повлияе на затлъстяването и метаболитните заболявания в контекста на претоварване с хранителни вещества, без съпътстващо увеличаване на енергийното търсене, те не представляват истинско миметично упражнение.
Заключителни бележки
Широките концепции за метаболитна гъвкавост предизвикаха десетилетия на изследване на фактори и механизми, влияещи върху наличността на енергия и избора на гориво. Голяма част от ранната работа се фокусира върху разбирането на инсулиновата резистентност в скелетните мускули и мастните тъкани като част от цялостната метаболитна гъвкавост. По-нови проучвания изследват метаболитната гъвкавост в мускулните и мастните клетки и съответните им роли в общата метаболитна гъвкавост. Проучвания, използващи гладуване за хранене (или инсулинова стимулация), почивка за упражнения или тренировъчни интервенции с мастни и мускулни биопсии, разкриха важни механистични улики, подкрепящи метаболитната гъвкавост при хората, както е обобщено на Фигура 5. Трябва да продължат усилията за разпит на механизми и потенциални лечения за инсулинова резистентност и метаболитна гъвкавост, включително способността за окисляване на мастните киселини, основното затлъстяване, диабет тип 2 и свързаните с тях състояния.
Скелетните мускули преминават от по-високи нива на окисление на мастните киселини по време на сън/след абсорбционни условия към по-голямо окисление и съхранение на глюкоза след хранене и намалено окисление на мастните киселини. Мастната тъкан преминава от по-високи нива на липолиза към потискане на липолизата и съхранение на мазнини по време на гладуване към преход към хранене. От почивка до упражнения, скелетните мускули увеличават нивата на окисляване както на мастните киселини, така и на глюкозата, за да поддържат по-високи енергийни нужди, докато липолизата в мастната тъкан се засилва драстично.
Благодарности
Изказваме искрената си благодарност на д-р Дейвид Е. Кели и д-р Стивън Р. Смит, които дълбоко са оформили нашите мисли за метаболитната гъвкавост през последните 20 години. Бихме искали също да благодарим на много други, които са допринесли за изследванията и концепциите, подчертани в този преглед. И накрая, благодарим на д-р Елвис Карнеро за помощта му с данните и създаването на фигура за метаболитната гъвкавост, използвайки калориметрия на цялата стая. Авторите са подкрепени от безвъзмездни средства от Националните здравни институти и Американската асоциация по диабет.
Бележки под линия
Отказ от отговорност на издателя: Това е PDF файл на нередактиран ръкопис, който е приет за публикуване. Като услуга за нашите клиенти ние предоставяме тази ранна версия на ръкописа. Ръкописът ще бъде подложен на редактиране, набиране и преглед на полученото доказателство, преди да бъде публикуван в окончателния си вид. Моля, обърнете внимание, че по време на производствения процес могат да бъдат открити грешки, които биха могли да повлияят на съдържанието, и всички правни откази от отговорност, които се отнасят до списанието, се отнасят до.
- Диетата с високо съдържание на захар може да наруши метаболитното здраве и грижите на майката след бременност EurekAlert! Научни новини
- Храни с високо съдържание на фибри и здраве на храносмилателната система Горе-долу диета срещу болест
- Отдел за наследствени метаболитни заболявания по медицинска генетика Станфордска медицина
- Здравето е повече от липсата на болест, адекватното хранене е критична част от уравнението
- Бъбречно заболяване при деца Детска нефрология Здраве на херцог