Нашата група организира 3000+ Глобални конферентни събития всяка година в САЩ, Европа и Азия с подкрепата на още 1000 научни дружества и публикува 700+ списания с отворен достъп, които съдържа над 50000 видни личности, известни учени като членове на редакционния съвет.
Списания с отворен достъп печелят повече читатели и цитати
700 списания и 15 000 000 читатели всеки вестник получава 25 000+ читатели
Това четене е 10 пъти повече в сравнение с други абонаментни списания (Източник: Google Analytics)
- Редакционна
- J Nutr Diet 2018, том 1 (1): 1
Дата на получаване: 19 септември 2017 г./Приета дата: 10 януари 2018 г./Дата на публикуване: 15 януари 2018 г.
Редакционна
Човешката диета е сложна смес от взаимодействащи компоненти, които кумулативно влияят върху здравето [1]. Метаболизиращата се енергия на макроелементите (т.е. въглехидрати, протеини и липиди) е отговорна за по-голямата част от енергията в човешката диета. Микроелементите (т.е. минералите и витамините) играят централна роля в метаболизма и в поддържането на тъканната функция [2]. Метаболизмът обхваща всички биохимични процеси, използвани от организмите за синтезиране на структурни и функционални съставки и за получаване на енергия. Обикновено се разделя на анаболизъм, който включва биосинтеза на макромолекули като гликоген, протеини и липиди (напр. Триацилглицерол-TAG) и катаболизъм, който включва разграждането на макромолекулите до най-простите им предшественици: глюкоза, аминокиселини, глицерол и мастни киселини. Свободната енергия, отделена чрез катаболно разграждане - чрез аденозин трифосфат и никотинамид аденин дифосфат - се използва за задвижване на ендергоничните процеси на анаболната биосинтеза [3]. Въглехидратите (напр. Гликоген) представляват непосредствени енергийни запаси (черен дроб), а липидите (напр. TAG) представляват дългосрочни енергийни запаси (адипоцити) [4]. Протеините съставляват активната (функционална) клетъчна маса и са второстепенен източник на енергия [4].
Съществува и амфиболичен метаболизъм, така наречен за обслужване както на анаболни, така и на катаболни пътища. Ензимите (и техните субстрати) от този двупосочен метаболизъм остават по-добре изучени при прокариотни организми (бактерии) като Escherichia coli, чиято телеономия на някои щамове дава възможност за метаболитна гъвкавост, свързана главно с цикъла на лимонената киселина, известен също като трикарбоксилна киселина или цикъла на Кребс [9]. Други динамични аспекти на този жизненоважен метаболитен цикъл включват анаплероза и катаплероза; първият термин се отнася до презареждане на цикъла на Кребс, когато междинен продукт напусне митохондриите по време на биосинтетични събития, а вторият термин се отнася до обратната функция (т.е. отстраняване на натрупващите се аниони от цикъла на лимонената киселина) [10].
Фактът, че метаболизмът се среща на много етапи, медииран от множество ензимни субстрати и продукти (метаболити), мотивира термина междинен метаболизъм. Метаболизмът на макронутриентите е особено взаимосвързан [4]. Например, глюкозата може да се синтезира от лактат, глицерол и аминокиселини (напр. Аланин) (глюконеогенеза), но не и от мастни киселини [4]. За разлика от това, дихидроксиацетон фосфатът, използван за производството на глицерол-3-фосфат (G3P) за синтез на TAG, произлиза или от глюкоза по гликолитичния път (или по Embden-Meyerhof път), или от оксалоацетат чрез съкратена версия на глюконеогенезата, наречена глицеронегенеза [3]. Важно е, че както глюконеогенезата, така и глицеронеогенезата са катаплеротични пътища, тъй като те превръщат анионите от цикъла на лимонената киселина във фосфоенолпируват, който след това се използва за получаване на глюкоза или G3P [10].
Трябва да се подчертае, че глюкозата и FFA са най-важните енергийни субстрати за повечето организми (включително хората) и че междинният метаболизъм отразява предимството на тези горива. Освен това съществуването на метаболитни цикли като глюкоза-лактат (цикъл на Кори), глюкоза-мастна киселина (цикъл на Рандъл) и глюкоза-аланин (цикъл на Кахил) засилва тази идея.
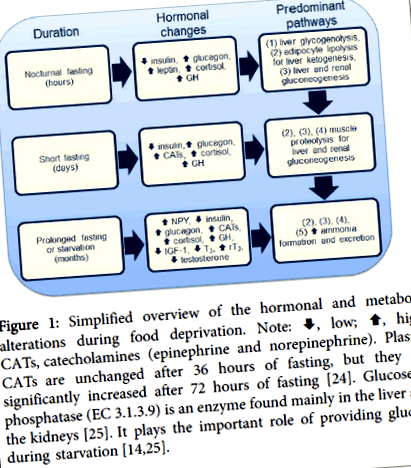
Фигура 1: Опростен преглед на хормоналните и метаболитни промени по време на лишаване от храна. Забележка:, ниско;, Високо; CATs, катехоламини (епинефрин и норепинефрин). Плазмените CAT са непроменени след 36 часа на гладно, но се увеличават значително след 72 часа на гладно [24]. Глюкоза-6-фосфатазата (EC 3.1.3.9) е ензим, открит главно в черния дроб и бъбреците [25]. Играе важната роля за осигуряване на глюкоза по време на глад [14,25].
Възможно е да се видят новите граници, до които е поставен метаболизмът от глад. Критичното заболяване представлява многообразна клетъчна обида с увреждане, предизвикано от хипоксия, хипоперфузия и възпаление, а премахването на клетъчните увреждания от автофагия е от съществено значение за възстановяването [26]. Автофагията е еволюционно запазен процес, който разгражда клетъчните компоненти, за да възстанови енергийната хомеостаза при ограничени хранителни условия като глад [27]. По този начин гладуването насърчава автофагията [28]. Напротив, потискащите ефекти от хранителните вещества рано по време на критично заболяване могат да компрометират такива системи за отстраняване на щети [26]. Все още не е напълно изяснено как се регулира тази гладна автофагия на ниво цялото тяло [27]. Въпреки това анаболните хормони (напр. Инсулин и IGF-1) и катаболните хормони (напр. Глюкагон и CAT) са значими регулатори на автофагията [29].
Препратки
- Yetley ElA, MacFarlane AJ, Greene-Finestone LS, Garza C, Ard JD, et al. (2017) Опции за базиране на диетични референтни дози (DRI) на крайни точки за хронични заболявания: доклад от съвместна спонсорирана от САЩ/Канада работна група. Am J Clin Nutr 105: 249S-285S.
- Shenkin A (2006) Микронутриенти в здравето и болестите. Postgrad Med J 82: 559-567.
- Voet D, Voet JG (2011) Биохимия. John Wiley & Sons, Inc., Hoboken.
- Campbell I (2017) Междинен метаболизъм. Anaesth Intensive Care Med 18: 147-149.
- Messini CI, Malandri M, Anifandis G, Dafopoulos K, Georgoulias P, et al. (2017) Субмаксималните дози грелин не инхибират нивата на гонадотропин, но стимулират секрецията на пролактин при жени в постменопауза. Clin Endocrinol 87: 44-50.
- Alberti KGMM, Batstone GF, Foster KJ, Johnston DG (1980) Относителна роля на различни хормони в медиирането на метаболитния отговор на нараняване. J Parenter Enteral Nutr 4: 141-146.
- Kang SG, Lee HJ, Park YM, Choi JE, Han C, et al. (2008) Възможна връзка между - 2548A/G полиморфизма на лептиновия ген и индуцираното от оланзапин наддаване на тегло. Prog Neuropsychopharmacol Biol Psychiatry 32: 160-163.
- Van den Berghe G, De Zegher F, Bouillon R (1998) Остра и продължителна критична болест като различни невроендокринни парадигми. J Clin Endocrinol Metab 83: 1827-1834.
- Sanwal BD (1970) Алостерични контроли на амфиболичните пътища в бактериите. Bacteriol Rev 34: 20-39.
- Hanson RW, Hakimi P (2008) Роден да бяга; историята на PEPCK-Cmus мишката. Biochimie 90: 838-842.
- Kayaba M, Park I, Iwayama K, Seya Y, Ogata H, et al. (2017) Енергийният метаболизъм се различава между етапите на съня и започва да се увеличава преди пробуждането. Metab Clin Exp 69: 14-23.
- Chowdhury SA, Орсков ER (1994) Последици от гладуването върху енергийния метаболизъм и оценката на фуражите при преживните животни. J Anim Feed Sci 3: 161-169.
- Kraus WE, Slentz CA (2009) Обучение за упражнения, регулиране на липидите и действие на инсулина: заплетена мрежа от причина и следствие. Затлъстяване 17: S21-S26.
- Basdevant A, Tchobroutsky G (1987) Запаси énergétiques¾ конституция¾ мобилизация. В: Traité de médecine. 2-ро издание. Flammarion Médecine-Sciences: Париж.
- Camandola S, Mattson MP (2017) Мозъчен метаболизъм в здравето, стареенето и невродегенерацията. EMBO J 36: 1474-1492.
- Kerndt PR, Naughton JL, Driscoll CE, Loxterkamp DA (1982) Гладуване: история, патофизиология и усложнения. West J Med 137: 379-399.
- Longo VD, Mattson MP (2014) Гладуване: молекулярни механизми и клинични приложения. Cell Metab 19: 181-192.
- Søndergaard E, Johansen RF, MD Jensen, Nielsen S (2017) Метаболизъм след хранене VLDL-TG при диабет тип 2. Метаболизъм 75: 25-35.
- Laforenza U, Bottino C, Gastaldi G (2016) Функция на акваглицеропорин при бозайници в метаболизма. Biochim Biophys Acta 1858: 1-11.
- Cahill Jr GF (2006) Горивен метаболизъм при глад. Annu Rev Nutr 26: 1-22.
- Wang T, Hung CCY, Randall DJ (2006) Сравнителната физиология на лишаването от храна: от празника до глада. Annu Rev Physiol 68: 223-251.
- Martinez B, Ortiz RM (2017) Регулация на щитовидните хормони и инсулинова резистентност: прозрения от животни, естествено адаптирани към гладуването. Физиология 32: 141-151.
- Hennemann G, Docter R, Krenning EP (1988) Причини и ефекти на синдрома с нисък Т3 по време на лишаване от калории и нетиреоидни заболявания: преглед. Acta Med Austriaca 15: 42-45.
- Webber J, Macdonald IA (1994) Сърдечно-съдовите, метаболитните и хормоналните промени, съпътстващи острото гладуване при мъжете и жените. Br J Nutr 71: 437-447.
- Van Schaftingen E, Gerin I (2002) Глюкозо-6-фосфатазната система. Biochem J 362: 513-532.
- Van den Berghe G (2012) Интензивна инсулинова терапия в интензивното отделение - съвместяване на доказателствата. Nat Rev Endocrinol 8: 374-378.
- Mans LA, Cano LQ, Van Pelt J, Giardoglou P, Keune WJ, et al. (2017) Туморният супресор LKB1 регулира индуцираната от глад автофагия при системен метаболитен стрес. Sci Rep 7: 7327.
- Marik PE (2016) Полезно ли е ранното гладуване за тежко болния пациент? Curr Opin Clin Nutr Metab Care 19: 155-160.
- Sinha RA, Singh BK, Yen PM (2017) Взаимна кръстосана препратка между автофагична и ендокринна сигнализация в метаболитната хомеостаза. Endocr Rev 38: 69-102.
Позоваване: Moacir Couto de Andrade Júnior (2017) Метаболизъм по време на гладуване и глад: Разбиране на основите, за да се видят нови граници. J Nutr Diet 1: e102.
Изберете езика, който ви интересува, за да видите общото съдържание на интересуващия ви език
- Мнение Вие го наричате глад
- Перорален прием на храна срещу гладуване при следоперативна панкреатична фистула след дистална панкреатектомия
- Странични ефекти от гладуването за три дни LEAFtv
- Признаци на периодично гладуване е опасно или нездравословно за вас - Business Insider
- Регулиране на липидния метаболизъм чрез наличност на енергия роля за централната нервна система -