Джин Ю
1 Катедра по фармацевтични науки, Фармацевтичен колеж, Университет на Южна Флорида, Тампа, FL 33620, САЩ; ude.fsu.htlaeh@uynij (J.Y.), ude.fsu.htlaeh@uhzgnoh (H.Z.), ude.fsu.htlaeh@sirehat (S.T.), ude.fsu.htlaeh@ydnomw (W.L.M.)
Хонг Жу
1 Катедра по фармацевтични науки, Фармацевтичен колеж, Университет на Южна Флорида, Тампа, FL 33620, САЩ; ude.fsu.htlaeh@uynij (J.Y.), ude.fsu.htlaeh@uhzgnoh (H.Z.), ude.fsu.htlaeh@sirehat (S.T.), ude.fsu.htlaeh@ydnomw (W.L.M.)
Саид Тахери
1 Катедра по фармацевтични науки, Фармацевтичен колеж, Университет на Южна Флорида, Тампа, FL 33620, САЩ; ude.fsu.htlaeh@uynij (J.Y.), ude.fsu.htlaeh@uhzgnoh (H.Z.), ude.fsu.htlaeh@sirehat (S.T.), ude.fsu.htlaeh@ydnomw (W.L.M.)
Уилям Л. Понеделник
1 Катедра по фармацевтични науки, Фармацевтичен колеж, Университет на Южна Флорида, Тампа, FL 33620, САЩ; ude.fsu.htlaeh@uynij (J.Y.), ude.fsu.htlaeh@uhzgnoh (H.Z.), ude.fsu.htlaeh@sirehat (S.T.), ude.fsu.htlaeh@ydnomw (W.L.M.)
Стивън Пери
2 NutriFusion®, LLC, Неапол, FL 34109, САЩ; moc.tnilaesnoc@yrreps
Марк С. Кинди
1 Катедра по фармацевтични науки, Фармацевтичен колеж, Университет на Южна Флорида, Тампа, FL 33620, САЩ; ude.fsu.htlaeh@uynij (J.Y.), ude.fsu.htlaeh@uhzgnoh (H.Z.), ude.fsu.htlaeh@sirehat (S.T.), ude.fsu.htlaeh@ydnomw (W.L.M.)
3 Катедри по молекулярна медицина, молекулярна фармакология, физиология и патология и клетъчна биология и неврология, Медицински колеж, Университет на Южна Флорида, Тампа, FL 33620, САЩ
4 Медицински център Джеймс А. Хейли, VA, Тампа, FL 33612, САЩ
Болница за деца 5 Shriners, Тампа, FL 33612, САЩ
Свързани данни
Резюме
1. Въведение
Травматичното увреждане на мозъка (TBI) е следствие от външно въздействие, което задейства пътища, допринасящи за патологични промени в мозъка, водещи до промени в мозъчната функция [1]. TBI е сериозен здравен проблем с повече от 1,8 милиона американци, засегнати всяка година [2]. Честите причини за TBI или сътресения не са ограничени до наранявания, свързани с битки, но най-често се случват от инциденти, свързани с сблъсъци с моторни превозни средства, падания, спорт и нападения [3]. TBI се появява, когато внезапен удар кара мозъка да удари черепа. Резултатът може да бъде лека, умерена или тежка мозъчна травма и признаците и симптомите могат да бъдат трудно разпознаваеми [4,5]. Поддържането на мозъчно сътресение или TBI може да доведе до промени в когнитивните способности и контрол на емоциите, мобилността, речта и сетивата [6]. Недиагностициран и нелекуван, TBI може да окаже огромно влияние върху начина, по който човек мисли и действа, и върху неговото или нейното психично здраве.
Към днешна дата няма добри лечения за TBI. Въпреки че терапията за това вредно разстройство все още остава неуловима, в транслационните изследвания са положени огромни усилия за разбиране и управление на клиничните симптоми след TBI [7,8]. Редица проучвания са свързани с хранителни добавки както за профилактика, така и за лечение на мозъчни синдроми [9,10,11]. Употребата на омега-3 полиненаситени мастни киселини (ω-3 PUFAs) е широко изследвана за исхемично увреждане, болест на Алцхаймер и Паркинсон, както и TBI [12]. Доказано е, че хранителните добавки с ω-3 PUFAs при хората са изключително безопасни и могат да се консумират в продължение на дълги периоди профилактично. В допълнение, храненето изглежда е важен предиктор за смъртта поради TBI [13]. Заедно с профилактиката на артериална хипотония, хипоксия и вътречерепна хипертония, това е една от малкото терапевтични интервенции, които могат пряко да повлияят на резултатите от TBI. След TBI се препоръчва ранно започване на хранене.
GrandFusion ® (GF) са смеси от плодове и зеленчуци, значително подобрени с витамини и хранителни вещества, които са в състояние да отслабят степента на мозъчна исхемия и да ограничат няколко параметъра на инсулт, като възпалителни маркери и реактивни кислородни видове и поведенчески промени [14] . Освен това, GF смесите могат да подобрят паметта и обучението при възрастни плъхове и да подобрят физическата активност, медиирана от антиоксидантни ензими и сигнални пътища [15,16]. Предишни изследвания показват, че GF има противовъзпалителни, антиоксидантни, невропротективни и неврогенни свойства [14,15].
В настоящото проучване нашата цел беше да определим влиянието на профилактичните диети, богати на зеленчуци и плодове, върху резултатите, свързани с черепно-мозъчна травма (TBI). Мишките бяха хранени с диети, обогатени с плодове и зеленчуци в продължение на 2 месеца преди и след това подложени на TBI. Целта на проучването е да се определи дали наличието на тези нутрицевтични и фитохимикали може да ограничи степента на нараняване след TBI. Резултатите разкриха, че тези диети са успели да смекчат щетите, причинени от TBI. Промени в поведението, възпаление, обем на лезията и проапоптотични маркери бяха изследвани при мишки, хронично изложени на диети. И накрая, демонстрирахме, че добавянето на мишки с подобрените диети ограничава степента на нараняване, намалява възпалението и променя пътищата, критични за процеса на нараняване. Тези данни предполагат, че тези профилактични диети могат да повлияят на изразените промени, наблюдавани при TBI, за да забавят процеса и да подобрят резултата.
2. Материали и методи
2.1. Експерименти с животни
Мишките C57BL/6 (Jackson Laboratory, Bar Harbor, ME, USA), с тегло от 22 до 25 g, получиха свободен достъп до храна и вода преди експеримента. Животните (100 мъжки мишки) са били на възраст 10 до 12 седмици в началото на експеримента и са били поддържани на 12-часов цикъл светлина/тъмнина (светлините са включени в 7:00 сутринта). Всички животни бяха рандомизирани в различните групи. Преди TBI, животните са били хранени в продължение на 2 месеца с нормална диета или нормална диета с
2% добавка към различните материали NF-216 (GrandFusion – Fruit and Veggie # 1 Blend), NF-316 (GrandFusion-Fruit # 2 Blend), и NF-416 (GrandFusion-Vegetable # 3 Blend) [14,15, 16]. Вижте таблица S1 за състава на добавките. Животните се дават с добавките ежедневно, веднъж на ден. Добавките GrandFusion бяха приготвени от NutriFusion, LLC (www.nutrifusion.com). Средният прием на храна е 3,75 ± 0,07 g/ден/мишка, а средната консумация на диети е 0,08 ± 0,005 g/ден/мишка. Всички проучвания бяха одобрени от Институционалния комитет за грижи и употреба на животните към Медицинския университет в Южна Каролина и Медицинския център по въпросите на ветераните. Това проучване се придържа към Ръководството за грижа и употреба на лабораторни животни, разработено от Службата за хуманно отношение към лабораторните животни.
2.2. ТБИ Травма
2.3. Анализ на активността на катепсин В
Активността на мозъчния катепсин В се измерва 2 часа след травма, като се използва комплект за флуорометричен анализ, както е описано от производителя (ab65300; Abcam, Cambridge, MA, USA). Накратко, тъканите бяха измити два пъти в ледено студен фосфатно буфериран физиологичен разтвор и след това хомогенизирани в екстракционен буфер, както е описано от производителя. След 10-минутна инкубация върху лед, екстрактът се центрофугира при 10 000 g в продължение на 5 минути и 50 μL супернатант се смесва с равен обем 2 х реакционен буфер и 2 μL субстрат в 96-ямкова микроплака. Плаките се държат на тъмно при 37 ° С в продължение на 1 час и се записва флуоресценция, като се използва FLUOstar Optima четец за плочи (BMG LABTECH GmbH, Ортенберг, Германия). Концентрацията на протеин се определя чрез метода за анализ на бицинхонинова киселина (Bio-Rad, Hercules, CA, USA). Активността на катепсин В се измерва в три екземпляра и се изразява като флуоресцентни единици/mg протеин. За определяне на ензимната активност изолирахме района на травма за анализ.
2.4. Анализи на катепсин В и Bax Western Blot
Мозъчните нива на катепсин В, Bax и актин (контролен) протеин бяха определени 24 часа след фалшива операция или TBI, тъй като е известно, че нивата на катепсин B и Bax протеин са значително повишени по това време след TBI [17]. Относителните нива на катепсин В, Bax и актин в супернатантната фракция от мозъчния екстракт се определят чрез Western blot (поликлонални антитела: Cathepsin B, sc-13985; Bax, sc-526; β-актин, sc-130657; Santa Cruz Биотехнологии, Санта Круз, Калифорния, САЩ), както е описано по-рано [18]. Относителната интензивност на Western blot ленти беше оценена чрез денситометрия в три екземпляра за всяка проба. Денситометричният анализ беше направен с помощта на софтуера IQTL (Imagequant TL) (GE Life Sciences, Piscataway, NJ, САЩ). За проучвания на протеини, цялата лезирана площ е събрана за Western blot анализ. При контролни или фалшиви животни се добива подобен регион.
2.5. ELISA анализ
За количествен анализ на цитокини се използва ELISA за измерване на нивата на тумор некротизиращ фактор-α (TNF-α), интерлевкин-1β (IL-1β) или трансформиращ растежен фактор-β (TGF-β) в мозъчната тъкан [ 19]. Цитокините се екстрахират от мозъка на мишки, както следва: замразени хемибрайни се поставят в тъкан за хомогенизиране на буфер, съдържащ коктейл за инхибитор на протеаза (Sigma, St Louis, MO, USA) 1: 1000 разреждане непосредствено преди употреба и се хомогенизират с помощта на политрон. Суспензиите на тъканни проби се разпределят в аликвотни части и се замразяват в течен азот за по-късни измервания. След това бяха използвани комплекти за инвитроген ELISA, съгласно указанията на производителя (Carlsbad, CA, USA).
2.6. Rotarod Assay
Използван е автоматизиран ротарод (San Diego Instruments, San Diego, CA, USA) за оценка на ефектите върху вестибуломоторната функция на мишки след травма [20]. В деня, предхождащ нараняването, мишките претърпяха две последователни опити за кондициониране при зададена скорост на въртене (16 оборота в минута) в продължение на 60 секунди, последвани от три допълнителни опити с ускоряващи скорости на въртене. Средното време за падане от въртящия се цилиндър в последните три изпитания е записано като базова латентност. След нараняване мишките се подлагаха на последователни ежедневни тестове с три опита за ускоряване на скоростта на въртене (интервал между опитите от 15 минути). Записана е средна латентност за падане от пръчката. Мишките, неспособни да хванат въртящия се прът, получават латентност от 0 сек. Експериментаторът бил заслепен по отношение на групите животни.
2.7. Тест за окачване на тел
Устройството за окачване на тел се състои от пръчка от неръждаема стомана (50 cm; диаметър 2 mm), подпряна на две вертикални опори и издигната на 37 cm над равна повърхност. Този тест е извършен, както е описано по-рано от изследователи, заслепени за експерименталните групи [21].
2.8. Тест за ходене по решетка и крак
Тестът за ходене по решетка е чувствителен към дефицити в низходящия двигателен контрол [22]. Всяка мишка беше поставена върху решетъчен под от неръждаема стомана (20 × 40 cm с размер на окото 4 cm 2), издигнат на 1 m над пода. За видеозаписан 1-минутен период на наблюдение се отчита общият брой стъпки. Броят грешки при грешки в краката (когато животните са поставили предния крайник или задния крайник, така че да е паднал през решетката) също се записва за 1 минута.
2.9. Тест на цилиндъра и тест на водния лабиринт на Морис
Тестът на цилиндъра и тестовете Morris Water Maze бяха проведени, както беше описано по-рано от изследователи, заслепени за експерименталните групи [23,24]. При теста на цилиндъра бяха записани общо 20 движения по време на 10-минутния тест. Крайният резултат беше определен въз основа на следната формула:
Този тест оценява асиметрията на използване на предните крайници за преместване на тежестта по време на вертикално изследване и осигурява висока надеждност дори при неопитни оценители. Понякога мишките с големи дефицити не се движеха достатъчно често, за да получат достатъчен брой вертикални движения. Обикновено тези мишки се възстановяват навреме, когато е извършен тестът. За да се избегне пристрастие, тези мишки не са отбелязани, докато не могат да извършат теста. Тези тестове бяха проведени от изследователи, заслепени за изследваните групи.
2.10. Анализ на обема на мозъчните лезии
Хистологичният анализ е настъпил в последния ден от поведенческия анализ (ден 35 след TBI мишки), за да позволи корелация на поведението с патологията [17]. Мишките бяха анестезирани и транкардиално перфузирани с физиологичен разтвор и 10% буфериран разтвор на формалин фосфат, съдържащ 4% параформалдехид (PFA). Мозъците бяха отстранени, фиксирани в PFA за 24 часа и защитени с 30% захароза. Замразените мозъчни секции (30 μm) бяха нарязани на криостат и монтирани върху стъклени пързалки. Всяка четвърта секция беше обработена за имунохистохимичен анализ, започвайки от произволна начална точка преди увредената зона. Тридесетмикронни срезове бяха оцветени с хематоксилин и еозин (H&E), дехидратирани и монтирани за анализ. Обемът на лезиите във всяка секция се определя с помощта на компютърно подпомогната система за анализ на изображения, състояща се от компютър Power Macintosh (Apple Inc., Купертино, Калифорния, САЩ), оборудван с QuickCapture грайферна карта, CCD камера на Hitachi (Hitachi Kokusai Electric Inc., Токио, Япония), монтиран на микроскоп на Olympus (Olympus, Tokyo, Japan), и стойка за фотоапарат. Изображенията бяха заснети и общата площ на щетите беше определена по раздели, като се използва софтуер за анализ на изображения на Националния здравен институт (NIH) (v. 1.55; NIH, Bethesda, MD, USA), проведен от един оператор, заслепен за статуса на лечение за анализи на всички измервания.
2.11. Определяне на плътността на невроналните клетки
Преброяването на клетките беше проведено с помощта на светлинен микроскоп Nikon Eclipse E800 (Nikon Imaging Japan Inc., Токио, Япония), свързан със софтуерния пакет StereoInvestigator (MicroBrightField, Williston, VT, USA) [17]. Плътността на невроните се изчислява като броя на оцветените неврони на обем хипокампус, определен с помощта на метода на оптичния фракционер, както е описано по-рано [25,26,27]. Преди преброяване всички слайдове бяха кодирани, за да се избегне пристрастие. Както беше определено от StereoInvestigator, три секции (40 μm), разположени на осем секции един от друг по протежение на хипокампалната формация, бяха избрани чрез систематично произволно вземане на проби. На всеки участък е очертана хипокампалната област. Бройха се само клетки в рамките на преброяващата рамка или припокриващи дясната или горната граница на преброяващата рамка и за които ядрата са на фокус, докато фокусират надолу през височината на дисектора. Генерираната тъкан и H&E, маркирани за анализ на обема на мозъчните лезии, бяха използвани за определяне на плътността на невронните клетки.
2.12. Статистически анализ
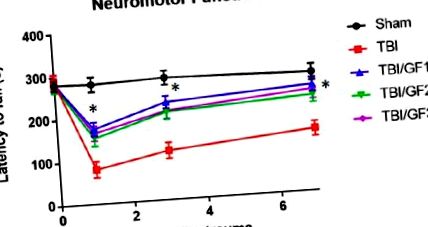
Експериментите се състоят от по 10 мишки във всяка група. Статистически анализи и графики на данни бяха проведени с помощта на компютърен софтуер, предназначен за научен анализ на данни (GraphPad Prism 4; GraphPad Software Inc., La Jolla, CA, USA). Количествените данни бяха показани като средна стойност със стандартна грешка на средната стойност и разлики между средните стойности, определени чрез еднопосочен дисперсионен анализ (p Фигура 1). Преди нараняването всички групи са имали подобни периоди на латентност по време (281,2 ± 3,7 сек). Фалшиви мишки поддържат невромоторна функция по време на тестването. На ден 1 след травма, само при TBI мишките са имали времена на латентност 84,5 ± 7,3, което е 70% по-кратко време от фалшивите контроли. TBI мишките имат по-лоша невромоторна функция по отношение на контролите. TBI мишките показват бавно възстановяване до около 136,7 ± 9,4 сек. Моторните характеристики бяха оценени за мишки, хранени с GF диети (GF1, GF2 и GF3). Като цяло, мишките на GF диети показват значително по-малко невромоторна дисфункция и се възстановяват по-бързо, отколкото мишките с TBI. На 1-ви ден времената на латентност бяха 174,9 ± 16,1 (GF1), 153,5 ± 18,0 (GF2) и 164,7 ± 17,4 (GF3) секунди, като мишките с TBI имат значително 45 до 52% по-кратко време от това на третираните животни. Времето на латентност в третия и седмия ден за лекуваните мишки е значително по-добро от мишките само с TBI. Важно е, че тези данни показват, че диетите, обогатени с плодове и зеленчуци преди нараняване, значително намаляват тежестта на невромоторната дисфункция от TBI, с почти пълно възстановяване на 7 дни след TBI.
Ефекти от диетите GrandFusion ® (GF) върху невромоторната дисфункция. Невромоторната дисфункция се оценява в различни часови точки през седмицата след травматично мозъчно увреждане (TBI), като се използва ротарод анализ, като се измерва латентността към падане, като по-краткото време отразява по-голяма дисфункция. Показани са времената на латентност за падане за фалшивите, TBI и TBI плюс GF диетични мишки. Мишките бяха хранени с нормална диета или диети, допълнени с 2% GF. Всяка точка представлява средно +/− SD (n = 10 за времева точка). * p Фигура 2). Както се вижда на фигурата, има значително подобрение в когнитивните показатели след CCI за всички групи мишки. Обратно, мишките, обогатени с GF, показват по-малко когнитивна дисфункция от тези на редовна диета. Дефицитите в паметта след CCI при мишки на редовна диета се изразяват като по-малко време, прекарано в целевия квадрант. В допълнение, нямаше разлики в скоростта на плуване, което да предполага, че няма ефект върху подобрени или забавени физически параметри, но отразява преки промени в когнитивните функции.
- Център за превод на знания за системи за спастичност и травматично мозъчно нараняване (MSKTC)
- Храненето може да помогне за лечение на травматични мозъчни наранявания
- Хранене и възстановяване от мозъчни наранявания Ernest Health
- Оксидативен метаболизъм, апоптоза и перинатална мозъчна травма - Тейлър - 1999 - Мозъчна патология -
- Неоперативно лечение на увреждане на панкреаса - ScienceDirect