Хуей Чен
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
2 Център за здравни технологии, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Jane P. M. Ng
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Yi Tan
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Кристин Макграт
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
2 Център за здравни технологии, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Дейвид П. Бишоп
3 Училище по математически и физически науки, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Брайън Оливър
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
2 Център за здравни технологии, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Yik Lung Chan
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Майкъл Б. Корти
4 Институт за наномащабни технологии, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Брус К. Милторп
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
2 Център за здравни технологии, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Стела М. Валенсуела
1 Екип за молекулярни биологии, Училище за науки за живота, Факултет по природни науки, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
2 Център за здравни технологии, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
4 Институт за наномащабни технологии, Технологичен университет Сидни, Сидни, NSW 2007 Австралия
Свързани данни
Всички данни, генерирани или анализирани по време на това проучване, са включени в тази публикувана статия [и съответния допълнителен файл].
Резюме
Заден план
Затлъстяването е висок риск от множество метаболитни нарушения поради прекомерен прилив на енергия, глюкоза и липиди, често от западна диета. Нискостепенното възпаление играе ключова роля за прогресирането на такива метаболитни нарушения. Противовъзпалителното свойство на златните съединения се използва при лечението на ревматоиден артрит в клиниката. По-рано установихме, че наночастиците от чисто злато (AuNPs, 21 nm) също притежават противовъзпалителни ефекти върху ретроперитонеалната мастна тъкан след интраперитонеално инжектиране, чрез понижаване на регулаторния фактор на туморната некроза (TNF) α. Дали обаче такъв ефект може да промени риска от метаболитни нарушения при затлъстяване не е добре проучен. В проучването са използвани мишки C57BL/6, хранени с диети с високо съдържание на мазнини (HFD, 43% като мазнини), които са били лекувани ежедневно с AuNPs [ниска (HFD-LAu) или висока (HFD-HAu) доза] чрез интраперитонеална инжекция в продължение на 9 седмици. В in vitro проучването RAW264.7 макрофаги и 3T3-L1 адипоцити са култивирани с ниски и високи концентрации на AuNPs самостоятелно или заедно.
Резултати
Хранените с HFD мишки показват значително увеличение на мастната маса, непоносимост към глюкоза, дислипидемия и чернодробна стеатоза. Групата HFD-LAu показва 8% намаление на телесното тегло, подобрена хиперлипидемия и нормален глюкозен толеранс; докато групата HFD-HAu имаше 5% намаление на телесното тегло със значително подобрение на тяхната непоносимост към глюкоза и хиперлипидемия. Основният механизъм може да се отдаде на намаляване на мастната и чернодробната локална продукция на възпалителни цитокини, напр. TNFα. In vitro проучвания на съвместно култивирани миши RAW264.7 макрофаги и 3T3-L1 адипоцити подкрепят този предложен механизъм.
Заключение
AuNP демонстрират обещаващ профил за потенциално управление на свързаните със затлъстяването нарушения на глюкозата и липидите и са полезни като изследователски инструмент за изследване на биологични механизми.
Електронен допълнителен материал
Онлайн версията на тази статия (10.1186/s12951-018-0338-1) съдържа допълнителен материал, който е достъпен за оторизирани потребители.
Заден план
Затлъстяването е важен рисков фактор за множество метаболитни нарушения, включително непоносимост към глюкоза и хиперлипидемия. Настоящият глобален скок на затлъстяването отчита зашеметяващото 800% увеличение на търсенето на хирургични процедури за отслабване през последното десетилетие, като средство за контрол на тези метаболитни нарушения [1]. Това увеличение се дължи и на разочароващо ниската степен на успех на лекарствата и интервенциите за отслабване, както и на трудностите, с които се сблъскват хората, опитващи се да поддържат идеалното телесно тегло след първоначалната загуба на тегло. Например, в скорошно проучване е доказано, че последното одобрено инжекционно лекарство за отслабване Liraglutide (Saxenda) предизвиква
6% от общата загуба на телесно тегло след 56 седмици лечение [2]. Този ефект на отслабване обаче изисква ежедневно спазване на строга нискокалорична диета и постоянна подкрепа от страна на диетолозите, което прави прилагането му трудно за постигане извън строго контролирана среда [2]. Следователно все още остава спешна и нарастваща нужда от ефективни стратегии за справяне с глобалната пандемия на затлъстяването. Тук представяме интригуващи доказателства, че златните наночастици (AuNP) могат да служат като нов терапевтичен агент при лечението и контрола на затлъстяването и свързаните с него глюкозни и липидни нарушения.
Вече има исторически приоритет за използването и прилагането на насипно злато и златни соли в рамките на клиничната практика [3]. Сега става очевидно, че AuNP имат подобни терапевтични възможности [4]. Наноматериалите са широко прилагани в медицината като биохимични сензори, контрастни вещества в изображенията и средства за доставка на лекарства, революционизиращи настоящото лечение и диагностика на заболяването [4]. Функцията и токсичността на AuNP обаче се различават по същество в зависимост от размера и формата с AuNP, по-големи от 15 nm, сравнително нетоксични [5].
Въпреки че противовъзпалителното свойство на насипно злато и AuNPs е клинично използвано за лечение на ревматоиден артрит [3], инжекционният AuNP препарат не е докладван за управление на затлъстяването и метаболитните нарушения при затлъстяване. Следователно, в настоящото проучване ние IP инжектирахме AuNP в мишки, хранени с високомаслена диета (HFD) в продължение на 9 седмици, за да изследваме ефекта върху натрупването на мазнини и метаболитните нарушения, свързани със затлъстяването. В допълнение, нашите in vitro проучвания изследват прякото въздействие на AuNP върху взаимодействията на адипоцити и макрофаги. Знанията, получени от това проучване, ще послужат за вдъхновение на нови, оригинални и по-ефективни терапевтични подходи, които включват директно насочване на вътреклетъчните пътища в адипоцитите и/или макрофагните клетки.
Методи
Експерименти с животни
маса 1
Антропометрия на мишки след 9 седмици лечение с HFD и AuNP
| Първоначално телесно тегло (g) | 20,2 ± 0,3 | 20,2 ± 0,3 | 20,3 ± 0,2 | 20,2 ± 0,3 |
| Крайно телесно тегло (g) | 27,7 ± 0,3 | 37,5 ± 1,2 * | 34,5 ± 0,8 * † | 35,8 ± 0,6 * |
| Енергиен прием (kJ/ден) | 44,9 ± 0,6 | 48,4 ± 1,4 | 50,5 ± 1,4 * | 52,3 ± 1,4 * † |
| Сърце (g) | 0,135 ± 0,002 | 0,145 ± 0,004 | 0,138 ± 0,004 | 0,141 ± 0,004 |
| Сърце (%) | 0,49 ± 0,01 | 0,40 ± 0,01 * | 0,39 ± 0,02 * | 0,40 ± 0,01 * |
| Бъбрек (g) | 0,165 ± 0,004 | 0,192 ± 0,005 * | 0,179 ± 0,004 * | 0,188 ± 0,005 * |
| Бъбрек (%) | 0,59 ± 0,01 | 0,51 ± 0,02 * | 0,49 ± 0,02 * | 0,53 ± 0,02 * |
| Черен дроб (g) | 1,34 ± 0,03 | 1,86 ± 0,12 * | 1,49 ± 0,03 * † | 1,54 ± 0,04 * † |
| Черен дроб (%) | 4,86 ± 0,08 | 5,03 ± 0,12 | 4,27 ± 0,07 * † | 4,30 ± 0,10 * † |
| Ретроперитонеална мазнина (g) | 0,097 ± 0,006 | 0,761 ± 0,054 * | 0,652 ± 0,044 * | 0,616 ± 0,048 * † |
| Ретроперитонеална мазнина (%) | 0,35 ± 0,02 | 2.01 ± 0.10 * | 1,86 ± 0,11 * | 1,77 ± 0,09 * † |
| Мезентериална мазнина (g) | 0,372 ± 0,018 | 0,939 ± 0,075 * | 0,741 ± 0,060 * † | 0,691 ± 0,029 * † |
| Мезентериална мазнина (%) | 1,35 ± 0,06 | 2,46 ± 0,14 * | 2,07 ± 0,28 * † | 1,97 ± 0,07 * † |
| Епидидимална мазнина (g) | 0,405 ± 0,013 | 2.029 ± 0.19 * | 1,77 ± 0,12 * | 1,80 ± 0,09 * |
| Епидидимална мазнина (%) | 1,43 ± 0,06 | 5,38 ± 0,35 * | 5,07 ± 0,14 * | 4,98 ± 0,19 * |
| Плазмен инсулин (ng/ml) | 1,05 ± 0,12 | 1,09 ± 0,12 | 1,44 ± 0,21 * † | 1,11 ± 0,05 |
| Плазма NEFA (n m) | 2,54 ± 0,16 | 4,51 ± 0,54 * | 2,9 ± 0,24 † | 3,14 ± 0,35 † |
| Плазмен холестерол (m m) | 6,24 ± 0,31 | 11,14 ± 0,36 * | 9,40 ± 0,29 * † | 9,46 ± 0,41 * † |
| Плазмен триглицерид (m m) | 0,75 ± 0,05 | 0,86 ± 0,05 | 0,67 ± 0,04 † | 0,69 ± 0,05 † |
| Чернодробен триглицерид (m m/mg) | 0,023 ± 0,005 | 0,124 ± 0,019 * | 0,139 ± 0,007 * | 0,145 ± 0,010 * |
| Плазмен ALT (U/L) | 17,3 ± 6,2 | 55,9 ± 13 * | 25,5 ± 6,9 † | 26,3 ± 2,4 † |
| Плазма AST (U/L) | 6,33 ± 2,16 | 31,4 ± 7,1 * | 16,9 ± 3,9 † | 12,1 ± 2,2 † |
Данните са изразени в средна стойност ± S.E.M. Данните бяха анализирани с помощта на еднопосочен ANOVA, последван от post hoc тестове на Bonferroni
n = 20/група за антропометрични маркери; n = 8/група за плазмени концентрации на инсулин, NEFA, холестерол, триглицериди и чернодробни триглицериди; n = 6/група за концентрация на ALT и AST в плазмата
* P † P ® сонда/грундове (Допълнителен файл 1: Таблица S1, Life Technologies, Калифорния, САЩ) и SYBR ® Зелени премиери (Допълнителен файл 1: Таблица S2, Bio-Rad, Калифорния, САЩ) [22] бяха използвани за PCR в реално време (Eppendorf Realplex 2, Хамбург, Германия). Гените от интерес са нормализирани спрямо домашния ген 18s rRNA (Допълнителен файл 1: Таблица S1). Като калибратор е зададена средната стойност на контролата, спрямо която всички останали проби се изразяват като кратна разлика.
Имунохистохимия
Формалин, фиксирани проби от черен дроб и коремна мазнина (n = 5) се влагат в парафин и се разделят (4 µm). За изследване на F4/80 позитивни клетъчни срезове бяха инкубирани със заешки антимиши F4/80 (Abcam, Cambridge, UK) първични антитела и визуализирани с помощта на хрянова пероксидазна анти-заешка Envision система (Dako Cytochemistry, Токио, Япония). След това срезовете бяха оцветени с хематоксилин. Три изображения от всеки раздел бяха заснети и използвани за анализ. Клетките, експресиращи F4/80, бяха преброени и изразени като процент от общия брой на клетките за общия брой ядра на пробата и броя на ядрата за всяко поле.
Статистически анализ
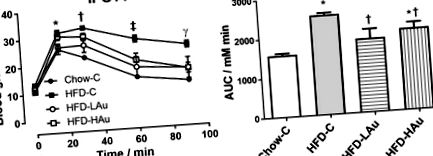
Резултатите са изразени като средна стойност ± стандартна грешка на средната стойност (S.E.M). Данните бяха анализирани с помощта на еднопосочен ANOVA, последван от post hoc тестове на Bonferroni (Statistica 10. StatSoft Inc., ОК, САЩ), ако обикновено се разпределят. Ако данните не са били нормално разпределени, те са били трансформирани, за да се постигне нормалност на разпространението, преди да бъдат анализирани. Нивата на глюкозата по време на IPGTT бяха анализирани с помощта на еднопосочен ANOVA с повторни мерки, последвани от post hoc тест Bonferroni. Р 1). На 9 седмици след лечението, групата, хранена с HFD (HFD-C), е била с 35% по-тежка от контролната група (Chow-C), със значително повишени маси на органи и мазнини, както и концентрации на липиден холестерол в кръвта и концентрации на NEFA (P 1). Размерът на адипоцитите се е увеличил повече от два пъти в групата с HFD-C (P 1). Нивата на кръвната глюкоза по време на IPGTT също са значително по-високи в групата с HFD-C, отколкото групата Chow-C, от 15 до 90 минути след инжектиране на глюкоза (P 1 a), с 60% по-голяма стойност на AUC (P 1 b).
а интраперитонеален тест за толерантност към глюкоза (IPGTT, глюкоза 2 g/kg), б площ под кривата (AUC) на (а), на 8 седмици лечение. Данните са изразени в средна стойност ± S.E.M. IPGTT разлика в (а) бяха анализирани с помощта на еднопосочен ANOVA с повторни мерки, последвани от post hoc тест Bonferroni. * P † P ‡ P γ P † P 1). Въпреки това, телесното тегло на HFD-LAu и HFD-HAu групите е съответно с 8 и 5% по-малко от HFD-C мишките (P 1). Размерът на мастните клетки обаче е по-голям в групата на HFD-LAu, но по-малък в групата на HFD-HAu (и двете P 1). Тези резултати предполагат ефект на понижаване на липидите от AuNP и дългосрочна безопасност и полза за черния дроб. По време на IPGTT (фиг. 1 а), групата HFD-LAu не е развила глюкозна непоносимост; докато групата HFD-HAu е имала значително подобрен глюкозен клирънс на 60–90 минути (P 1 a). AUC показва подобни промени като нивата на кръвната глюкоза и в трите HFD групи (фиг. 1 b).
Разпределение на органи на AuNP
След 9 седмици са открити следи от злато в мишките Chow-C и HFD-C (Допълнителен файл 1: Таблица S3) чрез индуктивно свързана плазмена-масспектрометрия (Допълнителен файл 1), което е наблюдавано и при хора [ 3]. И в двете групи HFD-LAu и HFD-HAu най-високата концентрация на злато е установена в коремната мастна тъкан, последвана от далака и черния дроб (P 2 a, b). От друга страна, нивото на серумния амилоид А (SAA) -1 е повече от 5 пъти това на контролните мишки, но без статистическа значимост (Фиг. 2 в). Процентът на макрофагите обаче не се променя от консумацията на HFD (фиг. 2 г). В групата на HFD-LAu нивата на експресия на TNFa и SAA-1 тРНК са значително регулирани надолу (P2a, c); както беше нивото на TLR-4 от
50% обаче без статистическа значимост (фиг. 2 б). В групата на HFD-HAu, нивата на експресия на TLR-4 и SAA-1 са значително намалени (P 2 b, c). Процентът на макрофагите е намален наполовина в групата с HFD-LAu, макар и без статистическа значимост, която не е променена в групата с HFD-HAu (Фиг. 2 г).
- Диетата с високо съдържание на мазнини засяга транспортиращите хранителни вещества в хипо и хипертиреоидни мишки от PPAR-a
- Дългосрочни ефекти от диета с много ниско съдържание на въглехидрати с периодично гладуване върху метаболитния профил в a
- Диетата с високо съдържание на мазнини и ниско съдържание на въглехидрати може да подобри мозъчната функция и паметта при възрастни възрастни; Новини-Медицински
- Диетата с високо съдържание на мазнини причинява подплодие и нарушена функция на яйчниците, независимо от затлъстяването при мишки
- Консумацията на японски гъби променя метаболомичния профил на липидите на диети, хранени с високо съдържание на мазнини -