Резюме
Въведение
Механизмите, които са в основата на печалбата от функционалните дейности на р53 мутантите, остават слабо разбрани. Някои проучвания подчертават значението на N-терминалния транскрипционно-активационен домен за експресия на мутантния p53 прираст на функционален фенотип (Lanyi et al., 1998; Lin et al., 1995). Мутантните p53s изглежда са способни да активират промотори на гени, които обикновено не се активират от дивия тип протеин. Сред тях са промотори на MDR1 (Chin et al., 1992; Dittmer et al., 1993; Kopnin et al., 1995), PCNA (Deb et al., 1992), HSP70 (Tsutsumi-Ishii et al., 1995), 15-липоксигеназа (Kelavkar и Badr, 1999), BAG-1 (Yang et al., 1999) и c-myc (Frazier et al., 1998) гени. Не е ясно дали мутантният р53 действа директно като транскрипционен фактор с променена специфичност на последователността или модифицира експресията на гените чрез взаимодействие с фактори, отговорни за положителната или отрицателната транскрипционна регулация. Като се вземе предвид колко често мисенс р53 мутантите са при рака на човека, става ясно, че разбирането на механизмите, които са в основата на това усилване на функцията, както и идентифицирането на гени, които се регулират от р53 мутанти, може да помогне при разработването на рационални стратегии за лечение на рак.
В това проучване ние показваме, че някои видове мутантни p53s са способни да индуцират експресия на гена dUTPase и в резултат на това да повишат устойчивостта на клетките към флуоропиримидинови лекарства. Това наблюдение осигурява възможен механизъм за повишена резистентност на някои злокачествени тумори към 5-FU и може да има потенциална стойност за прогнозиране на чувствителността към химиотерапия въз основа на анализ на мутантна експресия на р53.
Резултати и дискусия
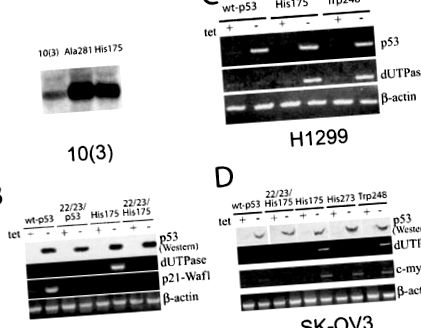
Тествахме дали експресията на различни форми на получени от тумори р53 мутанти, въведени в p53 отрицателни клетки, може да повлияе на dUTPase експресията и чувствителността към 5-FU. Конститутивната ектопична експресия на His175 и Ala281 р53 мутанти в p53-отрицателна миши клетъчна линия 10 (3) води до значително увеличаване на dUTPase транскриптите, както се вижда от Northern blot хибридизация (Фигура 1а). Този резултат е в съответствие с факта, че dUTPase кДНК клонът е присъствал във висок дял на библиотека за изваждане от 10 (3) -His175 срещу 10 (3) клетъчни линии.
Промени в dUTPase генните транскрипти в p53 отрицателни клетки след ектопична експресия на p53 мутанти. (а) Northern blot хибридизация на общата РНК (20 μg) от миши клетки 10 (3), експресиращи Ala281 и His175 р53 мутанти с маркирана мишка dUTPase cDNA сонда. (б) RT – PCR анализ на dUTPase транскриптите в миши клетки 10 (1), съдържащи тетрациклин-регулирани конструкции, експресиращи wt-p53, 22/23-p53 и 22/23/His175 p53 в присъствието (+) и след 24 часа след отстраняване (-) на 1 μg/ml тетрациклин. RT-PCR с праймери p21-Waf1 се използва като контрол за транскрипционната активност на wt-p53. Бета-актиновите праймери бяха използвани за нормализиране на кДНК пробите. (° С) RT-PCR анализ на dUTPase транскриптите в човешки белодробни карциномни клетки H1299, съдържащи регулирани с тетрациклин wt-p53, His175 p53 и Trp248 p53. RT-PCR с праймери, специфични за човешки р53, бяха използвани за контрол на индукцията на експресия на р53. (д) RT – PCR анализ на dUTPase транскриптите в клетки на човешки карцином на яйчниците SK-OV3, съдържащи регулирани с тетрациклин wt-p53, 22/23/His175 p53, His175, His273 p53 и Trp 248 p53. RT – PCR с праймери, специфични за човека c-myc са били използвани за наблюдение на експресията на един от гените, за които е известно, че се регулират от мутантни p53s
За да се тества дали може да има някои специфични ефекти върху експресията на dUTPase в зависимост от вида на мутация на p53 missense, две допълнителни мутантни p53 cDNA с мутант, получени от тумор, His273 и Trp248, бяха експресирани в p53 отрицателни клетки. Докато Trp248 р53 мутантът показва подобна индукция на dUTPase транскрипти, няма видим ефект от His273 както в SK-OV3 (Фигура 1d), така и в H1299 клетъчни линии (не е показано). Този диференциален ефект на р53 мутантите е специфичен за гена dUTPase, както c-myc, друг ген, за който е известно, че реагира на р53 мутанти (Frazier et al., 1998), се индуцира от всичките три мутанти еднакво добре (Фигура 1г). Резултатът е подобен при клетъчни линии SK-OV3 и H1299 (не са показани).
Образуване на колонии от 10 (1) клетъчни подлинии в присъствието на нарастващи концентрации на 5-FU (а) и доксорубицин (б). Образуване на колонии в присъствието на 5-FU и доксорубицин (DOX) от 10 (1) клетки (° С), H1299 клетки (д) и SK-OV3 клетки (д) с регулирана от тетрациклин експресия на р53 мутанти с (tet +) и без (tet-) тетрациклин в средата
При две p53 отрицателни човешки клетъчни линии H1299 и SK-OV3 е намерена добра корелация между способността на р53 мутантите да повишават експресията на гена dUTPase и да увеличават броя на колониите, образувани в присъствието на 150 n M от 5-FU (Фигура 2г, д). Най-силно увеличение на образуването на колонии се наблюдава при мутанта His175 p53. Друг р53 мутант, Trp248, също е способен да увеличи броя на 5-FU резистентни колонии, въпреки че ефектът е умерен. За разлика от него, мутантът на His273 р53, свръхекспресиран в SK-OV3 клетки, не произвежда нито увеличаване на dUTPase транскриптите, нито повишено оцеляване на клетките в присъствието на 150 n M 5-FU (Фигура 1г и Фигура 2д). Трябва да се отбележи, че експресията на двата р53 мутанти в тестваните клетъчни линии не води до промени в броя на колониите, образувани в присъствието на доксорубицин. Следователно ефектът не се дължи на някакво неспецифично увеличаване на клетъчната преживяемост, а се ограничава до резистентност към флуоропиримидинови лекарства.
Промени в съотношението на белязани с EGFP клетки 10 (1) и 10 (1) -His175 в смеси с немаркирани 10 (1) клетъчни подлинии, експресиращи р53 мутанти, или рекомбинантна миша dUTPase cDNA в смисъл и антисенс. Белязаните и немаркираните клетки се смесват 50:50 преди третиране с 5-FU (вж. Материали и методи). Делът на белязаните с EGFP клетки се определя чрез FACScan
Материали и методи
Клетъчни линии
Всички клетъчни линии се отглеждат в DMEM, допълнен с 10% FBS при 37 ° С и 5% CO2. Миши p53-нулеви фибробластни клетъчни линии 10 (3) (Harvey and Levine, 1991) с въведени His175 и Ala281 р53 мутанти под контрол на MuMLV LTR са описани по-рано (Pugacheva et al., 2000). За експресия на р53 мутанти, регулирана от тетрациклин, мишки 10 (1) и 10 (3) (Harvey and Levine, 1991) и човешки SK-OV3 (ATTC HTB-77) и NCI-H1299 (ATCC CRL-5803) p53-null клетъчните линии бяха заразени за първи път с ретровирусен вектор pPS-tTA-hygro, експресиращ тетрациклин-зависим трансактиватор протеин tTA (Gossen и Bujard, 1992). Избрани функционални tTA експресиращи клонове бяха заразени със самоинактивиращи се ретровирусни вектори (pSIT-neo), носещи различни мутантни p53s (His175, Trp248, His273, Leu22/Trp23, His175/Leu22/Trp23) под контрола на тетрациклинозависим промотор. Избрани са устойчиви на G418 култури и се поддържат в присъствието на 250 ng/ml доксициклин за потискане на експресията на р53. За индукция на експресията на р53, клетките се инкубират в среда без доксициклин в продължение на 24-48 часа.
Western blot анализ
Клетките се промиват два пъти с PBS, изстъргват се от чашките на Петри в студен PBS, последвано от кратко центрофугиране. 10 (1) клетъчни пелети бяха лизирани в буфер (50 m M Tris-HCl рН 7.5, 150 m M NaCl, 0.5% NP-40 и 1 m M EDTA с добавяне на 1 m М дитиотреитол, 100 μ M PMSF, 1 μ M пепстатин A и 1 μ M E64). SK-OV3 и H1299 клетъчните пелети бяха лизирани в RIPA буфера. Равни количества от общия протеин (приблизително 600 μg) бяха използвани за имунопреципитация през нощта с р53 специфични моноклонални антитела PAb421, омрежени към протеин A-Sepharose CL4B при 4 ° C. Утаените протеини се разделят на 10% SDS-PAAG електрофореза, прехвърлят се върху мембраната на Immobilon-P (Millipore), сондират се с р53 специфични моноклонални антитела PAb421 и се разработват с помощта на конюгирани с пероксидаза антимиши IgG и ECL-Plus Western blot реагенти (Amersham).
Северна хибридизация
Общата РНК се изолира с реагент Trizol (GIBCO – BRL). Разделянето върху 1% агарозен гел, капилярен трансфер към мембрана Hybond-N и хибридизация със съответните 32 Р-маркирани cDNA сонди се извършват съгласно публикувани протоколи (Sambrook et al., 1989). Всяка проба, приложена върху гел, съдържа 20 μg обща РНК. DUTPase cDNA, използвана като сонда, е получена чрез RACE PCR.
Полуколичествена RT – PCR
cDNA се синтезира върху 5 μg обща РНК, с олиго- (dT) 18–23 праймер и AMV обратна транскриптаза, съгласно препоръките на производителя (Amersham PLC). PCR амплификации бяха извършени с праймери, които дават 126 bp фрагмент от кДНК на dUTPase на мишката: 5′-AGCATTTGGTGTTCTAGGATGCAGGA; 5′-ACCAAGTCTGCATGTCAATGCCATGCTC; 520 bp фрагмент от човешка dUTPase кДНК: 5′-CGGGATCCCGCCTTCTGGCTCTGCCATGCCCTGC-3 ′; 5′-GGAATTCGCATAAATTTTAATTCTTTCCAGTG-3 ′; 5′-GGAATTCGCATAAATTTTAATTCTTTCCAGTG-3 ′, 278 bp фрагмент от мишка p21-WAF1 cDNA: 5′-CCGAGAACGGTGGAACTTTGA; 5′-GTTTTCGGCCCTGAGATGTTG; 589 bp фрагмент от човешки c-myc cDNA: 5′-AAGATGAGGAAGAAAACGATGTTG; 5′-ACATTTCTGTTAGAAGGAATCGT; и 604 bp фрагмент, съответстващ на бета-актиновата кДНК: 5′-AAGATGACCCAGATCATGTTTGAGACC; 5′-GCAGTAATCTCCTTCTGCATCCTGTCA. Амплификацията се извършва с HotTub ДНК полимераза (Amersham) в продължение на 20, 25 и 30 цикъла. PCR продуктите се разделят чрез електрофореза в агарозен гел.
Препратки
Aherne GW, Browne S. 1999 г. Ръководство за развитие на противоракови лекарства: Антифолатни лекарства в терапията на рака Джакман АЛ (изд.) Тотова, Ню Джърси: Humana Press, Inc стр. 409–421
Benhattar J, Cerottini JP, Saraga E, Metthez G, Givel JC. 1996 г. Международна J. Рак 69: 190–192
Blandino G, Levine AJ, Oren M. 1999 г. Онкоген 18.: 477–485
Bottini A, Berruti A, Bersiga A, Brizzi MP, Brunelli A, Gorzegno G, DiMarco B, Aguggini S, Bolsi G, Cirillo F, Filippini L, Betri E, Bertoli G, Alquati P, Dogliotti L. 2000 г. Clin. Рак Res. 6: 2751–2758
Bunz L, Hwang PM, Torrance C, Waldman T, Zhang Y, Dillehay L, Williams J, Lengauer C, Kinzler KW, Vogelstein B. 1999 г. J. Clin. Инвестирам. 104: 263–269
Cabelguenne A, Blons H, de Waziers I, Carnot F, Houllier AM, Soussi T, Brasnu D, Beaune P, Laccourreye O, Laurent-Puig P. 2000 г. J. Clin. Онкол. 18.: 1465–1473
Canman CE, Radany EH, Parsels LA, Davis MA, Lawrence TS, Maybaum J. 1994 г. Рак Res. 54: 2296–2298
Chin KV, Ueda K, Pastan I, Gottesman MM. 1992 г. Наука 255: 459–462
Deb S, Jackson CT, Subler MA, Martin DW. 1992 г. J. Virol. 66: 6164–6170
Dittmer D, Pati S, Zambetti G, Chu S, Teresky AK, Moore M, Finlay C, Levine AJ. 1993 г. Нат. Genet. 4: 42–46
Donehower LA, Harvey M, Slagle BL, McArthur MJ, Montgomery Jr CA, Butel JS, Bradley A. 1992 г. Природата 356: 215–221
el-Deiry WS. 1998 г. Семин. Рак Biol. 8: 345–357
Frazier MW, He X, Wang J, Gu Z, Cleveland JL, Zambetti GP. 1998 г. Мол. Клетка. Biol. 18.: 3735–3743
Gloushankova N, Ossovskaya V, Vasiliev J, Chumakov P, Kopnin B. 1997 г. Онкоген 15: 2985–2989
Gossen M, Bujard H. 1992 г. Proc. Natl. Акад. Sci. САЩ 89: 5547–5551
Greenblatt MS, Bennett WP, Hollstein M, Harris CC. 1994 г. Рак Res. 54: 4855–4878
Харви DM, Levine AJ. 1991 г. Гени Dev. 5: 2375–2385
Hsiao M, Low J, Dorn E, Ku D, Pattengale P, Yeargin J, Haas M. 1994 г. Am. J. Pathol. 145: 702–714
Kelavkar UP, Badr KF. 1999 г. Proc. Natl. Акад. Sci. САЩ 96: 4378–4383
Kopnin BP, Stromskaya TP, Kondratov RV, Ossovskaya VS, Pugacheva EN, Rybalkina EY, Khokhlova OA, Chumakov PM. 1995 г. Онкол. Рез. 7: 299–306
Kremenetskaya OS, Logacheva NP, Baryshnikov AY, Chumakov PM, Kopnin BP. 1997 г. Онкол. Рез. 9: 155–166
Ladner RD, Lynch FJ, Groshen S, Xiong YP, Sherrod A, Caradonna SJ, Stoehlmacher J, Lenz HJ. 2000 г. Рак Res. 60: 3493–3503
Lanyi A, Deb D, Seymour RC, Ludes-Meyers JH, Subler MA, Deb S. 1998 г. Онкоген 16.: 3169–3176
Levine AJ. 1997 г. Клетка 88: 323–331
Levine AJ, Wu MC, Chang A, Silver A, Attiyeh EF, Lin J, Epstein CB. 1995 г. Ан. Ню Йорк акад. Sci. 768: 111–128
Li R, Sutphin PD, Schwartz D, Matas D, Almog N, Wolkowicz R, Goldfinger N, Pei H, Prokocimer M, Rotter V. 1998 г. Онкоген 16.: 3269–3277
Lin J, Teresky AK, Levine AJ. 1995 г. Онкоген 10: 2387–2390
Lindhal T. 1982 г. Ану. Rev. Biochem. 51: 61–87
Liu G, McDonnell TJ, Montes de Oca Luna R, Kapoor M, Mims B, El-Naggar AK, Lozano G. 2000 г. Proc. Natl. Акад. Sci. САЩ 97: 4174–4179
Lotem J, Sachs L. 1995 г. Proc. Natl. Акад. Sci. САЩ 92: 9672–9676
Matas D, Sigal A, Stambolsky P, Milyavsky M, Weisz L, Schwartz D, Goldfinger N, Rotter V. 2001 г. EMBO J. 20.: 4163–4172
Michalovitz D, Halevy O, Oren M. 1991 г. J. Cell Biochem. 45: 22–29
Peled A, Zipori D, Rotter V. 1996 г. Рак Res. 56: 2148–2156
Пугачева Е.Н., Снегур И.Н., Копнин Б.П., Чумаков П.М. 2000 г. Мол. Biol. 34: 143–151
Sambrook J, Fritsch E, Maniatis T. 1989 г. Молекулярно клониране Ню Йорк: Cold Spring Harbor Laboratory Press
Sionov RV, Moallem E, Berger M, Kazaz A, Gerlitz O, Ben-Neriah Y, Oren M, Haupt Y. 1999 г. J. Biol. Chem. 274: 8371–8374
Sun Y, Nakamura K, Wendel E, Colburn N. 1993 г. Proc. Natl. Акад. Sci. САЩ 90: 2827–2831
Tsutsumi-Ishii Y, Tadokoro K, Hanaoka F, Tsuchida N. 1995 г. Клетъчният растеж се различава. 6: 1–8
Wolf D, Harris N, Rotter V. 1984 г. Клетка 38: 119–126
Ян Х, Патер А, Танг СК. 1999 г. Онкоген 18.: 4546–4553
Zheng M, Wang H, Zhang H, Ou Q, Shen B, Li N, Yu B. 1999 г. J. Рак Res. Clin. Онкол. 125: 357–360
Информация за автора
Елена Н Пугачева
Настоящ адрес: Център за рак на Fox Chase, 7701 Burtholme Avenue, Филаделфия, 19111, Пенсилвания, Пенсилвания, САЩ
Алексей V Иванов & Петър М Чумаков
Настоящ адрес: Катедра по молекулярна биология, Изследователски институт на Лернер, Фондация Клиника Кливланд, 9500 Euclid Avenue, Кливланд, 44195, Охайо, Охайо, САЩ
Арнолд Джей Левин
Настоящ адрес: Университет Рокфелер, 1230 Йорк Авеню, Ню Йорк, 10021, Ню Йорк, САЩ
Принадлежности
Институт по молекулярна биология Енгелхард, Руска академия на науките, ул. Вавилов 32, Москва, 117984, Русия
Елена Н Пугачева, Джулия Е Кравченко и Петър М Чумаков
Катедра по молекулярна генетика, Университет на Илинойс в Чикаго, Чикаго, 60607, Илинойс, Илинойс, САЩ
Алексей V Иванов & Петър М Чумаков
Институт по ракогенеза, Руски център за изследване на рака, Москва, Каширское шосе 24, Москва, 115478, Русия
Катедра по молекулярна биология, Принстънския университет, Принстън, Ню Джърси, САЩ
Елена Н Пугачева и Арнолд Джей Левин
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Автора за кореспонденция
Права и разрешения
Относно тази статия
Цитирайте тази статия
Пугачева, Е., Иванов, А., Кравченко, Дж. и др. Ново усилване на функционалната активност на р53 мутанти: активиране на експресията на dUTPase ген, водещо до резистентност към 5-флуороурацил. Онкоген 21., 4595–4600 (2002). https://doi.org/10.1038/sj.onc.1205704
Получено: 02 януари 2002 г.
Ревизиран: 15 май 2002 г.
Приет: 22 май 2002 г.
Публикувано: 05 юли 2002 г.
Дата на издаване: 11 юли 2002 г.
Ключови думи
- мутант p53
- резистентност към лекарства
- печалба от функция
Допълнителна информация
Непролиферативна роля на метаболизма на пиримидин при рак
Молекулярен метаболизъм (2020)
miR ‐ 200b ‐ 3p смекчава резистентността към оксалиплатин чрез насочване на TUBB3 при колоректален рак
- Ю ‐ Жу Жу
- , Хонг-Юе Лин
- , Ин Джан
- & Уен-Фа Чен
Вестник на генната медицина (2020)
Към преодоляване на противоракова лекарствена резистентност, медиирана от р53 мутации
- Син Цао
- , Jiayun Hou
- , Куанлин Ан
- , Йехуда Г. Асараф
- & Xiangdong Wang
Актуализации за резистентност към лекарства (2020)
Екзозомният трансфер на p-STAT3 насърчава придобитата 5-FU резистентност в колоректалните ракови клетки
- Цян Джанг
- , Rui-Xian Liu
- , Ка-Уо Чан
- , Jiancong Hu
- , Jingdan Zhang
- , Лили Вей
- , Хуйлиу Тан
- , Ксианглинг Ян
- & Huanliang Liu
Списание за експериментални и клинични изследвания на рака (2019)
Мутант p53R248Q понижава регулирането на окислителното фосфорилиране и регулира гликолизата при нормоксия и хипоксия в ракови клетки на човешка шийка
- Илеана Хернандес-Ресендис
- , Хуан Карлос Галардо-Перес
- , Амбар Лопес-Макай
- , Даяна Xochiquetzal Robledo-Cadena
- , Енрике Гарсия-Вила
- , Патрисио Гарильо
- , Ема Сааведра
- , Рафаел Морено-Санчес
- & Сара Родригес-Енрикес
Списание за клетъчна физиология (2019)
- Специфичните за пола промени в генната експресия в отговор на затлъстяването са свързани с различни FGF21
- Намаляването на инсулина чрез условна частична генна аблация при възрастни обръща индуцирано от диетата наддаване на тегло
- Предотвратяване на наддаване на тегло Здравословно тегло, хранене и физическа активност CDC
- Синтез, активност и структура-активност Изследвания на взаимоотношенията на новите катионни липиди за ДНК
- Учените идентифицират ген, свързан с тънкостта, който може да помогне да се противопоставят на наддаването на тегло - ScienceDaily